1. 引言
在草地生态系统中,土壤中微生物的分布与种类,既反映了土壤因素对微生物的影响,同时由于微生物的生物化学活性,也影响着土壤肥力、草地植物生长发育 [1] [2]。青藏高原高寒草地土壤环境因其独特的环境特征,如持续寒冷、季节性低温和昼夜温差大等,对草地纤维素分解真菌的分布和数量产生了重要影响。
纤维素分解菌是近年来的研究热点,目前国内已经对农作物秸秆、家畜瘤胃、堆肥、动物肠道、城市垃圾等环境中的纤维素分解菌的筛选做了比较全面的研究,取得丰硕的成果 [3] [4],但缺乏对高寒草地纤维素分解菌的研究。高寒草地土壤纤维素分解菌作为草地生态系统的重要组成部分,具有独特的生存方式和生态适应性 [5],查明其数量及其组成情况,无疑是十分必要 [6]。
氮源是微生物生长必需的营养物质,也是影响微生物产纤维素酶活性的重要因素 [7],因此,本论文试图探索在不同氮源条件下,进行分离和筛选纤维素分解真菌,并对筛选出的纤维素分解真菌的群落结构进行分析 [8],为了解高寒草地土壤纤维素分解真菌资源的分布状况,探索适合高寒地区最佳的筛选方法,研究地区土壤纤维素分解真菌的筛选提供科学依据。
2. 材料与方法
2.1. 样点选择和样品采集
研究区域主要在青藏高原高寒草地进行,样品主要采自青海省囊谦县地区和西藏藏北地区。2011年7~8月根据地形、地貌、海拔、植被等生境特征,选取有代表性的4类草地确定采样点。4类草地分别为:禾草草地(Grass grassland)、沼泽草地(Swamp grassland)、灌丛草地(Shrub grassland)和嵩草草地(Kobresia grassland)。野外用GPS定位,土壤样品的采集采用土壤剖面法和混合多点取样法 [9] 采取0~15 cm土层,样品用灭菌自封聚乙烯袋收集,运输过程中采用便携式冰箱低温条件下带回实验室分析。
2.2. 土壤纤维素分解真菌的分离和纯化
分离采用稀释平板法 [10]。灭菌的含不同氮源的羧甲基纤维素钠选择性培养基冷却至45℃左右时,加入链霉素达到终浓度30 μg/ml,倒入培养皿凝固。每皿加入100 μL稀释100倍并充分摇匀的土壤悬浮液,涂抹均匀,每个土样重复3皿。25℃生化培养箱培养3~5 d,肉眼观察,根据真菌菌落形态,统计各真菌(属级)在培养皿中的菌落数目。并挑取单孢至PDA培养基上进行分离与纯化,进行拍照、形态描和初步鉴定。
2.3. 实验设计和处理
在羧甲基纤维素钠平板培养基(CMC-Na)的基础上,分别选用硝酸钠、硫酸铵及蛋白胨作为不同的氮源改进培养基配方,进行单一无机氮源、单一有机氮源和组合氮源的实验处理,筛选高寒草地土壤中的纤维素分解真菌。
操作过程:称取1 g土样(精确到0.001 g),置于盛有99 ml无菌水(加玻璃珠20颗)的三角瓶中,在摇床上以150 rpm振荡30分钟,制成菌悬液,在静止10 min后吸取上清夜1 ml加入含9 ml无菌水的试管中,按照稀释分离程序制成不同浓度梯度的菌悬液10−1和10−2;取0.2 ml悬液于灭菌的培养皿中,再倒入培养基轻轻摇晃,每稀释度设3个重复,在25℃温箱中培养(一般为72 h),待菌落长成后,在平板内进行计数,并按菌落的不同特征归类,编号,然后将菌落特征不同的真菌转入至PDA斜面培养基进行培养,分离、纯化后保存备用。
2.3.1. 平板培养基
1. 单一氮源培养基
① 平板培养基一:NaNO3 2.5 g (无机单一氮源培养基) (编号为N1)
羧甲基纤维素钠(CMC-Na) 10 g;MgSO4 0.5 g;K2HPO4 1 g;NaCl 0.5 g;琼脂15 g;FeSO4 0.01 g;CaCl2 0.1 g;蒸馏水1000 ml;pH值用稀盐酸调至6.0~7.0 [11]。
② 平板培养基二:(NH4)SO4 2.5 g (无机单一氮源培养基) (编号为N2)
羧甲基纤维素钠(CMC-Na) 10 g;MgSO4 0.5 g;K2HPO4 1 g;NaCl 0.5 g;琼脂15 g;FeSO4 0.01 g;CaCl2 0.1 g;蒸馏水1000 ml;pH值用稀盐酸调至6.0~7.0 [11]。
③ 平板培养基三:蛋白胨2.5 g (有机单一氮源培养基) (编号为N3)
羧甲基纤维素钠(CMC-Na) 10 g;MgSO4 0.5 g;K2HPO4 1 g;NaCl 0.5 g;琼脂15 g;FeSO4 0.01 g;CaCl2 0.1 g;蒸馏水1000 ml;pH值用稀盐酸调至6.0~7.0 [11]。
2. 单一氮源培养基
① 氮源变化组合:
将蛋白胨、硫酸胺和硝酸钠分别组合成不同比例的培养基(见表1),进行纤维素分解真菌的筛选。

Table 1. Nitrogen source change combination
表1. 氮源变化组合
② 常量营养物质:
羧甲基纤维素钠(CMC-Na) 10 g;MgSO4 0.5 g;K2HPO4 1 g;NaCl 0.5 g;琼脂15 g;FeSO4 0.01 g;CaCl2 0.1 g;蒸馏水1000 ml;pH值用稀盐酸调至6.0~7.0 [11]。
2.3.2. 马铃薯葡萄糖(PDA)培养基
马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1000 ml (分装到试管,每管约20 ml,在121℃下灭菌30 min备用)。在实验中,主要用于真菌菌株的转接、分离和纯化。
2.4. 群落结构特征分析
2.4.1. 物种丰富度(Species Richness)
即群落中的物种数,在此指各生境采集的土壤样品中分离得到的纤维素分解真菌的属级物种数,以S表示 [12]。
2.4.2. 种群优势度(Dominance)
以Berger-Parker优势度指数(di) [12] 计算:di = Ni/N;式中:N为物种总数,Ni为第i物种个体总数(本文中以属为单位统计菌落数)。
2.4.3. 物种多样性
以Shannon-Wiener [12] 计算
多样性指数公式表示:
式中:
为物种的多样性指数,S为物种(本文中为属级分类单位,下同)总数,Pi为第i种物种个体数占群落总个体数的比例。
2.4.4. 物种均匀度采用Pielou指数(Pielou 1966) [13]
测定公式:
;式中:J为均匀度,
为Shannon-Wiener多样性指数,S为物种总数。
2.4.5. 相似性分析采用Jaccard (1901)系数公式
;式中:J为群落A与群落B共有的物种数,a为群落A含有的全部物种数,b为群落B含有的全部物种数。
2.4.6. 数据统计分析方法
统计分析用EXCEL 2003和DPS 3.01统计分析软件进行。
3. 结果与分析
3.1. 不同氮源条件下纤维素分解真菌的物种数和菌落数量
3.1.1. 单一氮源条件下纤维素分解真菌的物种数和菌落数量
通过图1可以看出,不同氮源条件下平板培养基上分离的菌落数和物种数均不同,其中以硝酸钠为无机单一氮源的培养基,分离出的纤维素分解真菌的物种数和菌落数最少,而采用蛋白胨为有机单一氮源的培养基,分离出的纤维素分解真菌的物种数和菌落数最多,采用硫酸铵的培养基却能够使菌落在培养皿内的形态更加清晰。由此说明高寒草地不同生境的土壤中纤维素分解真菌对有机氮源蛋白胨的利用能力优于无机氮源硝酸钠和硫酸铵,对硝酸钠的利用能力最弱。在单一氮源条件下,筛选到的高寒草地土壤中纤维素分解真菌中以高寒草甸中的物种数和菌落数最多,在整个草地系统中占优势。总体,物种和数量的多少排序依次为:高寒草甸 > 灌丛 > 藏嵩草草甸 > 高寒草原。
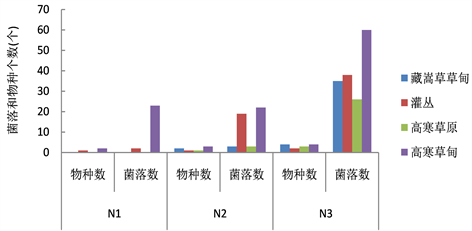
Figure 1. The number of species and colonies of cellulose decomposing fungi under a single nitrogen source
图1. 单一氮源条件下纤维素分解真菌的物种数和菌落数量
3.1.2. 复合氮源条件下纤维素分解真菌的物种数和菌落数量
通过图2可以看出,在复合氮源条件下平板培养基上分离的菌落数和物种数亦不同,以硝酸钠1 g,硫酸铵1 g,蛋白胨5 g,为氮源的第7种组合培养基上,分离出的纤维素分解真菌的物种数和菌落数最丰富,在复合氮源条件下,筛选到的高寒草地土壤中纤维素分解真菌以高寒草甸中物种数和菌落数量最多,在整个草地系统中占优势。总之,物种和数量的多少排序依次为:高寒草甸 > 灌丛 > 藏嵩草草甸 > 高寒草原。
3.2. 不同氮源条件下纤维素分解真菌的分离频率和相对多度
从表2中可以看出,在复合氮源条件下平板培养基上纤维素分解真菌物种数较多,其中以a和b菌株为优势属,h为最常见属,e、d和z作为常见属在筛选过程中出现的频率较高,其他菌种均为高寒草地土壤中的稀有属。总而言之,高寒草地土壤中纤维素分解真菌物种和数量比较多,因而使真菌群落多样性与草地植被群落构成之间的关系问题相对较复杂,具有较大的研究空间。
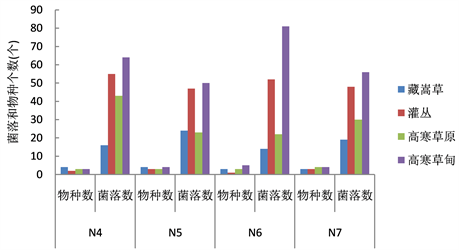
Figure 2. The number of species and colonies of cellulose decomposing fungi under the condition of compound nitrogen source
图2. 复合氮源条件下纤维素分解真菌的物种数和菌落数量


Table 2. Frequency and abundance of cellulose decomposing fungi under different nitrogen sources
表2. 不同氮源条件下纤维素分解真菌的频率和多度
3.3. 不同氮源条件下纤维素分解真菌群落多样性
根据表3可以看出,在不同氮源条件下,采用蛋白胨为有机单一氮源的培养基(N3)培养纤维素分解真菌群落的多样性指数、物种均匀度指数最大,指数均匀且差异显著(P < 0.01),采用NaNO3为有机单一氮源的培养基(N1)培养纤维素分解真菌群落的物种丰富度、物种个体总数、多样性指数和物种均匀度指数最小,由此可见,在不同氮源条件下,物种多样性不同。

Table 3. Community diversity of cellulose decomposing fungi under different nitrogen sources
表3. 不同氮源条件下纤维素分解真菌群落多样性
3.4. 不同氮源条件下纤维素分解真菌群落相似性分析
根据Jaccard相似性系数原理,当Cj值为0.00~0.25时,为极不相似;当Cj值为0.25~0.75时,为中等相似;当Cj值为0.75~1.00时,为极相似 [14]。
由表4可以看出,不同氮源水平下筛选出的真菌种类不同。N3和N4条件下分离出的纤维素分解真菌的群落相似性系数最大,N6和N7两种复合氮源的条件下分离出的纤维素分解真菌的群落相似性系数最大,为0.75,达到了极相似的水平,这说明这两种复合氮源条件下纤维素分解真菌种类组成的相似性最大,具有更多的共同物种,从而可以推知N6和N7两种复合氮源对分离筛选纤维素分解真菌有一定的相似性。这可能与培养基的营养有关。N4和N6,以及N4和N7的相似性系数最小,为0.5,显然两种复合氮源条件下的种类组成上的不相似是由于二者之间环境条件的不同所致。

Table 4. Similarity analysis of cellulose decomposing fungal community under different nitrogen sources
表4. 不同氮源条件下纤维素分解真菌群落相似性分析
4. 结论与讨论
当在其他培养条件一致时,不同氮源组合培养基培养的样品同单一氮源培养基培养的样品相比,筛选出的纤维素分解真菌的多样性指数、物种均匀度指数不同;有机氮源表现的更为明显,筛选出的物种数和菌落数较多,其菌群结构和组成有很大的差异,这可能也是由于两种培养基营养成分的差异而引起的,因为氮源组合培养基相对单一氮源培养基营养要丰富的多,目前大多数分离培养纤维素分解菌常常会用到CMC的不同氮源培养基,而CMC的单一氮源培养基营养成分少且单一,它所培养的菌一直会处在低营养状态。因此,在分离培养纤维素分解真菌的时候,采用复合氮源培养基对样品进行培养,应该是一个比较好的选择。但是,对于存在于土壤环境中的纤维素分解真菌而言,土壤环境是个复杂的大环境,基本不会对土壤纤维素分解真菌的生长、发育和繁殖产生局限,在土壤环境中可肆意获取自身生长、发育和繁殖所必须的营养物质 [14];而在实验条件下,给予土壤纤维素分解真菌的只是固定的营养物质,与土壤环境存在较大的差异,因此在未来的研究中,应尽可能地模拟微生物生存的真实环境,以筛选更多具有较高酶活的优良纤维素分解真菌的菌株 [15]。