摘要:
本文以蒜头果(Malania oleifera)种子为研究材料,通过高相液相色谱法建立一种快速测定蒜头果种子中神经酸含量的方法。采用Aglient C-18 ODS柱(250 mm × 4.6 mm, 5 μm)色谱柱,以甲醇:乙腈:四氢呋喃:0.4%乙酸水溶液(体积比为10:80:5:5)为流动相,检测波长为205 nm,流速1.0 mL/min,柱温25℃,进样量10 μL。结果显示蒜头果中神经酸的浓度在1 mg/mL~10 mg/mL范围内与峰面积呈现良好的线性关系,相关系数R = 0.9984,并且精密度、稳定性、重复性的RSD均<3.0%,平均加样回收率为98.2%,RSD为1.36%。表明该方法准确,重复性好,能够适用于蒜头果中神经酸含量的快速检测。
Abstract:
A method for the rapid determination of the content of nervonic acid in the seeds of Malania oleifera was established by High Performance Liquid Chromatography (HPLC). Nervonic acid was separated by Agilent C-18 ODS column (250 mm × 4.6 mm, 5 μm), using methanol:acetonitrile:tetra- hydrofuran:0.4% acetic acid (volume ratio 10:80:5:5) was used as mobile phase, the detection wavelength was 205 nm, the flow rate was 1.0 mL/min, the column temperature was 25℃, and the injection volume was10 μL. The results show that the concentration of nervonic acid in the range of 1 mg/mL - 10 mg/mL showed a good linear relationship with the peak area, and the correlation coefficient was R = 0.9984, and the RSD of precision, stability and repeatability were all < 3.0%, the average recovery rate was 98.2%, and the RSD was 1.36%. The method is accurate and reproducible, and can be used for rapid determination of the content of nervonic acid in the seeds of M. oleifera.
1. 引言
神经酸,是一种对人体有益的长链单不饱和脂肪酸,分子式为C24H46O2。提纯后的神经酸在常温下为白色片状晶体,溶于醇而不溶水。因最早从鲨鱼脑组织中分离,故又称为鲨鱼酸。二十世纪七十年代,Sinclar等发现当鲨鱼的脑部受伤后具自行修复的能力,后证明神经酸可以修复鲨鱼受损后大脑神经组织 [1]。神经酸是迄今为止世界上发现的能促进受损神经组织修复和再生的特效物质,是神经细胞特别是大脑细胞、视神经细胞、周围神经细胞生长、再发育和维持的必需“高级营养素”,对提高脑神经的活跃程度,防止脑神经衰老有很大作用。大家都知道大脑神经系统由白质,灰质组成,任何一方面的缺乏或病变都会引起严重后果神经酸作为白质的组成成分,它的缺乏将导致大脑的损伤。况且人体自身很难生成,只能靠体外摄取来补充,复合神经酸的摄入对推迟人体衰老有相当疗效。人体衰老往往是从脑的衰老开始的,大脑的衰老也往往是从白质缺少引起的,当摄入神经酸后,大脑白质得到及时补充,神经元细胞的生物膜组成、结构和功能得到改善,提高了细胞活力 [2]。
神经酸作为大脑神经组织和神经细胞的核心成分,具有促进神经细胞增殖和分化、活跃脑细胞延缓大脑老化、调节血脂血糖等功能。通过研究超长脂肪酸的基因学和代谢发现,饮食中摄入体内的神经酸含量大小能影响基因表达从而体内脂肪以及能量的代谢受到改变 [3]、精神错乱(psychosis)和注意力缺陷障碍(attention deficit disorder) [4] 等神经系统疾病也与体内神经酸含量相关。神经酸的多种生理药理活性在医学领域上所含价值极高 [5]。例如提高婴幼儿智力水平 [6]、治疗阿兹海默病 [7] 和身体免疫缺乏性疾病 [8] 等。鲨鱼为国际性保护动物,从动物体中获取神经酸这一方法受到严重限制,因此从植物中提纯神经酸收到广泛关注。
截至目前,我国植物中神经酸含量达到2%以上的植物有15种 [9],其中10种木本植物中蒜头果神经酸物质含量最高,种仁含油率高达 60%以上,种子富含的油脂经皂化后含40%~50%的神经酸 [10]。蒜头果为铁青树科(Olacaceae)蒜头果属(Malania)常绿乔木,又名马兰后、山桐果、猴子果等,国家二级重点保护野生植物,是中国特有的古老木本油料树种。作为中国特有的单种属植物之一蒜头果,自然分布区域狭窄,仅少量生长于广西西部山区和云南东部地带 [11]。狭窄的自然分布区域导致种群数量少,由于早些年保护不当促使消失速度加快 [12]。蒜头果幼苗生长周期缓慢且成活率极低,因此被《中国植物红皮书》列为需要保护的稀有物种 [13]。高效液相色谱法作为药典中发展最快的分析方法,具有速度快,重复性高,分辨率高等优点。被妥善保存的色谱柱可反复使用;样品又不易被破坏,易于回收再利用。本文通过以蒜头果种仁为原料提取神经酸的制备工艺,再利用高效液相色谱仪法直接测定蒜头果油中神经酸含量,具有实验操作方便、时间短等优点,为蒜头果油神经酸的开发利用提供参考。
2. 材料与方法
2.1. 实验材料与仪器
实验材料:蒜头果种子采自云南广南。
试剂:乙醇溶液:天津市科密欧化学试剂有限公司。
甲醇(色谱纯):韩国SK。
乙腈(色谱纯):韩国SK。
冰醋酸(色谱纯):天津市富宇精细化工有限公司。
四氢呋喃(色谱纯):天津市科密欧化学试剂有限公司。
石油醚(分析纯):天津市富宇精细化工有限公司。
神经酸标准品:Sigma-Aldrich有限公司。
仪器:Waters 717型高效液相色谱仪:美国Waters公司。
BSA124S-CW电子天平:赛多利斯科学仪器(北京)有限公司。
磁力搅拌水浴锅:常州金坛良友仪器有限公司。
TGL-20M高速离心机:湖南湘仪实验室仪器开发有限公司。
数控超声仪:昆山超声仪有限公司。
RE52A旋转蒸发仪:上海亚荣生化仪器厂。
精密微量移液器:德国Eppendorf公司。
2.2. 神经酸样品的制备
2.2.1. 蒜头果种子油的提取
将蒜头果种子去壳,风干除杂,果仁切薄片,低温烘干后人工切碎至粉末状备用。用索氏提取法,将粉碎烘干后的蒜头果仁粉与石油醚采取比例为1:14,温度为75℃,充分浸提8 h。采用旋转蒸发仪器浓缩,除去石油醚,剩余澄清油状黄色液体并有独特的油脂芳香气味,为蒜头果种子油。
2.2.2. 蒜头果种子油的皂化与甲酯化
按文献 [14] 中的方法进行皂化和甲酯化。皂化:精密称取20 g蒜头果油放入150 ml三角烧瓶中,加入质量分数为20 %的氢氧化钠溶液40 ml。在90℃恒温水浴锅中持续不断搅拌4 h进行皂化。
甲酯化:将皂化完的蒜头果油溶液中加入一定量的浓度为10%的稀硫酸不断搅拌调至pH为2,在放入90℃恒温水浴锅水中连续不断搅拌2 h后再将蒜头果油静置冰箱5 h,水洗上层油脂至中性。既得到混合脂肪酸。
2.2.3. 神经酸样品的纯化与除盐
精密称取一定量的蒜头果油皂化酸化所得混和脂肪酸,加入两倍质量的无水乙醇使其充分溶解,冷却至常温。将其置于5℃冰箱中静置5 h,取出抽滤后,再次加入两倍质量的无水乙醇,置于5℃冰箱中静置5 h,抽滤后即得结晶的神经酸初级样品。
称取0.5 g结晶的神经酸初级样品充分溶解于150 ml三氯甲烷中,倒入分液漏斗中,再加入80 ml蒸馏水并适量振荡。常温静置24 h后收集下层浑浊溶液,置于40℃旋转蒸发仪旋蒸至无明显液体,冷却至常温,置于冰箱8 h,瓶中结晶,为提纯除盐后的神经酸样品。
2.2.4. 神经酸样品的配制
精密称取上述0.1 g除盐后的神经酸样品,加入5 ml甲醇溶解,摇匀,在室温下,12000转/分离心10分钟,取上层清液,用0.22 μm微孔滤膜过滤,滤液用10 mL容量瓶定容,备用。
2.3. 神经酸标准溶液的配制及标准曲线的绘制
精密称取1 g神经酸标准品溶于色谱纯甲醇中,摇匀并定容于100 ml的容量瓶中,即为10 mg/ml神经酸标准母液。
精密吸取母液1 mL、2 mL、3 mL、4 mL、5 mL、6 mL、7 mL、8 mL、9 mL和10 mL于10 mL容量瓶中,以色谱纯甲醇为溶剂定容、摇匀。按照选定的色谱条件,分别对不同浓度的标准溶液进样分析,每样重复测定3次。分别以质量浓度X为横坐标,峰面积值Y为纵坐标,绘制标准曲线,得到神经酸的回归方程。
2.4. 色谱条件
色谱柱:Aglient C-18 ODS柱(250 mm × 4.6 mm, 5 μm)。
流动相:甲醇–乙腈–四氢呋喃–0.4%乙酸水溶液,其体积比为10:80:5:5。
流速:1.0 mL/min;柱温:25℃;检测波长:205 nm;进样量:10 μL。
2.5. 数据分析
采用Microsoft Office Excel 2010软件对数据进行统计分析和相对标准偏差计算。
3. 结果与分析
3.1. 神经酸的标准曲线
按照上述色谱条件,分别测定2.3中所配制的各个浓度下的标准品溶液,将所得数据以神经酸色谱峰面积和对应的质量浓度进行线性回归分析,绘制出如图1所示的神经酸标准曲线,其线性回归方程:Y = 967.08 X + 237.76,R2 = 0.9984。
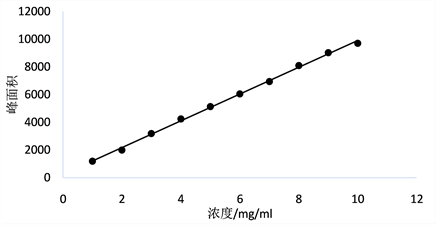
Figure 1. Standard graph of nervonic acid
图1. 神经酸标准曲线图
由图1可知,神经酸在1 mg/mL~10 mg/mL范围内具有良好的线性关系。在此色谱条件下神经酸的出峰时间约为8 min,峰形良好。神经酸标准品色谱图如图2所示。
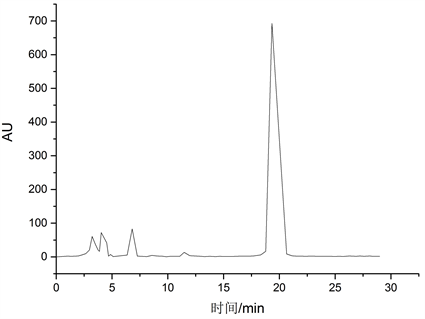
Figure 2. Chromatograms of standard of nervonic acid
图2. 神经酸标准品色谱图
3.2. 精密度实验
取神经酸标准品溶液2.4的色谱条件重复进样5次。神经酸峰面积的RSD为1.38%,说明实验仪器精密度良好。结果如表1。

Table 1. Precision test of nervonic acid
表1. 神经酸精密度试验
3.3. 稳定性实验
取神经酸标准品溶液,在第0 h、5 h、10 h、20 h、24 h、48 h,利用上述色谱条件进样,测得神经酸峰面积的积分值的RSD为2.57%,结果表明待测物在柱温25℃条件下,48 h内该方法稳定性较好(表2)。
3.4. 重复性实验
精密称取同一批样品,分成5份,每份10 g,按照上述方式制备成样品溶液,进行HPLC检测,每次进样进样10 μl,测得样品中神经酸的峰面积RSD为2.80%。结果表明,此次实验方法重复性良好(表3)。

Table 2. Stability test for nervonic acid
表2. 神经酸稳定性试验

Table 3. Repeatability test of nervonic acid
表3. 神经酸重复性试验
3.5. 加样回收率测定
分别在已测得神经酸含量的蒜头果种仁样品中添加0.5、1.0和2.0 mg/g的神经酸标准品溶液,按照2.2方法进行样品制备,2.4的色谱方法进行HPLC测定,每样品测定3次,其平均回收率在96%以上,相对标准偏差均在3.00%以下(表4),说明该方法良好,可行。

Table 4. Recovery rates of nerve acid by HPLC
表4. HPLC测定神经酸的回收率
4. 结论
本论文是基于高相液相色谱法(HPLC)建立了一种快速检测蒜头果种子中神经酸含量的方法,并通过方法学验证,实验结果表明,神经酸的保留时间约为8 min,其分离效果较好,精密度、稳定性、重复性和加样回收率均符合实验要求,可用于蒜头果种子中神经酸含量的快速检测。
基金项目
国家林业公益性行业专项[This Work Was Supported by the Special Fund for Forestry-Scientific Research in the Public Interest] (No. 2012BAD21B050107)资助。
NOTES
*通讯作者。