1. 引言
钾离子在人体内最重要的元素之一,对身体功能(如维持细胞外渗透压、酶的活化、胶原蛋白或弹性蛋白的形成、血压调节和pH平衡)至关重要。正常成年人血清钾离子在3.5~5.5 mM之间,正常尿钾在10~100 mM/24 h的范围内。钾水平的轻微变化可以影响健康,钾离子浓度变化导致肾脏功能、神经肌肉、心脏疾病、癌症等疾病。因此,快速的、可靠的、定量的测定钾离子的含量对于医学诊断是重要的。目前,钾离子的检测主要使用电化学方法、荧光法、原子吸收/发射光谱法、比色法、离子色谱等,本文将近几年来检测钾离子的方法进行阐述。
2. 修饰脱氧核糖核酸(DNA)类–荧光生物传感器
2016年Shan Zhang等 [1] 利用双标记凝血酶寡核苷酸适配体的衍生物来检测血清中的钾离子。在凝血酶寡核苷酸与钾离子形成G-四联体之后,通过两端的荧光基团实现荧光共振能量转移(FRET)来检测钾离子。如图1所示(图片来源:Specific detection of potassium ion in serum by a modified G-quadruplex method)。
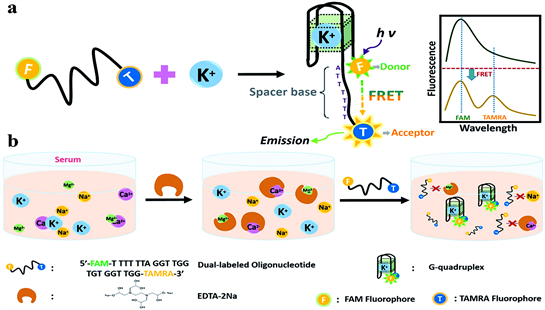
Figure 1. Schematic description of K+ detection based on the formation of G-quadruplex induced FRET. (a) G-quadruplex formation of dual-labelled TBA oligonucleotide derivative in the presence of K+ formation induced occurrence of FRET between FAM and TAMRA; (b) Eliminate the interference of Ca2+ and Mg2+ ions using EDTA as chelating agent to realize sensitive and selective K+ detection
图1. 钾离子检测且G-四链体诱导FRET示意图。(a) 在钾离子形成的存在下,双标记TBA寡核苷酸衍生物的G-四链体形成,FAM和TAMRA之间发生FRET;(b) 用EDTA作为螯合剂消除钙离子和镁离子的干扰,从而实现灵敏且选择性检测钾离子
考虑到钙离子、镁离子也会与凝血酶寡核苷酸结合形成G-四联体,用EDTA作为螯合剂避免了生理浓度下钙离子和镁离子的干扰。同时,Shan Zhang等在不同pH和温度下进行了测试,测试结果表明pH基本不会对结果产生干扰,不过值得注意的是FRET的效率会随着温度的升高而降低,不过在人体体温36.5℃~37.5℃区间影响不大。
3. 免标记–脱氧核糖核酸(DNA)类–荧光生物传感器
2015年Zhengbo Chen等 [2] 报道了一种基于双链DNA (dsDNA)构象变化和PicoGreen染料(一种不对称的菁染料)荧光性质的敏感、选择性和几乎通用的无标记荧光适体方法。该传感系统采用非对称菁染料PicoGreen、ssDNA适体及其互补单链DNA (ssDNA)。在没有互补链的情况下,PicoGreen不能诱导荧光,将互补链添加到混合物中,PicoGreen插入ssDNA双链并导致荧光强度显著增加,荧光强度与浓度成正比。如图2所示(图片来源:Superior fluorescent probe for detection of potassium ion)。这种方法的检测限为2.37 pM,并具有成本低、灵敏度高、特异性强、商品化程度高等优点。

Figure 2. Schematic illustration of the label-free fluorescent strategy for K+ based on aptamers and PicoGreen dye
图2. 基于适配体和PicoGreen染料的无标记荧光方案的示意图
2015年Shujun Zhen等 [3] 使用氧化石墨烯,ssDNA和荧光团吖啶橙(AO)免标记的方法进行钾离子检测。当溶液中没有钾离子情况下,ssDNA和AO通过π-π堆积 [4] [5] 的作用力吸附在GO的表面上,AO的旋转是与整个结构耦合的,AO荧光得到增强;当溶液中有钾离子时,ssDNA与钾离子形成G-四联体,AO可以与G-四联体可以稳定结合,并且由于核苷酸碱基与氧化石墨烯结构之间的π-π堆积减少,会远离氧化石墨烯表面 [6] [7],由于AO与G-四联体的复合物尺寸相对较小,AO的荧光显著下降。如图3所示(图片来源:Graphene oxide amplified fluorescence anisotropy for label-free detection of potassium ion)。这种方法可以在10 μM~2 mM范围内进行测试。
2016年Jingjing Dong等 [8] 利用3,4,5-三甲氧基苯乙二醛(TMPG,是一种特殊的化学荧光试剂)和ssDNA进行钾离子的测试。在水溶液中TMPG可以与鸟嘌呤立即发生反应 [9],富含鸟嘌呤的ssDNA可以与TMPG反应产生很强的荧光 [4],但是当ssDNA折叠形成G-四联体后,荧光会显著降低。如图4所示(图片来源:Rapid and sensitive detection of potassium ion based on K(+)-induced G-quadruplex and guanine chemiluminescence)。这种方法可以检测尿液中的钾离子,并且检测过程可以在5分钟内完成,检测限为9 μM。

Figure 3. The concept and principle of GO amplified fluorescence anisotropy for the label-free detection of K+
图3. GO放大荧光各向异性的概念和原理用于无标记检测K+的示意图
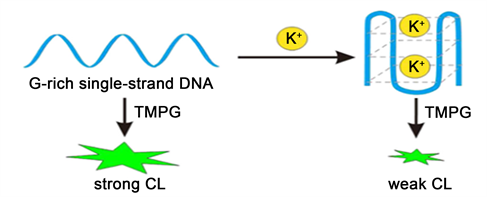
Figure 4. The chemiluminescence (CL) strategy for K+ detection. TMPG 3,4,5-trimethoxylphenylglyoxal
图4. K+检测示意图。TMPG 3,4,5-三甲氧基苯乙二醛
2016年Le Yang等 [5] 首次使用一种基于G-四联体的检测方法,能够直接通过荧光方法检验血液中的钾离子。为避免受到背景吸收和血液自身荧光的干扰,使用两个光子激发的配体EBMVC-B[(乙基-4-[3,6-双(1-甲基-4-乙烯基吡啶碘)-9氢-咔唑-9-基]丁酸乙酯]作为荧光报告分子。钾离子可以诱导G-四联体的形成,并与EBMVC-B进行结合。如图5所示(图片来源:Direct Fluorescent Detection of Blood Potassium by Ion-Selective Formation of Intermolecular G-Quadruplex and Ligand Binding)。这种方法线性响应范围为0.5~10 mM,血液中钾离子浓度范围匹配。

Figure 5. Schematic illustration for highly selective detection of blood potassium based on K+-Dependent formation of intermolecular g-quadruplex and two-photon ligand binding
图5. 基于分子间G-四联体和双光子配体结合K+的高选择性检测血钾的示意图
4. 碳点–荧光生物传感器
2015年Lingyang Zhang等 [6] 利用碳点作为荧光探针来检测血清中钾离子。独特的碳点可用作荧光探针,无需任何预处理即可灵敏地检测人血清中的生理钾水平。
利用碳点表面的−OH和COO−可能形成氢键,从而形成一种环状结构,这种结构类似于冠醚,对金属离子具有敏感和选择性结合特性 [7] [10],在钾离子与空腔结合后,钾离子和氧供体原子的孤对电子之间的强相互作用可以产生更稳定的结构,由此导致碳点的荧光猝灭。如图6所示(图片来源:Carbon dots as a fluorescent probe for label-free detection of physiological potassium level in human serum and red blood cells)。此方法检测限为1.0 × 10−12 M。其结果与目前临床诊断中使用的离子选择性电极法获得的结果基本一致,具有需样量少、成本低廉、精度良好、易于检测等优点,但也存在荧光强度随着pH值的增加而降低,碳点的随着激发波长的改变其产生的荧光也会有所改变的缺点 [11]。
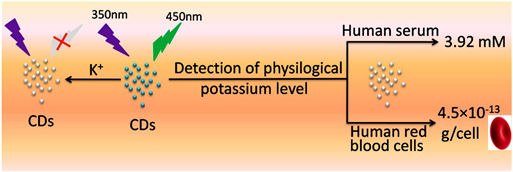
Figure 6. Schematic illustration of detection of physiological potassium level in human serum and red blood cells based on fluorescent CDs
图6. 碳点作荧光探针检测血清中钾离子示意图
2016年Marta Jarczewska等 [12] 开发了DNA适配体作为识别层,用来检测钾离子的电化学传感器。通过Au-S键将硫醇化的适配体探针固定在金电极上,比较氧化还原指示剂亚甲基蓝(MB),蒽醌-2-甲基磺酸钠(AQMS)和Na4Fe(CN)6的电流变化,使用方波伏安法(SWV)测定钾浓度。如图7所示(图片来源:Direct Fluorescent Detection of Blood Potassium by Ion-Selective Formation of Intermolecular G-Quadruplex and Ligand Binding)。研究表明,与钾离子结合的适配体序列中,当15-mer凝血酶适配体对钾的亲和力最高,适配体在10−8至10−5 M范围内表现出线性响应,检测限为2.31 × 10−9 M。

Figure 7. Aptamer-based biosensor behaviour in the presence of potassium ions
图7. 在钾离子存在下适体生物传感器的行为
5. 电化学阻抗谱传感器
2014年Peng Miao等 [13] 利用钾与特异性适配体结合和RecJf核酸外切酶来检测钾离子。在金电极上修饰具有茎环结构的DNA探针,钾离子可以特异性结合适配体并形成G-四链体结构,破坏了茎环结构。5’末端可以通过RecJf外切核酸酶进一步反应,释放钾离子,释放的钾离子可以与电极上的另一个DNA探针结合,在由钾离子引发的RecJf外切核酸酶切割循环后,电化学信号强度显着降低,可用于确定钾离子的浓度,检测限为50 nM。如图8所示(图片来源:An aptasensor for detection of potassium ions based on RecJ(f) exonuclease mediated signal amplification)。

Figure 8. Illustration of the aptasensor for K+ with RecJf exonuclease mediated signal amplification
图8. 用RecJf核酸外切酶介导使信号放大示意图
2019年H. X. Zhang等 [14] 研究结果表明,1-氮杂-18-冠-6(1-aza-18-crown-6)通过亲核加成反应成功地将氧化石墨烯(GO)功能化,形成了碳氮共价键。然后将冠GO复合材料作为电极改性材料,采用电化学阻抗谱(EIS)方法检测钾离子。在EIS测量中,1-aza-18-crown-6起着分子识别探针的作用,它捕获钾离子,石墨烯复合材料增加了结合钾离子的能力。随着钾离子浓度的增加,修饰电极表面的电荷转移电阻(Rct)逐渐减小。根据Rct的变化,可以间接测定钾离子浓度。这种超灵敏电化学传感器对钾离子的线性响应范围为10−7~10−13 M,检测限为10−15 M。
6. 比色法
2018年Mahboube Naderi等 [15] 在适配体传感器中利用金纳米颗粒和阳离子染料去检测钾离子。利用反应后出现的不同颜色(橙色和绿色之间)来区分溶液中有无钾离子。众所周知传感器改变颜色是由金纳米颗粒溶液的离子强度所影响,金纳米颗粒的大小有离子电势有关,离子电势越大,聚集越多,随后颜色向蓝色范围移动。最初,吸附有适配体的金纳米颗粒加入染料后呈现橙色,这可能是由于混合颜色(红色的金纳米颗粒和黄色的染料,在420 nm和530 nm处可观察到紫外–可见峰),加入钾离子后,与适配体之间的高亲和力导致适配体与金纳米颗粒表面解离,钾离子与适配体形成G-四链体结构,由于阳离子染料会引起的金纳米颗粒的聚集,添加染料后颜色从橙色变为绿色,这可能是蓝色(聚合的金纳米颗粒的颜色)和黄色的组合,紫外光谱通过530 nm的吸收峰降低和700 nm的吸收强度增强所致。如图9所示(图片来源:Naked-eye detection of potassium ions in a novel gold nanoparticle aggregation-based aptasensor)。这种传感器不需要将核酸固定到纳米颗粒上,也不需要添加过量的盐,并且在染料的作用下,不同浓度钾离子溶液的颜色变化会更加明显,此方法检测限为4.4 nM。
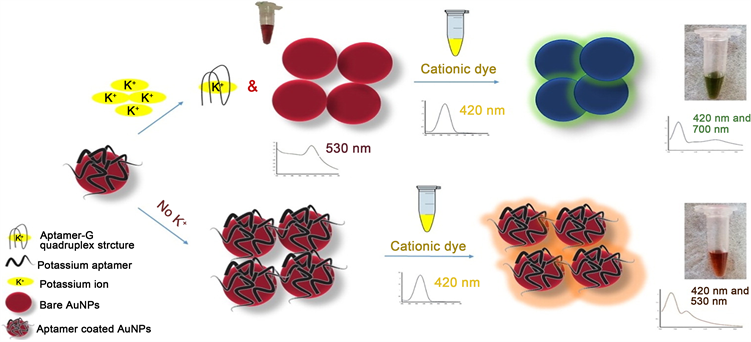
Figure 9. Schematic illustration of the potassium sensing system
图9. 钾离子传感器示意图
2019年Jiaoyan Qiu等 [16] 通过冠醚改性金纳米粒子检测钾离子。其原理是冠醚可以通过Au-N键固定在金纳米粒子表面,钾离子与冠醚可以进行螯合作用,从而诱导了金纳米颗粒的聚集。金纳米颗粒溶液的颜色从酒红色变为灰色,并在620 nm附近出现一个特征吸收峰;也就是说,4-氨基苯并-18-冠-6(ABC)和钾离子之间形成2:1的稳定三明治复合结构,由于尺寸匹配,会诱导ABC修饰的金纳米颗粒的聚集。如图10所示(图片来源:Rapid colorimetric detection of potassium ions based on crown ether modified Au NPs sensor)。通过金纳米颗粒的聚集和表面等离振子共振(SPR)吸收峰的变化,用于钾离子的定性和定量分析,此方法肉眼检测限为40 μM,紫外可见光谱检测限为5.24 μM,并且仅需20分钟即可完成检测。通过进行尿液样品的测试后,与电感耦合等离子体质谱(ICP-MS)检测的结果较为一致。

Figure 10. Mechanism of the colorimetric detection method for K+ based on ABC modified AuNPs
图10. ABC修饰的AuNPs比色检测钾离子机理
2019年Gang Shen等 [17] 利用手性菁染料/TBA配合物的组装和拆分,建立了一种高选择性、高灵敏度的直接检测钾和铅离子的方法。通过紫外–可见光谱测量,染料DMSB(3-乙基-2-[3-(3-乙基-3-苯并硒偶氮-2-亚立德)-2-甲基丙-1-烯基]苯并硒偶氮溴化物)可被凝血酶结合适体(TBA)G-四链结构激活。只有在K+存在下形成的TBA-g4plex能强烈诱导DMSB的J-聚集信号。由于Pb2+离子能以比K+更高的效率结合和稳定TBA的G-四链,当Pb2+存在时,DMSB的J-聚集信号急剧下降。结果表明,DMSB的组装和拆卸可分别对10 μM K+和20 nm Pb2+进行选择性检测,即使竞争性钠离子(Na+)高达145 mM。在0.5~5.0 mM和200~2000 nM范围内,J-集料强度与K+和Pb2+浓度呈线性相关。如图11所示(Direct detection of potassium and lead (II) ions based on assembly-disassembly of a chiral cyanine dye/TBA complex)。此外,本方法还测定了人血清样品中K+ (∼3mm)和Pb2+ (20nm以下)的浓度,与电感耦合等离子体质谱法(ICP-MS)一致。这项工作不仅为进一步开发基于G-四极体的复杂实际系统的aptasensor打开了一扇门,而且为临床离子检测提供了一个简单、通用的传感平台。

Figure 11. Schematic representation for the detection of K+ and Pb2+ ions
图11. K+和Pb2+离子检测示意图
本方法具有三个重要的特点:1) 在不受其它金属离子干扰的情况下,对K+和Pb2+具有良好的选择性。最重要和有趣的是,即使在145 mM Na+存在下,10 μM K+和20 nm Pb2+也可以很容易地被检测到;2) 它简单,省去了DNA共价修饰的需要,大大降低了成本;3) 可用于人血清中K+和Pb2+的测定。这些重要的特性使这种新型的无创传感器在临床研究和诊断中具有广阔的应用前景。
7. 拉曼散射光谱
2016年Hongyang Su等 [18] 首次使用了在疏水表面使用拉曼散射的方法用于检测人血清中的生理钾离子。其原理是通过聚四氟乙烯的疏水表面,当一滴水溶液置于该表面上时,其溶质在溶剂蒸发过程中被浓缩,液滴将保持球形。利用钾离子和铵离子定性亚硝酸钴钠试剂,在酸性介质或中性条件下,可以进行钾离子和亚硝酸钴钠的反应:
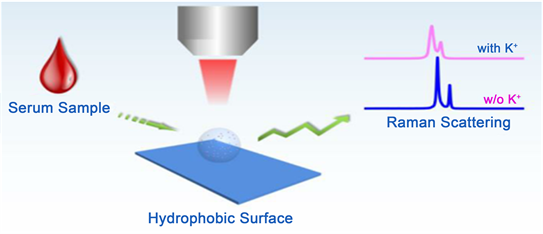
Figure 12. Raman spectra of potassium-sodium cobaltinitrite (A) and sodium cobaltinitrite (B)
图12. 钴亚硝酸钾钠(A)和钴亚硝酸钠(B)的拉曼光谱
这种方法可以实现钾离子的定性检测,并且结合反应和拉曼散射光谱,可以实现钾离子的定量检测。检测时样品无需经过预处理。钾–亚硝酸钴钠的特征拉曼峰在827 cm−1处,可以通过此特征峰来证明钾离子的存在,具有良好的重复性和重现性,检测线可以达到0.01 mM,可用于钾离子的定量、定性分析,并且整个检测过程仅需要2分钟就能完成。这是一种用少量样品进行快速检测含有大量钠离子的人血清中钾离子含量的方法。如图12所示(图片来源:Detection of physiological potassium ions level in human serum by Raman scattering spectroscopy)。
8. 展望
人们在检测钾离子方面已经得到实际进展,例如检测限、敏感度和选择性,但是检测钾离子的传感器的可重复利用、储存稳定性、便携性、小型化仍然是一个挑战。在实际工作中,样品的复杂环境必定会对其测定结果产生影响,随着研究的深入,必定会出现不需要复杂处理过程,准确度和灵敏度高的生物传感器,用于检测钾离子。相反,钾离子传感器也可用于DNA检测,利用荧光法、比色法等制成可以检测病毒核酸的试剂盒,用于快速检测病毒的存在。
NOTES
*通讯作者。