1. 引言
资料显示急性肾损伤(Acute Kidney Injury AKI)的死亡率一直居高不下,在老年人中常见,大约有40%~75%的AKI由脓毒症引起 [1]。国际上对于脓毒症急性肾损伤的定义包括:1) 符合改善全球肾脏病预后组织(KDIGO)在2012年AKI临床实践指南中提出的的AKI的诊断和分级标准;2) 符合脓毒症的诊断标准;3) 除外其他非脓毒症相关性急性肾损伤(如造影剂及其他肾毒性药物相关性急性肾损伤) [2] [3]。脓毒症急性肾损伤因素复杂,涉及多种炎症机制,包括直接的细胞损伤、炎症引起的损伤和微循环系统的恶化,都可以导致局部组织缺血。在这个过程中,以内皮细胞表面的多糖包被受损为代表的微循环的改变是早期的重要表现 [4]。内皮细胞多糖包被在液体和溶质的跨毛细血管膜的运动、内皮细胞对剪切力的机械转换、中性分子黏附到内皮细胞表面层的过程中扮演重要的角色。在炎症因子的刺激下,伴随多糖包被的脱落使血管屏障的破坏进一步加重,内皮细胞的通透性明显增加,有效血容量减少,进一步加重组织低灌注 [4]。
有研究显示血管生成素-1 (Angiopoietin-1, Ang-1)可以代表内皮细胞修复的能力,Kasprzak的研究显示Ang-1是内皮细胞损伤的一个重要保护因素,Ang-1增多可促进血管新生 [5]。另外Wen-Chih Chiang的研究显示Ang-1的增加通过影响内皮细胞的存活/再生来减轻肾损害,并且促进肾损伤后的恢复。而Ang-1减少可以导致内皮细胞受损后修复减慢 [6]。因而Ang-1是治疗缺血性肾损伤的一种新方法。
多配体聚糖-1 (Syndecan-1, SDC-1)一直以来被认为是多糖包被的代表性标志物,其对血管内皮的保护作用也有诸多研究,Thejaswi的研究显示在内皮细胞受刺激或损伤以及处于应激状态时,机体通过沉默肝素酶来保护SDC-1,进而增加了附着在血管壁上的血管性血友病因子(von Willebrand factor, VWF)的数量,血浆VWF水平升高,降低肾损伤出血风险。因而内皮细胞与SDC-1有强烈的相关性,SDC-1增多可以显著降低血管内皮损伤带来的肾出血发生率 [7]。
CRRT不但可以清除炎症介质,而且对于血流动力学的稳定有重要作用。有研究指出,在脓毒症急性肾损伤患者中,早期开展治疗,可以降低患者90天的死亡率,减少患者血管活性药物应用的剂量及应用持续的时间 [8] [9]。
多配体聚糖-1 (SDC-1)是多糖包被受损的特异性血浆标志物。而血管生成素-1 (Ang-1)的水平反应内皮细胞的修复能力 [10]。本研究通过动态检测CRRT过程中脓毒症AKI的SDC-1和Ang-1的血浆浓度,观察多糖包被的脱落程度及内皮细胞的通透性的变化,探寻CRRT开展时机的理论依据。
2. 资料与方法
2.1. 研究对象
采用单中心前瞻性随机对照研究方法,纳入了2015年12月~2016年12月入住河北医科大学第四医院重症医学科明确诊断为AKI的患者。本研究经河北医科大学第四医院伦理委员会审核批准。
2.1.1. 纳入标准
患者符合脓毒症的诊断标准,同时符合KDIGO指南的急性肾损伤1、2期的诊断标准。
2.1.2. 排除标准
存在低分子肝素禁忌;年龄 < 18周岁或处于妊娠阶段;慢性肾衰;糖尿病;急性肾损伤满足KDIGO 3期;高钾血症(血K+浓度 > 6.5 mmol/L);严重代谢性酸中毒(PH < 7.25);本研究所采集数据无法获得者;临终状态;ICU住院日期小于3天。
2.1.3. 试验分组
在充分征得患者家属知情同意的基础上,将入选患者随机分为对照组(脓毒症集束化治疗)和试验组(脓毒症集束化治疗 + CRRT)。
2.2. 研究方法
2.2.1. 研究过程
所有入选患者入住ICU后均连接心电监护仪,经颈内静脉或锁骨下静脉置入中心静脉导管,监测患者心率、体温、中心静脉压、平均动脉压等。具体措施如下:
根据2012年《拯救脓毒症运动:2012严重脓毒症和脓毒症休克管理指南》:对于脓毒症休克患者,应尽早进行液体复苏,对照组给予脓毒症集束化治疗。试验组在脓毒症集束化治疗的基础上给予CRRT治疗。CRRT的模式及参数:CVVH模式,前稀释90%,治疗剂量:35 ml/kg/h,液体策略:机器零平衡。入科0 h、12 h均给予低分子肝素钙针4100 iu皮下注射。
2.2.2. 数据采集
分别收集治疗0 h、4 h、12 h的临床数据,包括:血浆乳酸(Lac),中心静脉血氧饱和度(ScvO2),白细胞计数(WBC),降钙素原(PCT),C反应蛋白(CRP),脑钠肽(BNP),液体入量、尿量、液体平衡量。
对照组和试验组分别于入科0 h、4 h、12 h采集外周静脉血2 ml,采用酶联免疫吸附试验(ELISA)的方法测定血浆中Ang-1、SDC-1的浓度。
2.2.3. 数据分析
应用SPSS 21.0版本(IBM Corp., Armonk, NY, USA)进行统计学分析。计量资料符合正态分布,以均数 ± 标准差(x ± SD)表示,配对样本采用配对t检验进行分析;非正态参数以中位数(四分位数间距)表示,采用秩和检验进行分析。采用spearman算法检测分析不同因素之间的相关性,并用R语言进行可视化。P < 0.05认为具有统计学意义。
3. 结果
3.1. 患者的入选流程及分组情况
本研究共对40例患者进行了筛选。其中2例存在抗凝禁忌,2例存在慢性肾功能损害,3例存在糖尿病且血糖控制不佳,2例存在高钾血症,1例存在数据缺失,1例存在严重的代谢性酸中毒,本研究最终总共纳入29例患者。29例入ICU即存在脓毒症急性肾损伤的患者中,在征得家属的知情同意后,其中有15例患者纳入试验组,14例患者纳入对照组。
3.2. 对照组和试验组的一般临床数据的比较
对照组与试验组的APACHE II评分分别为18.43 ± 4.42和20.53 ± 6.90,差别不具有统计学意义(P = 0.110)。对照组与试验组的SOFA评分分别为6.00 (3.00)和7.00 (1.00),差别不具有统计学意义(P = 0.576) (见表1)。对照组和实验组各临床数据(Lac, ScvO2, BNP, WBC, PCT, CRP)不具有统计学差异(见表2)。

Table 1. General clinicopathological data of patients with AKI
表1. AKI患者的一般临床病理资料
Data = [
± S, M(QR)],*P < 0.05。
3.3. 对照组和试验组的血浆标志物浓度的比较
0小时、4小时、12小时对照组Ang-1浓度(pg/ml)分别为283.90 ± 144.90、352.26 ± 110.01和523.60 ± 141.63,试验组的Ang-1浓度(pg/ml)分别为300.79 ± 226.27、430.22 ± 266.88和531.30 ± 246.98。与对照组相比,试验组0小时的Ang-1 (P = 0.121)无差异,不具有统计学意义,4小时(P = 0.003)、12小时(P = 0.019)的Ang-1浓度有差异,具有统计学意义。0小时、4小时、12小时对照组SDC-1浓度(pg/ml)分别为5031.02 ± 2863.84、5416.85 ± 3332.89和5521.67 ± 3086.21,试验组SDC-1浓度(pg/ml)分别为4667.14 ± 2506.71、4634.45 ± 2700.60和4764.96 ± 2498.37。与对照组相比,试验组0小时(P = 0.715)、4小时(P = 0.531)、12小时(P = 0.377)的SDC-1浓度无差异,不具有统计学意义(见表3,图1)。
3.4. 不同时间状态下Ang-1浓度之间的相关性
由相关性分析显示,Ang-1在0 h的浓度与4 h的浓度具有显著的相关性(Cor = 0.842, P = 8.201e−05),另外,Ang-1在4 h的浓度与12 h的浓度同样具有显著的相关性(Cor = 0.953, P = 3.99e−08) (见图2)。
3.5. 不同时间状态下Ang-1浓度与其他临床因素指标之间的相关性
Ang-1在4 h的浓度与Lac (Cor = 0.37, P = 1.749e−01),ScvO2 (Cor = 0.81, P = 2.537e−04),BNP (Cor = 0.199, P = 4.958e−01),PCT (Cor = 0.352, P = 1.978e−01),CRP (Cor = 0.274, P = 3.238−01),SDC−1 (Cor = 0.278, P = 3.162e−01)的相关性具有统计学意义(见图3(a))。

Table 2. Clinical characteristics of the control group and the experimental group
表2. 对照组和试验组的临床特点
Data = [
± S, M(QR)],*P < 0.05。

Table 3. Ang-1 and SDC-1 concentrations in the control group and the experimental group
表3. 对照组和试验组的Ang-1和SDC-1的浓度
Data = [
± S, M(QR)],*P < 0.05。
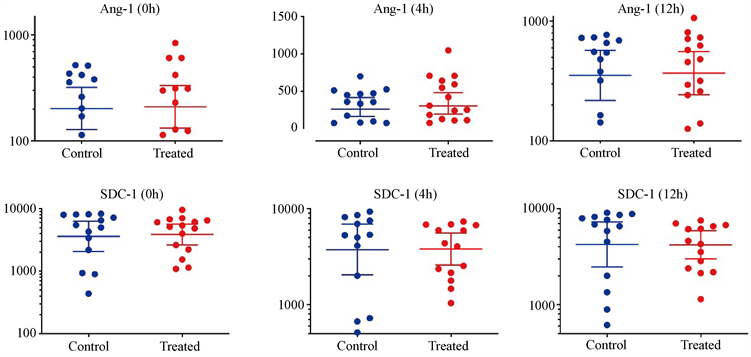
Figure 1. Comparison of Ang-1 and SDC-1 concentrations between the control group and the experimental group at 0 h, 4 h and 12 h
图1. 0小时、4小时、12小时对照组和实验组Ang-1和SDC-1浓度的比较

Figure 2. Correlation between Ang-1 concentrations at different time states
图2. 不同时间状态下Ang-1浓度之间的相关性
Ang-1在12 h的浓度与Lac (Cor = 0.431, P = 1.087e−01),ScvO2 (Cor = 0.747, P = 1.368e−03),BNP (Cor = 0.176, P = 5.484e−01),PCT (Cor = 0.532, P = 4.125e−02),CRP (Cor = 0.186, P = 5.071e−01),SDC−1 (Cor = 0.125, P = 6.581e−01)的相关性具有统计学意义(见图3(b))。
3.6. 试验组和对照组的液体入量的比较
对照组和试验组的4小时的单位体重液体入量(ml/kg)分别为29.61 (11.30)和26.95 (6.75),不具有统计学意义(P = 0.089)。12小时的单位体重液体入量(ml/kg)分别为43.99 (14.95)和37.23 (11.80),具有统计学意义(P = 0.023,见表4)。
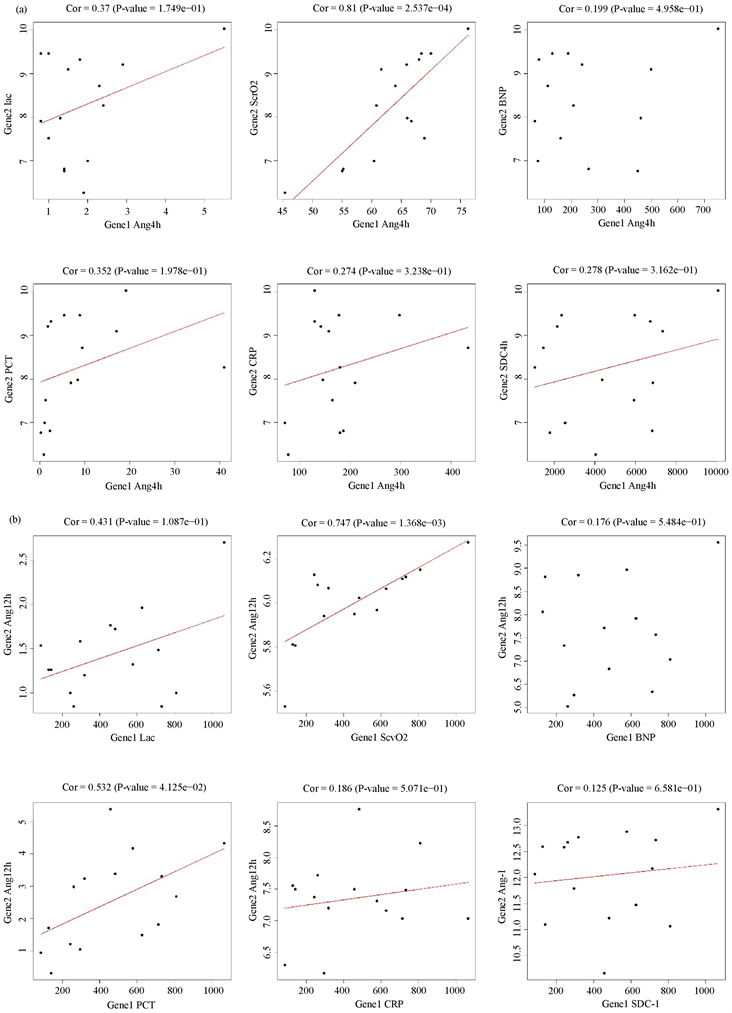
Figure 3. Correlation between Ang-1 concentration and other clinical factors at different time states
图3. 不同时间状态下Ang-1浓度与其他临床因素指标之间的相关性

Table 4. Liquid intake (ml/kg) at 4 h and 12 h in the control group and the experimental group
表4. 对照组和试验组在4 h和12 h的液体入量(ml/kg)的情况
Data = [
± S, M(QR)],*P < 0.05。
4. 讨论
研究表明,AKI的发生与炎症反应和内皮细胞功能障碍有关 [10] [11]。在炎症反应中,Ang-1能够降低血管炎症反应和渗漏,从信号传导角度来说,Ang-1与Tie2的结合导致酪氨酸磷酸化,从而维持血管完整性、抑制血管渗漏、抑制炎症反应基因表达,阻止PI3K/Akt通路引起的粒细胞迁移 [12]。近年来,研究者对于内皮细胞多糖包被的研究也逐渐深入。多糖包被是覆盖在血管内皮细胞表面的一层结构,分为细胞膜内区域和细胞膜外区域,细胞膜内区域主要由蛋白聚糖和糖蛋白及其这两个结构上的侧链(如透明质酸,Hyaluronic acid)交织在一起形成的网状结构,细胞膜外区域主要指的是多配体聚糖(Syndecan, SDC) [13]。SDC是多糖包被结构的重要组成部分,根据SDC结合的硫酸肝素和硫酸软骨素链不同的特异的细胞区域又分为4个亚型 [14]。其中,SDC-1是反应多糖包被脱落的特异标志物 [15] [16]。在生理条件下,多糖包被层处于合成和脱落的动态平衡中 [13],研究显示在炎症反应早期多糖包被可大量脱落。因此,在炎症反应中,多数学者认为代表多糖包被破坏程度的降解产物在血浆中的浓度与疾病进展程度密切相关,降解产物的浓度越高,病情越重 [17] [18]。Qureshi等研究认为可以把多糖包被受损作为预测AKI的早期标志物 [19]。不仅如此,Marechal [20] 等通过建立鼠LPS脓毒症模型证实,多糖包被的降解发生在感染性休克内皮细胞功能障碍的最初阶段,在血浆中可以检测到较高浓度的SDC-1、硫酸类肝素(heparan sulfate, HS)和葡糖氨基葡聚糖(glycosaminoglycans, GAGs)。此外,有研究显示在儿科心脏外科术后的患儿中,血浆SDC-1的水平与AKI的发生密切相关,由此我们可以相信,SDC-1与血管损伤及AKI的密切相关 [21],在本研究中,通过监测SDC-1和Ang-1的血浆浓度,可侧面反映脓毒症AKI患者血管损伤程度及血管通透性改变,把CRRT作为干预手段,分析不同分组患者的结果入手,发现CRRT在脓毒症AKI患者中的应用时机,探索CRRT的实际临床价值,为临床开展CRRT的提供了有力的参考。SDC-1和Ang-1作为大分子物质,CRRT对其的清除能力有限。
传统的Starling原理认为血管内容量由血浆成分和细胞成分构成,毛细血管作为微血管屏障,分隔富含蛋白质的血浆成分和蛋白质溶度较低的组织间隙成分,液体滤过毛细血管内皮细胞由跨内皮细胞静水压差和血浆–间质胶体渗透压差决定 [22]。根据多糖包被概念的提出,有学者对Starling原理进行了修订,即决定经血管壁液体渗漏的是由血管腔内与多糖包被下无蛋白空间区域的压力差,而不是血管壁的内外两侧压力差。在生理条件下,血管内皮多糖包被层根据所在的器官组织的不同可以连续存在或间断存在,在肾小球毛细血管内多糖包被层是不连续的 [23]。而在病理状态下一旦多糖包被的完整性遭到破坏,血管的屏障功能将明显下降,更多的液体和蛋白由血管快速渗漏导致级联反应,引发灾难性后果 [24] [25]。在本研究中,试验组未通过CRRT对容量进行干预。液体出入量的研究为试验开始后4小时。对照组和试验组的4小时的单位体重液体入量分别为29.61 (11.30) ml/kg和26.95 (6.75) ml/kg,差别不具有统计学意义(P = 0.089),但是与对照组相比,试验组的单位体重液体入量较少。12小时的单位体重液体入量分别为43.99 (14.95) ml/kg 和37.23 (11.80) ml/kg,差别具有统计学意义(P = 0.023)。这说明试验组Ang-1的浓度增加,改善了血管通透性和加强了血管的完整性,从而保护了血管内容量,因此能够降低这类患者对液体的需求。
对于脓毒症患者,早期我们采用液体复苏以达到血流动力学的稳定,静脉补液的目的在于提高心输出量、增加组织器官灌注。对于那些腹泻、呕吐等明确丢失液体的患者中,补液存在它的合理性。但是,补液过多或者患者并不真正需要液体而进行补液,可引起肾脏间质水肿,加重肾脏功能的恶化 [26]。根据传统的Starling原理,胶体液往往备受青睐。但是根据修订的Starling原理,一旦血管内屏障完整性的丢失,所输注的胶体物质未必都被限制在血管内,甚至所输注的胶体物质更易进入组织间隙而加重组织水肿。对于脓毒症急性肾损伤的患者中,液体复苏往往是我们的首选,但是,研究发现液体过负荷导致心房利钠肽(ANP)分泌增加,使多糖包被的损害呈恶性循环 [27] [28]。严重的多糖包被层的破坏使血管内皮的通透性增加 [29]。液体过负荷、急性肾损伤与不良预后三者的关系十分密切 [30]。与此类似的研究中指出,液体正平衡同时也与不可逆性的肾功能恶化相关 [31]。本研究结果发现,虽然在试验组没有通过CRRT进行液体管理,但是我们对于符合KDIGO指南AKI的1、2期的患者早期开展了CRRT治疗,结果发现伴随血浆标记物水平的改变,CRRT能降低脓毒症急性肾损伤的患者的液体入量,同时对内皮细胞通透性有改善作用。本研究也测定了与ANP有相似临床意义的脑钠肽(BNP)的血浆浓度,结果发现试验组与对照组0小时、12小时的BNP水平均不具有统计学意义(P值分别为0.854,0.713)。这需要进一步实验研究ANP与BNP的临床敏感性。
本研究比较了两实验组的其它临床数据,结果发现白细胞计数,降钙素原,C反应蛋白,ScvO2,血浆乳酸在各时间点差别均不具有统计学意义(P > 0.05)。考虑原因为本研究的研究时间为12小时,未进行更长时间的观察对比。
综上所述,虽然既往研究已认为CRRT可以清除炎症因子,但是何时启动CRRT目前争论颇多,我们通过对脓毒症急性肾损伤的患者中血浆中标志物的监测,观察到早期开展CRRT可以降低内皮细胞多糖包被的损伤,改善内皮细胞通透性,保护内皮细胞表面层的完整性,从而为优化容量管理提供了进一步的理论基础。
基金项目
河北省卫生和计划生育委员会重点科技研究计划项目(ZD20140134)。
NOTES
*通讯作者。