摘要: 本综述旨在报道当致病因子突破皮肤黏膜或发生肿瘤细胞生长等危险信号,通过提高机体自身非特异免疫力的新思路新方法而具有的抗病毒抗肿瘤治疗的效果。非特异性免疫促进剂“帕米卡”在纷繁难以克服的病毒、肿瘤治疗中表现出显著的有效性和良好的安全性。帕米卡是多种膜式识别受体TLR3、TLR4、NOD、MDA-5和RIG-1的配体,能多靶点地激活机体免疫系统,免疫1~5小时能在动物体血清里检测到干扰素α、γ、白细胞介素-2、-6、-12、肿瘤坏死因子等多种细胞因子,促进机体产生共刺激因子CD80、CD86,促进抗原呈递细胞的提呈,促进免疫细胞和细胞受体的增殖,直接或间接活化巨噬细胞、DC、NK、T细胞,B细胞,进而促进肿瘤的消亡,使肿瘤萎缩、退化,阻止肿瘤的自然转移。帕米卡激活信号传导通路绑定TRIF、TRAF,级联式地活化机体免疫力。在肺癌、乳腺癌、黑色素瘤荷瘤小白鼠试验中帕米卡表现出具有极其显著的有效性(P < 0.05~0.001~0.0001),显现出帕米卡以提高全身非特异性免疫方法抗病毒抗肿瘤治疗新路径的可行性。
Abstract:
It is important mission in therapeutic fields to cure viral diseases, metastatic tumors due to have not been specific drugs and therapeutic vaccines for viruses and tumors so far. That is a new idea and new way for us: Pamica have shown markedly effects and good safety faced hardly viral infection and metastatic tumors with improving systemic nonspecific immunity. The composition of Pamica is dsRNA polyI:C, non-biotic amino compounds and CaCl2. It is the ligands of pattern recognition receptors TLR3, TLR4, NOD, MDA-5 and RID-1. As Pamica combined with these receptors that can stimulate different immune processes including produce cytokines including IFN-α, IFN-β, IFN-γ, IL-2, IL-12p40, IL-6, TNF-α during 1 - 5 hours, promote macrophage function, stimulate antigen-presenting cells to produce co-stimulators of CD80, CD86. In the mice with non small cell lung cancer, breast cancer, melanoma, the efficacy of Pamica showed significant difference (P < 0.05 - 0.001 - 0.0001) compared with the control. Our results showed that Pamica had the ability to inhibit tumor cell proliferation and promote cell apoptosis by binding TRIF, TRAT signaling pathway to leaded cascade activated body immunity. These preliminary findings underlined promise of this potentially life-saving drug by improve systemic nonspecific immunity. It is possible to provide a new idea and new way to open therapeutic revolutionary door of anti-viruses and anti-tumors.
1. 帕米卡概述
帕米卡® (Pamica)由双链聚肌苷酸–聚胞苷酸(PIC)、非抗生素类氨基化合物(Amino)、阳离子化合物(Calsium)等物质组成,各成分英文字母组合成Pamica,音译为帕米卡。图1为帕米卡示意图。
帕米卡处方的优越性:1) 帕米卡是TLR3、TLR4、NOD、MDA-5、RIG-1等多种模式识别受体的配体,与受体结合后能多靶点地激活机体免疫系统。2) 非抗生素类氨基化合物带正电荷的氨基可与聚阴离子PolyI:C的结合,形成稳定双链RNA结构,也是TLR4的配体,能有效地促进机体免疫 [1]。
2. 帕米卡的安全性及有效性研究
表1综述了帕米卡各项试验内容、作用靶点、方法、结果及出处。
3. 帕米卡作用机理
如图2所示,2011年诺贝尔生理学和医学奖获得者Bruce BA [3] 和Hoffmann JA [4] 发现TLRs膜式识别受体可以与微生物基本成分结合活化非特异性免疫,Steinman RM [5] 发现树突状细胞(DC)具有促进机体非特异免疫并进而活化淋巴细胞启动特异性免疫,帕米卡在免疫中具有这两方面的促进作用,是帕米卡作用机理的依据。
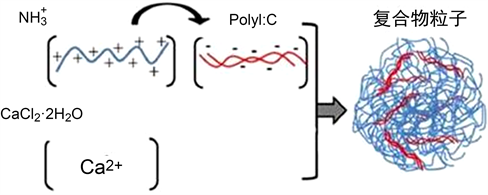
Figure 1. Structure diagram of compound PolyI:C-NH2-Ca2+
图 1 . PolyI:C-NH2-Ca2+的复合物结构示意图


Table 1 .Pamica multi targetly activate system immunity
表1. 帕米卡多靶点激活全身免疫力
 图片来源:编译自Roitt’s Essential Immunology,第13版。
图片来源:编译自Roitt’s Essential Immunology,第13版。
Figure 2. Recognition of DC to conserved components of bacteria and viruses
图2. DC对细菌病毒的保守成分的识别
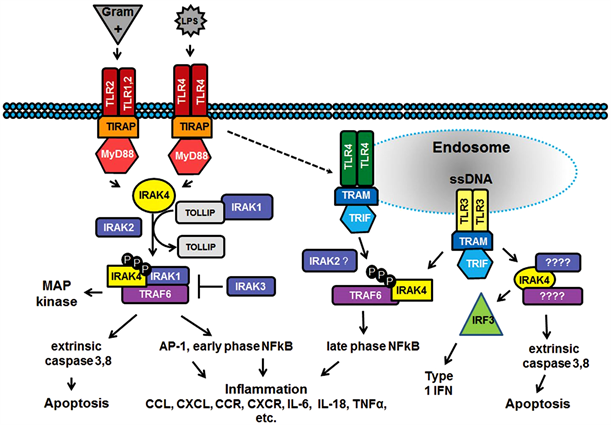
Toll样受体(Toll-like receptors, TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁,可以识别来源于微生物的具有保守结构的分子,当微生物突破机体的物理屏障如皮肤、粘膜等时,TLR可以识别它们并激活机体产生免疫细胞应答。帕米卡是多种膜式识别受体(PRR)的配体,包括TLR3、4 (Toll样受体3、4)、NOD (细胞内核苷酸结合寡核苷酸域)蛋白家族、RIG-I (RNA螺旋酶视黄酸诱导基因I)、MDA5 (黑色瘤分化相关基因5)依赖dsRNA蛋白激酶等。这些受体广泛存在于上皮细胞和树突状细胞里,还存在NK、T、巨噬细胞中,也在几种肿瘤细胞中表达。TLR3作为病毒双链RNA识别受体在机体抗病毒天然免疫中发挥十分重要的作用,TLR3与配体结合后,活化转录因子NF-KB和干扰素调节因子3 (IRF3),诱导炎症细胞释放炎症因子并介导炎症反应,同时诱导I型干扰素的释放,使DC细胞成熟,介导抗病毒抗肿瘤非特异性免疫。这些信号传导不仅通过TLR3还可通过MDA5和RIG-1胞浆受体。人体的巨噬细胞、嗜中性细胞、不同癌细胞、上皮细胞具有MDA5和RIG-1。双链RNA被MDA5和RIG-1识别后,与其相关的线粒体接头分子相互作用信号级联式启动,导致IRF3、NF-κB活化产生IFN1。帕米卡喷剂属于双链RNA (dsRNA)药物,双链RNA制剂作为配体一旦与这些受体结合,通过细胞内信号传导激活机体一系列非特异性和特异性免疫(如图3所示),在机体保护性免疫方面发挥重要作用,是调节抗感染抗肿瘤初始免疫的中心环节。
帕米卡另一主要成分“非抗生素类氨基化合物”是TLR4受体的配体,被识别后启动信号转导途径诱导NF-κB和蛋白激酶-1 (activator protein 1, AP-1)等的活化,通过促进巨噬细胞、NK细胞、T细胞功能发挥抗病毒抗肿瘤作用 [6]。
树突状细胞(DC),是功能最强的专职抗原递呈细胞(antigen presenting cells,APC),是连接初始免疫和继发免疫的中心环节。当受到外源性抗原或肿瘤抗原危险信号刺激时,树突状细胞摄取、加工处理这些抗原为抗原肽并与树突状细胞表面MHCI、II类分子(信号1)结合,通过抗原递呈激活初始T细胞。为保证诱发抗原特异性的免疫刺激反应,树突状细胞还需分泌共刺激分子(信号2)及特征性细胞因子白细胞介素12 (IL-12)等(信号3)。帕米卡喷剂能够通过上调DC细胞MHC I和II分子、促进共刺激分子CD80,CD86产生,促进IL-12产生,促进抗原呈递,连接初始免疫(非特异性免疫)和继发免疫(特异性免疫)。另一方面帕米卡本身就具有抗病毒、抗肿瘤作用(如图4所示)。
 图片来源:https://www.frontiersin.org/articles/10.3389/fimmu.2013.00338/full。
图片来源:https://www.frontiersin.org/articles/10.3389/fimmu.2013.00338/full。
Figure 3. Signaling pathways and effects after TLR3, 4 ligand combined with the rereceptors
图3. TLR3、4等受体与配体结合后信号传递途径及产生的免疫反应
 图片来源:百度识图搜索 https://graph.baidu.com/pcpage/similar?originSign=122b0004ee7a80e35542801597996113&srcp=crs_pc_similar&tn=pc&idctag=nj&sids=10005_10802_10916_10912_11006_10922_10905_10016_10901_10942_10907_11012_10961_10971_10968_11031_11120_13007_12201_13202_16109&logid=2872840947&entrance=general&tpl_from=pc&image=https%3A%2F%2Fss1.baidu.com%2F6ON1bjeh1BF3odCf%2Fit%2Fu%3D2324375711,3558937381%26fm%3D27%26gp%3D0.jpg&carousel=503&index=0&page=1。
图片来源:百度识图搜索 https://graph.baidu.com/pcpage/similar?originSign=122b0004ee7a80e35542801597996113&srcp=crs_pc_similar&tn=pc&idctag=nj&sids=10005_10802_10916_10912_11006_10922_10905_10016_10901_10942_10907_11012_10961_10971_10968_11031_11120_13007_12201_13202_16109&logid=2872840947&entrance=general&tpl_from=pc&image=https%3A%2F%2Fss1.baidu.com%2F6ON1bjeh1BF3odCf%2Fit%2Fu%3D2324375711,3558937381%26fm%3D27%26gp%3D0.jpg&carousel=503&index=0&page=1。
Figure 4 . The function of dendritic cell
图4. 树突状细胞的功用
4. 展望
帕米卡在抗病毒、抗肿瘤实验研究中显示了非特异性地多靶点促进机体全身的免疫力,特别是细胞免疫,在疾病期间可重复性长时间激发免疫力而少副作用等鲜明的迄今治疗上不同的机理和特点,从而发挥抗病毒感染和消灭残存肿瘤细胞的作用,展现出强大的抗病毒抗肿瘤免疫效应。
帕米卡制剂的治疗效果是通过致病因子突破皮肤黏膜后用提高全身非特异免疫力而具有抗病毒抗肿瘤效果的,这与笼统地以健康的生活方式和一般增强免疫力的方法不同。免疫治疗必须具有细胞免疫,产生或促进产生一系列细胞因子进入细胞内杀灭病毒和裂解病毒繁殖的细胞包括肿瘤细胞才具有治疗作用。帕米卡是TLR3、4等多种细胞膜式受体的配体,能多靶点非特异性地激活机体免疫系统促进多种细胞因子产生,促进DC成熟等具有明确的治疗作用。在没有抗原刺激下机体能杀灭肿瘤细胞、逆转肿瘤细胞逃逸、转移,与对照组相比显示出了极其显著的抗病毒抗肿瘤效果(P < 0.05~0.001)而且未表现出副作用,这种非特异性的效果及安全性展示了美好的前景。需要证明的是在机体患病过程中在病毒、肿瘤抗原存在情况下单独帕米卡是否也能促进这些机体存在的抗原发生特异性免疫反应,而具有了显著的治疗效果。另外,帕米卡在实践中联合应用现有的治疗手段将会走出一条新的抗病毒抗肿瘤抗超级细菌的更有效和很少副作用的新路来。通过提高机体非特异免疫是打开抗病毒抗肿瘤治疗难题一条新思路新路径。
本研究系列研究结果将陆续报道。
NOTES
*通讯作者。