1. 引言
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种常见的自身免疫性疾病。主要特征为T、B淋巴细胞活化异常产生大量自身抗体并与体内相应的自身抗原结合形成相应的免疫复合物,对肾、心血管、神经、肌肉骨骼和皮肤等多器官产生损害 [1]。84%~90%的患者会累及肾脏出现肾功能损伤,即狼疮性肾炎(lupusnephritis, LN),主要临床表现为蛋白尿、血尿等 [2]。SLE全球发病率为12.5~39/10万,我国的患病率为0.7~1/1000,女性:男性6~10:1,20~40岁是高发年龄 [3]。目前SLE无理想的治疗方案,临床上主要是应用糖皮质激素和免疫抑制剂,但仍有部分患者出现复发或反复活动,长期使用激素和免疫抑制同样增加了患者的潜在致死率 [4]。该病早期死亡风险较高,特别是年轻人,高达45%的患者出现早期器官损害,这与疾病持续活动或肾脏疾病有关,其中肾脏受累的患者,40%~50%的患者死亡率高于预期的8倍,且临床治疗不佳 [5]。与皮质类固醇激素相比,环磷酰胺治疗并没有改善患者的生存率 [6],有实验比较过霉酚酸酯和静脉环磷酰胺治疗狼疮性肾炎的疗效,患者完全缓解率分别仅有8.6%和8.1%,需要寻找更安全、更有效的方法 [7]。
干细胞(stem cell)是一类具有自我更新和多向分化潜能的细胞群体,具有可塑性。在一定的条件下能分化为组织细胞,如成骨细胞、成软骨细胞、脂肪细胞、神经细胞、内皮细胞及心肌细胞。根据干细胞的分化潜能大小分为三类:全能干细胞,多能干细胞和单能干细胞。按其来源可以分为胚胎干细胞和成体干细胞。胚胎干细胞(Embryonic Stem Cell, ESC)是从早期胚胎或原始性腺种分离出来的一类干细胞,具备体内外发育分化的全能性。其它从成体组织如骨髓、肌肉等获得的干细胞,我们称之为成体干细胞(Adult Stem Cell, ASC),只具有部分发育分化功能,只能分化为一种或多种功能细胞。人体几乎所有组织都存在ASC。
间充质干细胞(Mesenchymal stem cells, MSCs)是一类具有高度自我更新和多向分化潜能的成体干细胞。最早在骨髓中发现,后经研究证实,真皮、脂肪组织、肌肉、外周血、脐带血、脐带静脉内皮下层、胎盘中也发现MSCs。MSCs起源于中胚层,具有向内、中、外三胚层的多种细胞分化的能力。MSCs除了具有支持造血的功能,还具有免疫抑制作用,其独特的生物学特性及其临床应用越来越受到人们的重视,现在已成为多种疾病细胞治疗的首选。
2. 材料与方法
2.1. 实验材料
2.1.1. 实验动物
BALB/c小鼠45只,清洁级,6周龄,雄性,购自山东大学实验动物中心。
2.1.2. 实验试剂
淋巴细胞分离液(天津市灏洋生物制品科技责任有限公司)
胰酶-EDTA(Gibco公司)
胎牛血清(Gibco公司)
MEM-α培养基(Hyclone公司)
DMEM培养基(Hyclone公司)
UltraGROTM细胞营养添加物(美国Helios公司)
青霉素&链霉素(Hyclone公司)
乙醇(国产分析纯)
PBS (Gibco)
台盼蓝(Sigma公司)
DMSO (Sigma公司)
Pristane (Sigma 公司)
FITC-CD90抗体(BD公司)
PE-CD73抗体(BD公司)
PE-CD105抗体(BD公司)
PE-CD44抗体(BD公司)
FITC-CD34抗体(BD公司)
PE-CD45抗体(BD公司)
FITC-HLA-DR抗体(BD公司)
细胞因子添加物FGF、PDGF、VEGF、EGF (美国R & D公司)
细胞培养板、细胞培养瓶(美国Corning公司)
2.1.3. 实验仪器
流式细胞仪:Millipore公司
倒置显微镜:CKX31,OLYMPUS公司
CO2培养箱:HF240,上海力申科学仪器有限公司
酶标仪:BIO-TEK,ELx 808
2.2. 实验方法
2.2.1. 无血清培养脐带间充质干细胞
1) 细胞原代培养及无血清传代培养
UC-MSC细胞原代培养:采用组织块贴壁法。健康足月胎儿脐带经产妇同意后,根据伦理委员会通过的指导原则采集。75%酒精浸泡消毒,将脐带剪成2~3 cm小段,用生理盐水加双抗冲洗5~6次,洗去脐带表面血液。剥离脐静脉及脐动脉,将脐带剪成1 mm3,平铺于T150的细胞培养瓶中,37℃ 5% CO2培养箱放置24 h,加含有胎牛血清的MEM-α培养基。用倒置显微镜观察细胞的生长情况,4~6天后换液,弃去非贴壁细胞后,每3天换液一次。
UC-MSC的无血清传代与培养:当细胞长至80%融合时,用生理盐水冲洗两遍,0.25%胰蛋白酶37℃消化1 min,按照5 Í 104细胞/ml密度,使用含有UltraGROTM细胞营养添加物的DMEM培养基与含有胎牛血清的DMEM培养基1:3配比的混合培养基进行传代,记为P2。当细胞长至80%融合时,用生理盐水冲洗两遍,0.25%胰蛋白酶37℃消化1min,按照5 Í 104细胞/ml密度,使用含有UltraGROTM细胞营养添加物的DMEM培养基与含有胎牛血清的DMEM培养基1:2配比的混合培养基进行传代,记为P3。当细胞长至80%融合时,用生理盐水冲洗两遍,0.25%胰蛋白酶37℃消化1 min,按照5 Í 104细胞/ml密度,使用含有UltraGROTM细胞营养添加物的DMEM培养基与含有胎牛血清的DMEM培养基1:1配比的混合培养基进行传代,记为P3。当细胞长至80%融合时,用生理盐水冲洗两遍,0.25%胰蛋白酶37℃消化1min,按照5 Í 104细胞/ml密度,使用含有UltraGROTM细胞营养添加物的DMEM培养基与含有胎牛血清的DMEM培养基2:1配比的混合培养基进行传代,记为P4。当细胞长至80%融合时,用生理盐水冲洗两遍,0.25%胰蛋白酶37℃消化1min,按照5 Í 104细胞/ml密度,使用含有UltraGROTM细胞营养添加物的DMEM培养基进行传代,记为P4。P4之后传代均用含有UltraGROTM细胞营养添加物的DMEM培养基进行传代。
2) 常规观察和检测
a) 倒置显微镜观察
取第P5的UC-MSC进行常规倒置显微镜观察和HE染色。
b) 扫描电子显微镜观察
取第5代UC-MSC进行扫描电子显微镜观察。预置的盖玻片在爬满细胞后取出,在含2.5%戊二醛的0.1 mol/L PB (pH7.2)中固定12~24 h,0.1 mol/L PB清洗2 h (中间换2~3次新液);再用1%的锇酸固定1.5 h,用双蒸水洗至无锇酸气味;梯度酒精脱水,醋酸异戊酯置换,临界点干燥;IB-5离子溅射仪中镀铂;日立S-570扫描电子显微镜观察并拍照。
2.2.2. 免疫表型检测
取第5代对数生长期的UC-MSC,0.25%胰蛋白酶-EDTA液消化,待大部分细胞脱离瓶底后,用无血清培养基中止消化,1000转/min × 5 min收集细胞,再用含0.1% BSA的PBS悬浮,调整细胞密度为1 × 106个/ml,分别降入标记的鼠抗人CD90、鼠抗人CD105、鼠抗人CD73、鼠抗人CD44、鼠抗人CD45、鼠抗人CD34、鼠抗人HLA-DR 10 μl,另取一管做IgG同型对照,4℃避光孵育30min;PBS清洗两次,离心收集细胞,加入0.5ml PBS重悬,流式细胞仪上机检测。
2.2.3. 诱导分化实验
1) 成骨细胞:取第5代对数生长的UC-MSC,约60%融合时加入成骨诱导培养基(含10%小牛血清,地塞米松0.1 umol/L,Vc 0.2 mmol/L,β-甘油磷酸钠50 mmol/L),每3天全量换液一次,2周后行碱性磷酸酶染色和茜素红S染色。
2) 软骨细胞:取培养第5代处于对数生长期的UC-MSC,约60%融合时加入软骨诱导培养基(含10%小牛血清,TGF-β1 3 ng/mL,地塞米松0.1 umol/L,β-甘油磷酸钠5 mmol/L,Vc 0.2 mmol/L,胰岛素2 ug/mL,丙酮酸钠30 ug/ml,牛血清白蛋白0.4 mg/ml,亚硒酸2 ug/ml,亚油酸2 ug/ml),诱导2周后甲苯胺蓝染色检测胶原表达,RT-PCR检测软骨特异性II型、X型胶原和aggrecan基因表达。
2.2.4. 系统性红斑狼疮小鼠模型建立
取6~8周龄雌性BALB/c小鼠单次腹腔注射pristane 0.5mL,对照组单次腹腔注射PBS 0.5 mL,注射前及注射后每2周行流式细胞术(FCM)检测外周血中IFN-α分泌细胞(CD11b + Ly6Chigh)的比例及细胞活化状态B220 + Aβ1dhigh),ELISA检测血清中自身抗体(anti-dsDNA,anti-sm RNP,antiribosomal P0)的含量。至6个月处死动物,FCM检测腹腔细胞中IFN-α分泌细胞(CD11b + Ly6Chigh)的比例和脾脏中细胞的活化(B220,Aβ1d),采用直接免疫荧光法标记小鼠肾脏免疫球蛋白复合物及HE染色评估小鼠肾脏免疫复合物的沉积及损伤情况。饲养条件:室温25℃左右,湿度60%,每日12 h光照周期(6 am~6 pm),分笼喂养,每笼5~6只,自由进食。
2.3. UC-MSC移植治疗系统性红斑狼疮小鼠有效性评价
2.3.1. 分组与给药
SLE小鼠随机分为模型组和治疗组,每组15只。对照组为健康小鼠,15只。对照组和模型组给予等量的生理盐水;治疗组给予UC-MSC 4 × 105 cells/ml,0.2 ml,给药方式均为尾静脉注射(iv)。
2.3.2. 指标检测
每日观察小鼠的疾病活动度评分、尿蛋白抗双链、肾脏病理情况、DNA (ds-DNA)抗体检测浓度等。
1) 尿蛋白浓度的检测
每三四周测定动物体质量及尿蛋白定量(24 h)。采用代谢笼留取小鼠24 h尿量。尿蛋白浓度测定采用Bradford法以小牛血清蛋白作为标准品,于分光光度计595 nm下测吸光度(A)值,绘制蛋白定量标准曲线,计算实验组和对照组小鼠24 h尿蛋白浓度值。
2) 小鼠肾脏病理学检查
每组取小鼠的肾脏组织于体积分数10%中性甲醛液固定24 h,乙醇脱水,石蜡包埋,切片,厚4 μm,苏木精–伊红染色,显微镜下观察小鼠肾脏细胞数、肾小球硬化、新月体的性质和数目、肾小球毛细血管袢坏死及肾小球毛细血管袢内血栓形成等。
3) 抗ds-DNA抗体检测
按照试剂盒操作说明,在标准品孔中加入标准品50 μL;待测样本孔中。
先加入待测样本10 μL,再加样本稀释液40 μL;37℃恒温箱温育30 min;重复洗板4次;每孔加入酶标工作液50 μL;37℃恒温箱温育30 min;重复洗板4次;每孔依次加入显色剂A、B液50 μL,平板混匀器混匀30 s,37℃避光显色15 min;取出酶标板,每孔加终止液50 μL,终止反应;用450 nm波长测量各孔的吸光度值(A值);计算出标准曲线的直线回归方程。
3. 实验结果
3.1. UC-MSC细胞培养及鉴定
3.1.1. UC-MSC细胞形态
倒置显微镜下观察,原代培养的MSCs细胞24 h后开始贴壁,7天后可见贴壁细胞呈纺锤状。第10~14天后去掉组织块,倒置显微镜下可见散在分布、大小不等、贴壁生长的细胞集落,细胞形态与骨髓来源MSCs相似,多为长梭形细胞,细胞折光性好,核仁明显。细胞融合度达到80%时进行传代,按照5 Í 104细胞/ml的密度接种。接种后的MSCs 2 h后开始贴壁,接种第二天,细胞变为长梭形,生长迅速,接种第3~4天细胞即可达到80%~90%融合度(图1(A))。MSCs可传15代以上,细胞形态无明显变化。
扫描电子显微镜下可见大部分细胞表面光滑(图1(B)),少数梭形细胞有丰富的表面片状皱褶;透射电镜观察显示膜光滑有少量微绒毛的成纤维样细胞占大多数,该细胞核/质比约为1/5,细胞核常染色质丰富、分布均匀,图1(C)可见双核仁,核仁大而结构清晰,核膜完整,可见内质网、高尔基复合体、线粒体、溶酶体和一些髓鞘样小体,胞质中分别有大量核糖体和微丝。
 (A) 第5代UC-MSCs(×40);(B) H&E染色(×200);(C) 第5代人UC-MSCs扫描电子显微镜观察
(A) 第5代UC-MSCs(×40);(B) H&E染色(×200);(C) 第5代人UC-MSCs扫描电子显微镜观察
Figure 1. UC-MSCs were cultured in vitro
图1. 体外培养的人UC-MSCs
3.1.2. 细胞表型
第5代MSCs高表达CD90、CD73、CD105和CD44,低表达CD34、CD45和HLA-DR (见图2);本实验结果表明,脐带来源的MSCs与骨髓、脐血等其他组织来源的MSCs流式检测表型一致。
3.1.3. 细胞分化结果及其鉴定
加入成骨诱导培养基两三天后,细胞开始从长梭形缩短为多角形,细胞体积增大,诱导14天后茜素红S染色为阳性,碱性磷酸酶阳性细胞大幅增加,表现出成骨细胞的特点(图3(A),图3(B));加入软骨诱导培养基后,细胞由长梭形显著缩短为椭圆形,体积增大,甲苯胺蓝染色呈阳性(图4(A)~(C)),II型胶原免疫组化染色阳性(图4(D))。
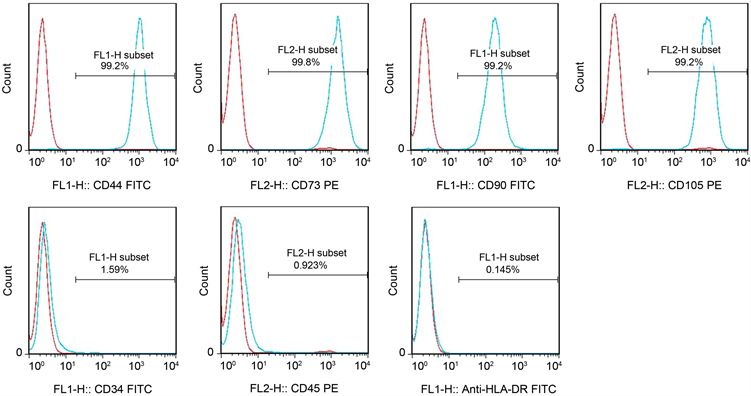
Figure 2. UC-MSCs phenotype was detected by flow cytometry
图2. 流式细胞术检测UC-MSCs表型
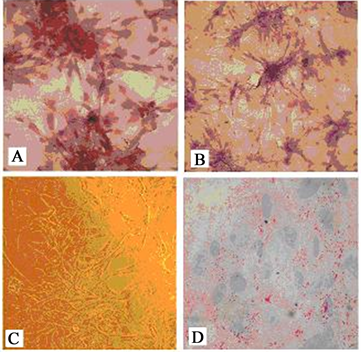 (A) 茜素红染色证明UC-MSC成骨分化;(B) 碱性磷酸酶表达证明UC-MSC成骨分化;(C) UC-MSC细胞向脂肪细胞分化;(D)成脂诱导分化油红O染色效果
(A) 茜素红染色证明UC-MSC成骨分化;(B) 碱性磷酸酶表达证明UC-MSC成骨分化;(C) UC-MSC细胞向脂肪细胞分化;(D)成脂诱导分化油红O染色效果
Figure 3. UC-MSCs were induced to differentiate into osteoblasts and adipocytes in vitro
图3. 体外诱导人UC-MSCs向成骨和脂肪细胞分化((A), (D)×200; (B), (C)×100)
3.2. 建立了完善的质量控制体系
参考国家政策文件、国际规范及行业规范确定细胞标准化检测体系的质控指标和检测流程。参考的文件主要有:《药品管理法》、《人体细胞治疗研究和制剂质量控制技术指导原则》、《干细胞制剂质量控制及临床前研究指导原则(试行)》、《细胞制品研究与评价技术指导原则(试行)》、《多潜能间充质干细胞最低标准》(国际细胞治疗协会,ISCT)、《基于人类细胞的治疗产品指南》(欧洲药品审评委员会)、《21CFR1271人用细胞组织和细胞的组织培养产品》(美国食品药品监督管理局)、《干细胞制剂制备质量管理自律规范》。
 (A) 软骨诱导3天后UC-MSC变宽;(B) 软骨诱导7天后UC-MSC发生聚集;(C) 甲苯胺蓝染色证明UC-MSC成软骨分化;(D) II型胶原的免疫组化染色
(A) 软骨诱导3天后UC-MSC变宽;(B) 软骨诱导7天后UC-MSC发生聚集;(C) 甲苯胺蓝染色证明UC-MSC成软骨分化;(D) II型胶原的免疫组化染色
Figure 4. UC-MSCs were induced to differentiate into chondrocytes in vitro
图4. 体外诱导人UC-MSCs向软骨细胞分化(×100)
参考《中国药典》、国家标准、国际标准(如AAABB、FACT)等法规及行业规范进行具体检测指标质量标准的研究,包括原辅料质量标准的研究与确定、原代细胞质量标准的研究与确定、工作细胞质量标准的研究与确定、细胞终制品质量标准的研究与确定等。
检测方法的研究与确定主要分为6部分:
① 细胞生物学属性,研发并建立细胞形态、细胞染色体核型分析、代谢酶亚型谱分析、表面标志物检测、细胞存活率、生长活性、细胞纯度等快速准确的检测方法;
② 微生物学安全性,研发并建立无菌(细菌和真菌)、支原体、分支杆菌、细胞内外源致病因子、内毒素检测等高灵敏度、适应性强的检测方法;
③ 细胞生物学安全性,研发并建立细胞致瘤性、细胞促瘤性、细胞过敏反应、细胞毒性等检测方法;
④ 细胞生物学有效性,研究并建立细胞分化潜能、免疫调控能力评价、细胞特有的生物学性能评价等检测方法。
⑤ 一般检测,研发并建立细胞外观、细胞悬液浊度、可见异物等检测方法。
⑥ 残留检测,根据细胞的特殊工艺,分析细胞制品中可能含有的杂质情况,研究并建立杂质检测的方法。
主要内容有(图5):

Figure 5. Establish flow chart of quality management system
图5. 质量管理体系建立流程图
3.3. 系统性红斑狼疮小鼠模型的建立
3.3.1. 小鼠血浆中自身抗体检测
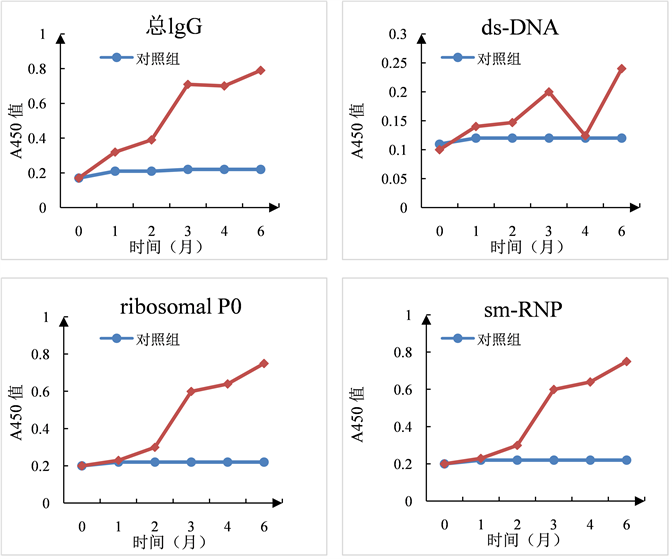
Pristane处理组小鼠血浆中自身抗体含量明显高于PBS,对照组外周高滴度自身抗体的持续存在是SLE 最主要的病理特征之一,也是SLE小鼠模型是否和人类疾病病理模型相近的主要评价指标之一。为此,首先采用ELISA方法检测了pristane处理的不同时段收集的小鼠血浆中总IgG及抗dsDNA、ribosomal P0和sm RNP的IgG含量,该3种抗原属于SLE特异性的自身核抗原,其中抗ds-DNA IgG含量也是目前临床上SLE的主要特异性诊断指标。图6所示,pristane处理组血清中总IgG及anti-dsDNA、anti-ribosomal P0及anti-smRNP IgG含量从第2个月起开始持续上升,自第3个月起抗ribosomal P0 的自身抗体的水平已经明显高于PBS对照组,从第4个月起,抗ribosomal P0和抗sm-RNP的水平均显著高于PBS处理组,至6个月处死时3种抗自身抗体的IgG含量抗体达到最高,相对于对照组均明显升高(P < 0.01),表明pristane处理后可以导致小鼠逐渐产生抗自身核DNA和核蛋白的自身抗体,其中抗ribosomal P0及sm-RNP IgG的增高相对抗dsDNA IgG来说出现的时间更早,也更明显。
3.3.2. 小鼠肾脏病理变化
6个月后处死小鼠,取新鲜肾脏制成石蜡切片,计数小鼠肾小球断面的细胞核数,计数了20个肾小球断面并取其平均值,显示pristane处理组小鼠肾小球断面平均细胞核数明显高于PBS对照组(图7),表明处理组小鼠肾小球发生了明显的细胞性硬化症,处理组小鼠的这种肾脏损伤与大量IgG在肾脏的沉积相一致。
 aP < 0.05,bP < 0.01 vs. PBS组
aP < 0.05,bP < 0.01 vs. PBS组
Figure 6. Total IgG and autoantibody in serum of mice
图6. 小鼠血清中总IgG及自身抗体含量

Figure 7. Renal immune complex deposition and pathological damage in mice
图7. 小鼠肾脏免疫复合物沉积及病理损伤
3.4. UC-MSC移植治疗系统性红斑狼疮小鼠有效性评估
3.4.1. UC-MSC移植对系统性红斑狼疮小鼠尿蛋白定量(24h)的影响
对照组小鼠从16周龄始,尿蛋白逐渐升高。治疗组小鼠在治疗的初期,尿蛋白也逐渐上升,但上升趋势较对照组明显减慢。32周时UC-MSC组水平低于模型组(P < 0.01) (图8)。

Figure 8. Effect of UC-MSCs transplantation on urinary protein quantification in mice with systemic lupus erythematosus (24 h)
图8. UC-MSCs移植对系统性红斑狼疮小鼠尿蛋白定量(24 h)的影响
3.4.2. UC-MSC移植对系统性红斑狼疮小鼠肾脏病理学检查
模型组小鼠肾脏病理显示显著的病理改变(图9),表现为肾小球硬化、肾小球系膜细胞增殖、基质增宽,并可见新月体形成,肾间质内大量淋巴细胞浸润。脐带MSCs组表现为系膜细胞,系膜基质轻至中度增生,局灶性硬化,偶尔可见的肾间质的炎症细胞的浸润。
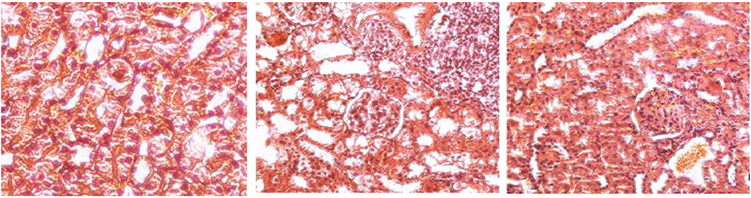
Figure 9. Effect of UC-MSC transplantation on renal pathology in mice with systemic lupus erythematosus
图9. UC-MSC移植对系统性红斑狼疮小鼠肾脏病理的影响
3.4.3. UC-MSC移植对狼疮鼠抗ds-DNA抗体的影响
UC-MSCs组(2.6 ± 0.9)抗ds-DNA抗体水平明显降低,与模型组(4.8 ± 0.7)相比差异有显著性意义,见表1。

Table 1. Changes of serum antibodies after umbilical cord MSCs transplantation ( x ¯ ± s , A )
表1. 脐带MSCs移植后血清抗体的变化
aP < 0.05, vs.模型组。
4. 讨论
人脐带MSCs是一类具有自我更新、增殖和多向分化潜能的干细胞,具有来源丰富、易于采集、保存和运输、移植前无需清髓处理、避免伦理争议等诸多优点 [8] [9] [10] [11]。由于MSCs没有MHC限制性,在异体MSCs移植时无排斥反应发生,而且MSCs在分化成其他细胞类型时仍保留其特性,临床上已将MSCs应用于组织工程、大剂量化疗后造血支持、治疗移植物抗宿主病等。
大量研究表明可通过多种途径调节炎症因子的释放,在体内外均可发挥免疫抑制作用 [12] [13],此外,MSCs还可诱导免疫耐受、抑制自身免疫反应,从而发挥治疗作用。目前认为MSCs的作用机制可能主要通过与免疫细胞(如T淋巴细胞,树突状细胞,B淋巴细胞等)直接接触发挥效应,还可能通过改变细胞因子分泌网络间接影响免疫细胞,但确切机制仍不清楚。
近年来对肾损伤疾病的研究也显示MSCs输注可促进肾损伤的结构修复和功能恢复,MSCs可迁移至受损的肾脏并分化为肾小管上皮细胞,加快肾小管细胞增殖速度 [14]。大量研究结果表明健康人骨髓MSCs移植治疗狼疮鼠能显著降低尿蛋白和血抗ds-DNA抗体水平,狼疮鼠肾病理显著改善 [15] [16]。结果发现,MSCs移植后,24 h尿蛋白定量降低、抗dsDNA抗体水平下降、肾脏病理改变明显好转,表明MSCs移植对狼疮肾炎具有治疗作用,这与国内外的研究报道相一致。实验结果提示MSCs移植可以通过抑制促炎因子的作用而发挥免疫抑制作用;同时,尿蛋白定量(24 h)降低、抗ds-DNA抗体水平下降,肾小球硬化、间质纤维化程度及间质炎症细胞浸润程度较对照组减轻,这些结果均表明MSCs对狼疮鼠肾脏病变具有修复作用。