1. 引言
脆性X综合征(Fragile X syndrome ,FXS)是一种智力缺陷和自闭症谱系的单基因遗传病 [1]。FXS患者在智力发育方面存在缺陷,语言交流能力较弱,人际交流时回避直接对视,存在社交障碍和广泛性焦虑。FXS患者具有与正常人不同的体态特征,伴有前额和下颌突出、耳朵外凸、腭弓较高、嘴大唇厚、关节松弛、脊柱侧凸等外在症状 [2]。已有大量研究表明,FXS是一种单基因遗传疾病,位于Xq27.3染色体的Fmr1 (Fragile X mental retardation 1)基因在5’端的CGG三核苷酸重复系列扩增超过200拷贝,导致启动子区域的胞嘧啶发生甲基化修饰 [3],染色质组蛋白过度乙酰化 [4],致使Fmr1基因沉默。该基因编码的蛋白FMRP (Fragile X mental retardation protein)是一种mRNA结合蛋白,它所调控的mRNA靶分子具有广泛性和不确定性。FMRP的功能主要是抑制mRNA翻译,然而也有FMRP促进孤独症相关大分子蛋白mRNA翻译的报道 [5]。此外,FMRP通过RNA结合蛋白参与pre-mRNA的剪切 [6]。
Fmr1基因敲除(Knockout, KO)小鼠是FXS的动物模型,具有学习记忆障碍、易发癫痫、多动等行为学症状。在Fmr1基因敲除后,由于FMRP的缺失,失去FMRP抑制作用的mRNA翻译水平升高,造成神经元蛋白表达量过度增加,突触的数量呈现非活动依赖性增加,使神经网络信号传递出现异常 [7] [8]。
腺相关病毒(AAV)是一种非包膜微小病毒,病毒颗粒直径约20~26 nm,其所介导的基因独立于宿主基因组稳定表达。与其它类型的病毒载体相比,AAV具有较低的免疫原性,在宿主神经组织中可以长时间介导外来基因表达,例如,AAV介导的基因可以在帕金森疾病非人灵长类动物模型脑组织中持续表达15年 [9],在帕金森病人脑中持续表达5年 [10]。因此,AAV作为安全性较高的病毒载体应用于中枢神经系统疾病的基因治疗受到广泛关注。据前人报道,基于AAV构建的FMRP表达载体可以有效修复Fmr1 KO小鼠的海马脑区LTD [11],并改善幼年Fmr1 KO小鼠成年后的重复刻板行为和社交支配行为 [12]。本研究采用成年Fmr1 KO小鼠,观察AAV9-FMRP在成年Fmr1 KO小鼠各脑区的分布表达情况,为今后进一步应用基因疗法治疗成年后的FXS病患提供参考依据。
2. 材料与方法
2.1. 实验动物
本研究采用的Fmr1 KO小鼠由美国密歇根州立大学Wang H.B.教授惠赠。动物房的温度控制在21℃~23℃、湿度保持在50%左右,每天光照时间12 h。小鼠自由饮食饮水。同窝出生的野生型(Wildtype,WT)小鼠作为对照组,所有实验小鼠均为成年(≥3月龄)雄性小鼠。
2.2. AAV9质粒共转染293T细胞
使用去内毒素的质粒提取试剂盒进行质粒提取,将获得的质粒−20℃保存。配制Ca-DNA转染液:取质粒DNA共75 μg,包括两个AAV9辅助质粒(p-Rac,p-Helper)和目的基因质粒(pAAV-SYN1-Fmr1)各25 μg,加入500 uL 0.25 M的CaCl2溶液,用ddH2O补足CaCl2溶液体积至2.5 mL,再加入2.5 mL 2 × BES溶液,充分混合均匀。将293T细胞培养皿中的旧培养基移除,更换为培养基A(将含10% FBS的DMEM按体积1000:1加入25 mM的氯喹溶液)15 mL,孵育15 min,向培养基中均匀滴加Ca-DNA转染液5 mL。滴加转染液后,将培养皿置于37℃、5% CO2培养箱中孵育3~4 h。移除所有培养基,每个15 cm皿中沿壁缓慢加入2~3 mL PBS溶液洗涤一次。吸弃PBS,加入培养基B (按体积100:1在含10% FBS的DMEM中加入500 mM的丁酸钠溶液) 25 mL,培养72 h后收集细胞。收取细胞后反复冻融3次,配制不同浓度的碘克沙醇溶液,通过离心、沉淀、透析等步骤获得纯化的AAV9-FMRP病毒载体溶液,保存于−80℃。
2.3. 实时定量PCR测定基因组拷贝数
将5 μL待测AAV9-FMRP样品或对照质粒(pAAV-SYN1-Fmr1,5 × 107 GC/μL)加入15 μL DNase I消化反应液中,37℃孵育30 min,对DNaseⅠ失活处理后转入95℃,孵育10min,取出放在冰盒中。对AAV9-FMRP样品或对照质粒进行稀释。实时定量PCR反应体系20 μL,包括2 × SYBR Mix 10 μL、ploy A forward primer 1 μL、ploy A reverse primer 1 μL、待测样品2 μL、无核酸酶水6 μL,每个样品各3个重复。设置以下程序运行PCR:预变性95℃ 10 min;然后95℃ 30 s,60℃ 20 s,72℃ 20 s,35个循环;溶解曲线:95℃ 5 s,65℃ 1 min,40℃ 10 min。Q-PCR运行结束后,利用换算系数和AAV基因组单链性质计算AAV9-FMRP载体基因组拷贝数:GC拷贝数/mL = PCR运行得到的平均拷贝数 ÷ 5 μL × 2 × 稀释倍数(DNase稀释4倍 × 后续稀释10,000倍) × 1000。
2.4. 立体定位注射
使用1%戊巴比妥钠将小鼠深度麻醉(100 mg/kg),固定于立体定位仪,使用体温加热垫保持麻醉小鼠肛温37 ± 1℃。玻璃毛细管顶端定位于双侧侧脑室(前囟旁开±0.8 mm,前囟后0.3 mm,颅骨表面向下深度2.2 mm)。使用微量进样器,将1 μL AAV9-FMRP或PBS以0.1 μL/min的速率注入单侧侧脑室,注射完成后玻璃管静置10min。按照基因型和注射溶液把小鼠分为4组,分别是WT + PBS组、WT + AAV9-FMRP组、KO + PBS组、以及KO + AAV9-FMRP组。手术后的各组小鼠返回笼中饲养4周。
2.5. 免疫组化检测
各组小鼠深度麻醉后进行心脏灌流取脑,30%蔗糖脱水,OTC包埋,冰冻切片(15 um)。PBST (0.3% Triton X-100)浸洗切片10 min,5% BSA室温封闭1 h,FMRP (Cell Signaling Technology, USA)一抗4℃孵育过夜。二抗HRP (Millipore, USA)室温孵育1 h,DAB显色,显微镜观察、拍照。采用ImageJ软件,对脑组织切片进行DAB染色强度和阳性细胞数初步分析。
2.6. 免疫荧光检测
使用适量的EDTA-柠檬酸钠抗原修复液,在微波炉中使用低火,对切片进行20 min的抗原修复。PBST (0.3% Triton X-100)浸洗切片3次,每次10 min。5% BSA室温孵育1 h,FMRP、Neun一抗4℃孵育过夜,1 × PBS浸洗切片3次,每次10 min。DAPI室温孵育10 min,1 × PBS浸洗切片10 min。荧光二抗室温孵育1 h,对切片进行封片。荧光显微镜观察、拍照。
3. 结果
3.1. AAV9-FMRP病毒载体制备
为了验证氯化钙转染细胞方法的可靠性,我们以p-EGFP质粒转染293T细胞,在不同的时间点(24 h、48 h和72 h)用荧光显微镜观察,发现在p-EGFP质粒转染48 h和72 h后,293T细胞已经能够稳定呈现较强的绿色荧光(图1(A))。因此,我们采用氯化钙转染细胞方法,将两个辅助质粒(p-Rac,p-Helper)和目的基因质粒(pAAV-SYN1-Fmr1)共同转染293T细胞,得到包含目的基因的AAV9-FMRP病毒载体(图1(B))。在转染293T细胞72 h后,裂解293T细胞获取病毒载体,进行病毒载体富集和纯化,经基因测序证明病毒载体构建成功。Q-PCR测定结果显示AAV9-FMRP病毒载体拷贝数为1.5 × 1011 GC/mL (图1(C))。
 (A) p-EGFP质粒转染293T细胞。(B) AAV9-FMRP结构示意图。(C) Q-PCR结果分析。
(A) p-EGFP质粒转染293T细胞。(B) AAV9-FMRP结构示意图。(C) Q-PCR结果分析。
Figure 1. Acquired AAV9-FMRP viral vector through 293T cell transfection
图1. 转染293T细胞获取AAV9-FMRP病毒载体
3.2. AAV9-FMRP介导FMRP在各脑区的表达分布
免疫组化结果发现,FMRP在野生型小鼠的额叶皮层、顶叶皮层、海马、枕叶皮层和小脑等脑区均有表达。在侧脑室注射AAV9-FMRP病毒载体后,野生型小鼠除小脑外,其它各脑区的FMRP表达水平有所增加。然而,Fmr1 KO小鼠所有脑区的FMRP表达缺失,在注射病毒载体后,其额叶皮层、顶叶皮层和海马脑区出现了表达FMRP的阳性细胞,说明AAV9-FMRP病毒载体使Fmr1 KO小鼠的这些脑区获得了FMRP的表达(图2)。
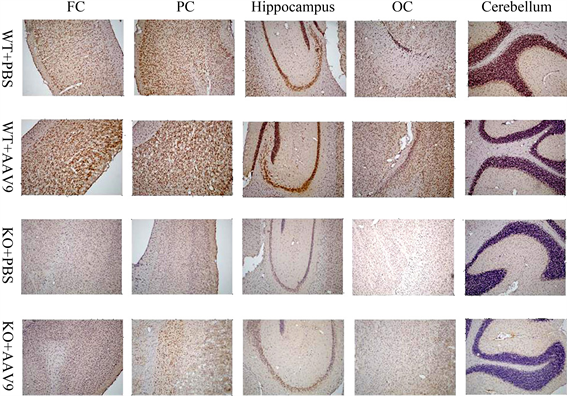 FC: Frontal cortex;PC: Parietal cortex;OC: Occipital cortex。100×。
FC: Frontal cortex;PC: Parietal cortex;OC: Occipital cortex。100×。
Figure 2. AAV9-FMRP vector-mediated FMRP expression in various brain regions
图2. AAV9-FMRP载体介导FMRP在各脑区的表达
3.3. AAV9-FMRP介导的FMRP表达与海马神经元共定位
免疫荧光检测结果显示,FMRP的表达定位于野生型小鼠海马CA3区神经元胞质。在侧脑室注射病毒载体后,Fmr1基因缺失小鼠海马CA3区可检测到FMRP阳性神经元,表明AAV9病毒载体介导的FMRP在海马神经元存在获得性表达(图3)。
4. 讨论
有多种AAVs包括AAV2、AAV5、AAV8、AAV9等可用于中枢神经系统疾病的基因治疗,其中AAV9可以在大脑和脊髓中广泛表达,优先结合神经元和胶质细胞 [13]。本研究采用氯化钙转染293T细胞的方法制备了AAV9-FMRP病毒载体,该病毒载体包含神经元特异性启动子SYN1,有助于提升FMRP在神经元的特异表达。通过侧脑室注射AAV9-FMRP,可以使Fmr1基因缺失的成年小鼠大脑重新获得FMRP的表达,其表达范围主要集中在额叶皮层、顶叶皮层和海马脑区。在Fmr1KO小鼠距离侧脑室较远的脑区,如小脑和枕叶皮层,未发现AAV9介导的FMRP表达或表达较少,其原因可能是由于病毒载体注射位点与FMRP未表达脑区之间物理距离较远;另外,前人报道发现AAV9-FMRP在幼年Fmr1KO小鼠侧脑室注射56天后,FMRP在海马神经元的表达水平达到野生型小鼠正常水平的50% [12],因此,本研究
 绿色荧光为FMRP,红色荧光为Neun,蓝色荧光为DAPI。200×。
绿色荧光为FMRP,红色荧光为Neun,蓝色荧光为DAPI。200×。
Figure 3. FMRP expression in hippocampal CA3 neurons of four groups of mice
图3. FMRP在各组小鼠海马CA3神经元的表达情况
在AAV9-FMRP注射4周后采样检测,有可能病毒载体拷贝数量尚未达到峰值,从而影响FMRP在Fmr1KO小鼠各脑区的表达水平。
前人研究表明,从基因水平通过AAV9载体介导FMRP在FXS模型小鼠脑中获得性表达,可以改善该模型小鼠的重复刻板行为和异常的社交支配行为 [12],恢复正常的长时程突触抑制 [11],可以推测FMRP获得性表达之后,FXS模型小鼠某些脑区神经元的结构和功能能够得到一定程度的修复。AAVs病毒载体相较于慢病毒和腺病毒具有较低的免疫原性,可以介导不依赖于宿主基因组的目的基因进行长时间的稳定表达 [14],因此AAVs是介导目的基因在体内表达的较优选择。有研究发现,AAV8-GFP在CMV启动子控制下,过量表达的GFP对黑质多巴胺能神经元存在一定程度的毒性作用 [15]。然而,本研究采用的AAV9-FMRP是通过SYN1启动子调控,该启动子具有神经元特异性 [16],目前我们尚未见SYN1调控的AAV9载体具有神经毒性的报道。基于AAV9开展针对FXS以及其它中枢神经系统疾病(如帕金森病)的基因治疗手段,安全性较好,对于治疗神经系统疾病具有潜在的应用前景 [17]。
基金项目
本研究受到国家自然科学基金项目(31660273)和云南省教育厅基金研究生项目(2018Y045)资助。
参考文献
NOTES
*通讯作者。