1. 引言
脑卒中是一种严重的急性脑血管疾病,是全球主要的致死原因之一 [1] [2]。在中国,缺血性脑卒中占所有脑卒中的80%以上,它最常见的机制是AS斑块的形成。目前普遍认为,免疫炎症反应是AS形成的主要作用机制之一 [3] [4]。
NOD样受体热蛋白结构域相关蛋白3 (nucleotide binding oligomerization domain-like receptors protein-3, NLRP3)与凋亡相关微粒蛋白(ASC)、pro-caspase-1共同组成了NLRP3炎症小体,它在动脉粥样硬化形成的炎症过程中占据重要地位 [5] [6] [7] [8]。近年来的研究发现,在人AS组织中,NLRP3炎症小体相关蛋白的表达明显增高 [9] [10]。而细胞外的嘌呤能离子通道型受体7 (purinergic ligand-gated ion channel 7 receptor, P2X7R)能够快速开放钾离子通道,是激活NLRP3炎症小体的重要因子 [11] [12]。
MiR-155是炎症相关疾病的多效性调节因子,在多种生理和病理过程中都起到了重要的调控作用 [13]。我们在过去的研究中发现,miR-155能够调控NLRP3炎症小体,影响动脉粥样硬化斑块的形成和发展 [14]。因此,我们推断,miR-155可能通过P2X7R途径,间接地激活NLRP3炎症小体,促进IL-1β成熟,激活炎症反应,从而推动AS的进展。本研究在ApoE−/−小鼠中建立颈AS模型,研究miR-155对P2X7R以及NLRP3炎症小体相关蛋白表达的影响,及其在颈AS斑块形成中的可能机制,为预防和治疗AS提供理论基础。
2. 材料与方法
2.1. 材料
我们从北京维通利华公司购买ApoE−/−小鼠(6周龄,雄性,SPF级),小鼠体重为23.60 ± 1.69 g,饲养于青岛大学附属医院动物实验室,饲养条件为:室温、暗光循环,高脂饮食成分为:15%脂肪、0.25%胆固醇(北京科澳协力饲料有限公司)。内径0.3 mm的硅胶环(山东医疗器械研究所)。慢病毒(汉恒生物):LV-miR-155 (HH20180330GZH-LV01),LV-miR-155-RNAi (HH20180330GZH-LV02);LV-P2X7R-RNAi (HH20180330GZH-LV03)。miR-155 引物(TIANGEN生物),SYBR qRT-PCR试剂盒(Takara)。抗体:β-actin (Elabscience),P2X7R、NLRP3、IL-1β (abcam),ASC (CST),caspase-1 (Santa Cruz Biotechnology),兔抗小鼠IgG (Elabscience)。ECL显影液(Millipore公司)。
2.2. 动物模型
在获得青岛大学附属医院医学伦理委员会的批准后,我们开始进行动物实验,我们保证动物实验遵守相关法律和机构准则,并努力减轻动物的痛苦。按照随机原则,将36只小鼠分为6组(每组6只):blank 组(未转染慢病毒),negative control (NC)组(转染空载慢病毒),miR-155 mimic组(转染 LV-miR-155),miR-155 inhibitor组(转染LV-miR-155-RNAi),miR-155 mimic and NC组(转染LV-miR-155及空载慢病毒),miR-155 mimic and P2X7R(-)组(转染LV-miR-155及LV-P2X7R-RNAi)。所有小鼠均喂以高脂饮食(15%脂肪、0.25%胆固醇)。小鼠喂养至8周龄后,给小鼠右颈总动脉插入硅胶环,诱导所有ApoE−/−小鼠的颈动脉形成AS斑块,术后48小时从尾静脉注射慢病毒200 μL (2 × 108 TU∙mL−1),建立所需实验模型。继续诱导8周后,用1.5%异氟烷将小鼠安乐死,获得小鼠右颈动脉标本,放置于液氮中备用。
2.3. 苏木精–伊红(HE)染色
取小鼠右颈动脉标本,将右颈总动脉用4%多聚甲醛固定,石蜡包埋,切片。用二甲苯I 10 min、二甲苯II 2 min、二甲苯III 1 min,梯度酒精10 min脱蜡,用水冲洗2 min,再用苏木精染色5 min,用水冲洗。然后,用0.3%盐酸乙醇分化2 s,用水冲洗30 s。用0.2%氨水返蓝2 s,用水洗涤3次,每次洗涤2 min,切片在伊红中染色30 s,用水洗涤3次,用梯度酒精、二甲苯I、二甲苯II洗涤3 min,每次洗涤3 min。在玻片上的二甲苯完全风干后,将中性凝胶滴在玻片上,然后用干净的盖玻片密封。在显微镜下观察血管的病理变化。
2.4. 实时荧光定量PCR
从液氮中取实验小鼠右颈总动脉标本,用Trizol提取样本总RNA。每20 mg样本加入1 mL Trizol,将样本捣碎匀浆,室温孵育15 min,4℃、12,000 rpm离心10 min,取上清。加入200 μL氯仿,手动震荡15 s,室温孵育15 min,4℃、12,000 rpm离心10 min,取出最上层水相。加入600 μL异丙醇,混匀,−20℃放置1 h。4℃、12,000 rpm离心15 min,可见RNA沉淀。弃上清,滤纸吸干余液,加入预冷的75%乙醇1 mL,洗涤。4℃、12,000 rpm离心10 min,弃上清,空气干燥15 min,得到RNA沉淀。加入10 μL DEPC水溶解。用分光光度计在260 nm光程下测量RNA浓度。根据逆转录反应试剂盒(112315, Takara)的说明,在聚合酶链反应器上进行逆转录,合成cDNA模板,逆转录反应条件如下:37℃,1 h;85℃,5 min;反应在4℃终止,产生的cDNA在−20℃冰箱储存。根据SYBR qRT-PCR试剂盒(639676, Takara)的使用说明,将cDNA用于实时荧光定量pcr,反应体系为20 μL,包括:10 μL SYBR预混料,2 μL cDNA模板,0.6 μL正向引物和0.6 μL反向引物,6.4 μL ddH2O。MiR-155引物(TIANGEN生物)序列为TGC GGT TAA TGC TAA TCG TGA TAG G,内参U6 (SYBR qRT-PCR试剂盒,Takara)序列为:5’-TGA AGG TCG GAG TCA ACG GAT TTG GT-3’ (forward)和5’-AAA TGA GCC CCA GCC TTC ATG-3’ (reverse)。反应条件为:95℃预变性30 s,95℃预变性45个周期30 s,退火20 s,72℃延伸30 s。随后,用2−ΔΔCt法分析miR-155的相对表达水平。
2.5. Western Blot
从液氮中取实验小鼠右颈总动脉标本,用RIPA提取样品总蛋白。按照RIPA:PMSF:磷酸酶抑制剂 = 100:1:1的比例配置蛋白裂解液,每20 mg样本中加入200 μL的蛋白裂解液,将样本捣碎匀浆,冰上静置10 min,使样本充分裂解,裂解后的样本在4℃、12,000 rpm离心5 min,取上清液。使用BCA法测蛋白浓度,将样品存放于−20℃冰箱备用。进行分离胶浓度为12%,浓缩胶浓度为5%的SDS-PAGE电泳实验,上样量为20 μL,随后用湿转法将蛋白转移到PVDF膜上,用5%脱脂奶粉将PVDF膜进行封闭,时间为1.5 h。之后将封闭好的PVDF膜分别放入含有β-actin (E-AB-20031, Elabscience, 1:1000)、P2X7R (ab229453, abcam, 1:1000)、NLRP3 (ab210491, abcam, 1:1000)、ASC (67824, CST, 1:1000)、caspase-1 (sc-56036, Santa Cruz Biotechnology, 1:500)、IL-1β (ab9722, abcam, 1:1000)的一抗中孵育过夜,孵育温度为4℃。第二天,回收一抗,用含0.1% tween 20的TBST进行每次10 min的洗膜,共三次。将膜在5%脱脂奶粉配置的兔抗小鼠IgG (E-AB-1003, Elabscience, 1:5000)中室温孵育1.5 h,然后用TBST洗三次。最后,用ECL法进行显色,凝胶成像分析系统用于对PVDF膜的拍照及后续分析。
2.6. 统计学分析
采用prism 5和spss22.0统计软件进行对数据进行统计学分析。用
来表示计量资料数据,单因素方差分析用于多组间均数的差异性比较,当P < 0.05时认为差异有统计学意义。
3. 结果
3.1. miR-155对ApoE−/−小鼠颈AS斑块的形成的影响
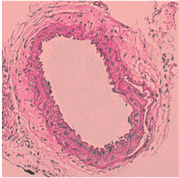
使用HE染色观察小鼠颈动脉病理特点,发现,blank及NC组予以颈动脉套管处理后,可见明显内膜增厚,内膜下可见大量炎性细胞、泡沫细胞;与NC相比,miR-155 mimic组可见明显的管腔内斑块,管壁进一步增厚,管腔狭窄严重,几不可见,内膜下泡沫细胞与胆固醇结晶明显增多;而miR-155 inhibitor组程度明显减轻(图1)。
 (a)
(a)  (b)
(b) 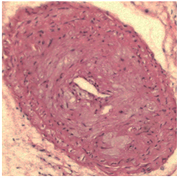 (c)
(c) 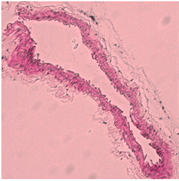 (d)
(d)
Figure 1. Effect of miR-155 on the formation of cervical AS plaque in ApoE−/− mice (HE, × 400)
图1. miR-155对ApoE−/−小鼠颈AS斑块的形成的影响(HE染色,400倍)
3.2. 各组小鼠miR-155表达
使用实时荧光定量PCR技术,测定miR-155在每组小鼠颈AS斑块中的表达水平,结果显示blank组和NC组的表达水平无显著差异;与NC组相比,miR-155的水平在miR-155 mimic组中显著升高,而miR-155 inhibitior组则显著降低(P < 0.05) (图2)。
 注:*P < 0.05,与NC相比。
注:*P < 0.05,与NC相比。
Figure 2. The expression of miR-155 in carotid artery of mice (qRT-PCR)
图2. miR-155在小鼠颈动脉组织中的表达水平(qRT-PCR)
3.3. miR-155对ApoE−/−小鼠颈AS斑块中P2X7R、NLRP3炎症小体和IL-1β的表达的影响
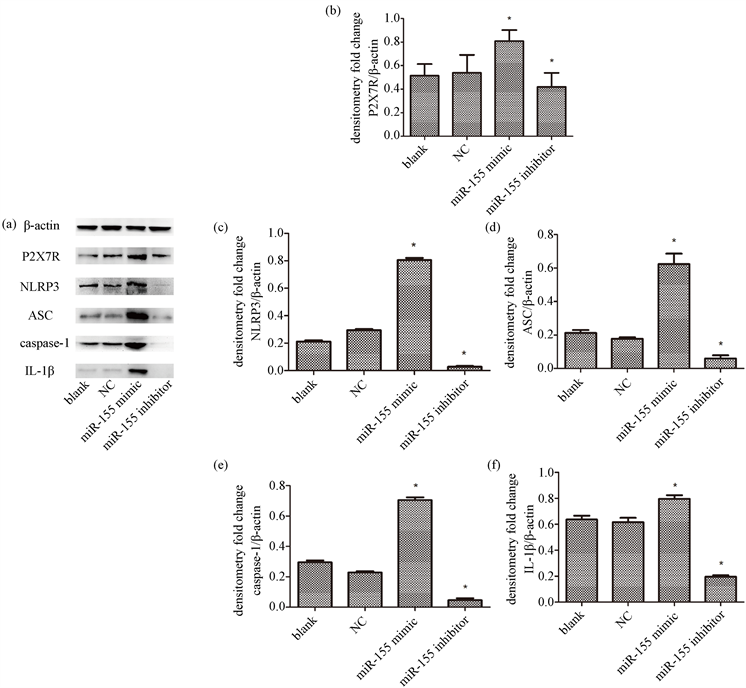
为研究miR-155影响AS斑块形成的机制,我们用western blot方法,检测了P2X7R、NLRP3炎症小体相关蛋白(包括NLRP3、ASC和caspase-1)和IL-1β表达时,发现,blank组和NC组小鼠颈动脉AS斑块中,P2X7R、NLRP3、ASC、caspase-1以及IL-1β表达无明显差异;而上调miR-155,P2X7R、NLRP3、ASC、caspase-1和IL-1β的表达均较NC有明显增多,下调miR-155,上述蛋白较NC有明显的减少(P < 0.05)。图3(a)用Western blot法检测β-actin、P2X7R、NLRP3、ASC、caspase-1、IL-1β的表达。(b)-(f)用直方图展示P2X7R (b)、NLRP3 (c)、ASC (d)、caspase-1 (e)、IL-1β (f)的相对表达(与β-actin水平相对比;*与NC组比较,P < 0.05)。
 注:*P < 0.05,与NC相比。
注:*P < 0.05,与NC相比。
Figure 3. Effect of miR-155 on the expression of P2X7R, NLRP3 inflammasome and IL-1β in cervical AS plaque of ApoE−/− mice (western blot)
图3. miR-155对ApoE−/−小鼠颈AS斑块中P2X7R、NLRP3炎症小体和IL-1β的表达的影响(western blot)
3.4. miR-155通过P2X7R影响NLRP3炎症小体及下游IL-1β的表达
为了进一步研究miR-155促炎作用的机制,我们分别给miR-155mimic组小鼠注射了空载慢病毒和LV-P2X7R-RNAi,并检测了NLRP3、ASC、caspase-1以及炎症因子IL-1β表达。结果发现,miR-155 mimic组与miR-155 mimic and NC组上述蛋白表达差异不大,而抑制P2X7R的小鼠中,上述蛋白的表达水平明显减少(P < 0.05) (图4)。
4. 讨论
AS是胆固醇在动脉内膜上堆积,使血管腔变窄甚至堵塞,或是使管壁硬化、破裂,从而引起急性脑血管疾病的发生,AS是缺血性脑卒中的主要病因之一。近几十年来的研究证实,在AS发生发展的整个过程中,炎症反应都发挥了重要作用 [3] [4]。microRNA是一类长度为2l~25个核苷酸的小分子非编码RNA,在转录后抑制基因的表达,是影响AS中信号传递的关键因子。miR-155也是microRNA中的一员。miR-155是一种多效性的调节因子,参与炎症、分化、和氧化应激等多种过程,能够在多种疾病对炎症反应的进程起到重要的调控作用 [15] [16] [17];同时,miR-155也是参与AS调节的重要分子 [13] [14]。本研究探讨了miR-155在ApoE−/−小鼠的颈AS形成过程中的作用及其相关机制。
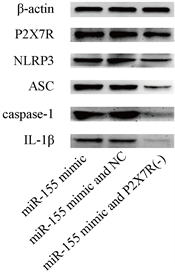 (a)
(a)  (b)注:*P < 0.05,与miR-155 mimic and NC相比。
(b)注:*P < 0.05,与miR-155 mimic and NC相比。
Figure 4. miR-155 affects the expression of NLRP3 inflammasome and IL-1β through P2X7R (western blot))
图4. miR-155通过P2X7R影响NLRP3炎症小体及下游IL-1β的表达(western blot)
我们用高脂饮食喂养ApoE−/−小鼠,并给小鼠进行颈动脉套管,从而构建小鼠颈AS模型。通过qRT-PCR技术验证了不同miR-155表达水平的实验小鼠模型的成功建立。在我们过去的研究中发现,高表达的miR-155能够使小鼠颈AS程度明显加重,管腔内有明显的斑块形成 [14]。因此,我们认为miR-155能够促进ApoE−/−小鼠AS的进展。
NLRP3是一种模式识别受体(PRR),属于NOD样受体(NLR)家族的3个亚家族之一,它与ASC、pro-caspase-1共同组成了NLRP3炎症小体。NLRP3炎症小体能够被多种损伤相关分子模式(PAMP)以及病原体相关分子模式(DAMP)所激活,其活化后(pro-caspase-1活化为caspase-1),能够将IL-1β前体(pro-IL-1β)裂解为成熟体IL-1β,启动炎症反应,促进炎症相关性疾病的进展 [8]。近年来的研究发现,miR-155能够在系统性硬化、银屑病、移植物抗宿主反应(GVHD)等多种炎症相关性疾病中,对NLRP3炎症小体进行调控,影响疾病的进程 [15] [16] [17]。本课题组在过去的研究中发现,在巨噬细胞中,miR-155能将NLRP3炎症小体激活,使其下游的炎症因子成熟,促进AS的进程 [14]。我们通过western blot实验检测小鼠颈动脉斑块,结果发现miR-155能显著使NLRP3炎症小体相关蛋白及IL-1β表达增加,这与我们过去的体外研究结果一致 [14]。但miR-155影响NLRP3炎症小体表达的具体作用机理仍不甚明确。
P2X7R是purinergic受体家族中的一个成员,是一类选择性对的钾离子、钠离子及钙离子可通透的通道,也是炎症反应中重要的调控因子。Piscopiello等 [18] 发现,P2X7R与人AS斑块形成过程中的炎症反应有关;Lin等 [19] 的研究发现,在巨噬细胞中,抑制P2X7R能够下调PMA诱导的EMMPRIN和MMP-9的表达,从而影响AS的进展。过去的研究也发现,作为一种ATP配体门控的二次跨膜受体,细胞外的P2X7R能够使钾离子外流,使细胞内的钾离子浓度降低、NLRP3炎症小体激活,介导炎症相关级联反应发生 [20],这一过程同样也发生在动脉粥样硬化AS疾病中 [12]。本次研究利用western blot技术,发现,上调miR-155,能够使小鼠颈AS斑块中的P2X7R的表达水平显著上升;在抑制P2X7R表达的miR-155 mimic小鼠中,NLRP3炎症小体相关蛋白以及其下游的炎症因子(IL-1β)的表达均受到抑制,这也证实了P2X7R在miR-155激活NLRP3炎症小体过程中起到了关键作用,并影响了后续的炎症反应的进展。
5. 结论
综上所述,本次实验证明,在ApoE−/−小鼠中,miR-155能够通过调控P2X7R,使NLRP3炎症小体被激活,增强后续炎症反应,从而促进AS斑块的形成。但是,AS形成机制复杂,miR-155作用机制也多种多样,是否有其他因子参与其中,仍需大量的研究去探索;而且,动物与人体的差异问题也难以解决。尽管如此,miR-155及P2X7R在AS形成过程中的重要作用不可忽视,深入了解miR-155及P2X7R在AS中的作用,将为预防和治疗AS提供理论基础。
基金项目
国家自然科学基金资助项目(81771259,81971111),科技部国家重点研发计划(2017YFC1310903)。
致谢
感谢潘旭东教授国家自然科学基金资助项目(81771259)及科技部国家重点研发计划(2017YFC1310903)对于本研究的支持,感谢马爱军教授国家自然科学基金资助项目(81971111)对本研究的支持及对于实验设计的指导,感谢朱晓岩主任对文章撰写提供的指导,感谢尹瑞华博士提供的实验帮助。
NOTES
*通讯作者。