1. 引言
随着社会的发展以及工业的进步,重金属资源被应用于生产与生活的方方面面,在这其中重金属铬的使用最为常见。在电镀、印染、木质材料防腐、保健医药以及皮革鞣制等行业均有含重金属铬的应用 [1]。在这些行业当中使用的铬主要为三价铬(Cr(III))以及六价铬(Cr(VI))。其中,Cr(III)的毒性和氧化性较低,其在碱性条件下会形成沉淀,因此较为容易从水体中去除。而Cr(VI)则具有比Cr(III)强100倍的生物毒性,同时也具有极强的氧化性,其在水体中能一直以离子形式存在,不容易从水体中去除,因此对环境危害性十分大 [2]。在工业中,主要通过化学还原的方式去除水体中的Cr(VI) [3]。除此之外,离子交换法、膜分离法、电解法和微生物还原法也是目前工业中应用较多的几种Cr(VI)处理方法 [4]。但是这几种方法都或多或少具有处理效率低、处理费用高以及会产生难以回收利用的副产物等等不足 [5]。因此,开发较为绿色、高效的Cr(VI)处理方法十分必要。
光催化技术是近些年来备受瞩目的一种技术,其处理Cr(VI)的原理是:光催化剂吸收光子,光生电子发生跃迁,形成电子–空穴对,其中电子与光催化剂表面吸附的Cr(VI)离子结合,Cr(VI)得到电子被还原为Cr(III) [6]。这种处理Cr(VI)的方法具有副产物少、绿色和高效等优点。目前能处理Cr(VI)的光催化材料较多,例如TiO2 [7]、CdS [8]、g-C3N4 [9]、聚吡咯 [10]、Bi2MoO6 [11]、BiVO4 [12]、Bi2O3 [13]、Bi2WO6 [14] 和Bi2S3 [15] 等。在这些光催化剂当中Bi2S3具有较大的光响应范围与较高的导带还原电势,其在关于Cr(VI)的处理方面的报道较多。由于以上被报道光催化剂都是粉体材料,这些粉体光催化剂在实际使用时会发生一定程度的聚集,这一定程度上影响了其光催化性能 [16] [17] [18]。
将光催化剂与磁性材料复合是提升其对Cr(VI)的光催化还原效果的一种常见的方法,同时还能赋予光催化剂磁性。Fe、Fe3O4和Fe3ZnO4等 [19] 磁性材料吸附Cr(VI)的性能较差,而Fe3S4却对Cr(VI)具有较高的吸附性能 [20]。Fe3S4在自然界中主要存在于硫复铁矿当中,其物理性质与Fe3O4类似,具有顺磁性 [21] [22] [23]。同时,在Fe3S4中存在一个呈正三价的铁原子(Fe(III))两个正二价的铁原子(Fe(II)),以及四个负二价的硫原子(S2−),Fe(II)与S2−之间的电子跃迁十分活跃 [24] [25],这使得Fe3S4可以提供大量的电子来进行氧化还原反应。除此之外,Fe3S4具有一些其他磁性材料不具有的性质。例如当使用Fe3S4用于去除Cr(VI)时,Fe3S4表面Fe(II)会优先与Cr(VI)发生氧化还原反应,使得Cr(VI)还原为Cr(III),而Fe(II)则被氧化为Fe(III),但是这些生成的Fe(III)会被S2−还原为Fe(II),这样便维持了Fe3S4的磁性,这是Fe3O4所不具备的 [26]。而当Fe3S4在被接受光照之后,Fe3S4具有较窄的禁带宽度(0.94 eV),其表面能产生超氧自由基与电子等具有还原性的物质,这些物质能将Fe(III)还原为Fe(II),而S2−则作为了空穴牺牲剂被氧化为S0 [27],这使得Fe3S4在进行氧化还原反应后依然能保持着磁性。目前,将光催化剂与磁性材料结合的相关报道中使用较多的磁性材料为Fe3O4。例如,Luo等以Fe3O4为核心,通过煅烧的方式在其表面生成Bi2S3,从而得到了Fe3O4@Bi2S3磁性材料。同样,Zhu等以Fe3O4为核心,通过低温水热的方式在其表面生成了Bi2S3,相对于单独的Bi2S3和Fe3O4,该磁性材料对RhB具有较强的降解能力。由于Fe3O4在处理Cr(VI)时,Fe2+会和Cr(VI)反应从而被氧化为Fe3+,使得Fe3O4失去磁性。而Fe3S4则不同,其在处理完Cr(VI)后依然可以保持磁性。
因此本文通过一步溶剂热法构建了磁性材料Fe3S4与光催化剂Bi2S3结合的Fe3S4/Bi2S3磁性材料,利用Fe3S4来提升Bi2S3对Cr(VI)的光催化还原性能,并通过调控Fe3S4/Bi2S3中Fe3S4的含量来调控其对Cr(VI)的光催化还原能力。
2. 材料与方法
2.1. 主要试剂
五水硝酸铋(Bi(NO3)3·5H2O)、硫代乙酰胺(TAA)和重铬酸钾(K2Cr2O7)购自上海阿拉丁试剂有限公司(Aladdin),乙二醇(EG)、氯化铁(FeCl3)、氢氧化钠(NaOH)和硝酸(HNO3)购自上海国药集团化学试剂有限公司,以上所有试剂均为分析纯,且在使用前均不需要进一步处理。
2.2. 样品的制备
精确称取1.21 g的Bi(NO3)3·5H2O固体溶于20 mL的乙二醇中,精确称取0.2028 g的FeCl3固体溶于20 mL的乙二醇中,将上述两种溶液混合后室温下搅拌30分钟,然后加入10 mL含有0.4507 g的TAA固体的乙二醇溶液中继续搅拌30分钟。将其移入100 mL的反应釜中后,再移入烘箱中160℃高温下反应12小时。反应结束后将反应釜冷却至室温,将反应釜内的样品用去离水子与无水乙醇多次洗涤,然后放入60℃的真空干燥箱中干燥10小时,即可得到Fe3S4/Bi2S3磁性材料样品FBS3。纯的Fe3S4与Bi2S3,以及不同比例的Fe3S4/Bi2S3样品,相关配比见表1。

Table 1. Experimental condition for the synthesis of Fe3S4, Bi2S3 and Fe3S4/Bi2S3
表1. Fe3S4、Bi2S3以及Fe3S4/Bi2S3的合成反应条件
2.3. 样品的表征
所有样品的晶型与晶相通过X射线粉末衍射仪(Brukeraxs D8)测定。其中X射线的辐射源为铜靶,扫描速度为2˚/分钟,扫描范围为10˚~90˚。所有样品的BET比表面积与粒径通过物理吸附仪(Micromeritics ASAP 2020)测定。所有样品都要在零下150℃超低温下脱气4小时,用氮气作为吸附质。通过X射线光电子能谱(Thermo Fisher Nexsa)测定样品表面Cr的价态。通过紫外–可见分光光度计(AOE A560)测定溶液中的Cr(VI)浓度。
2.4. 光催化实验
光催化实验中使用500 W的长弧氙灯(中教金源)提供可见光。光催化实验步骤为:精确称取0.02 g样品加到40 mL的40 mg/L的Cr(VI)溶液中,暗处搅拌30分钟使得样品对Cr(VI)的吸附达到饱和。然后将其置于可见光下,每间隔30分钟取3 mL溶液离心保留上清液,然后通过紫外–可见分光光度计测定上清液中的Cr(VI)浓度。
2.5. pH值影响实验
pH值对Fe3S4/Bi2S3光催化还原Cr(VI)的影响实验步骤为:精确称取0.01 g加入到20 mL的40 mg/L的pH值为2~11的Cr(VI)溶液中,其余过程与光催化实验中均一致。其中pH值的调配使用1 mol/L的HNO3和1 mol/L的NaOH。
2.6. 光催化循环实验
样品光催化还原Cr(VI)的循环实验步骤为:精确称取0.0050 g的样品分散于pH值为5的40 mg/L的Cr(VI)溶液中,暗吸附30分钟后再用可见光照射120分钟。然后将其离心后保留沉淀,将沉淀依次用1 mol/L的NaOH溶液和0.1 mol/L的抗坏血酸溶液洗涤。将洗涤后的沉淀重新干燥再进行下一次光催化还原Cr(VI)实验。
3. 结果与讨论
3.1. 表征分析
通过改变合成过程中铁源与铋源的添加量得到了不同Fe3S4:Bi2S3比例的Fe3S4/Bi2S3样品,其XRD图如图1所示。可以看出FBS1、FBS2和FBS3的XRD图均与Bi2S3(JCPDS No.89-8965)与Fe3S4(JCPDS No.16-713)的标准卡片一致。而且不含其它的杂峰,这表明FBS1、FBS2和FBS3均为纯的Fe3S4/Bi2S3复合材料。Fe3S4的30˚处是其最高峰,而Bi2S3的28˚处也是其最高峰,通过对比FBS1、FBS2和FBS3的XRD图中两峰的高度可知Fe3S4在Fe3S4/Bi2S3复合材料中的含量。通过对比可得,Fe3S4在FBS1中的含量最高,而在FBS3中的占比最少。由于合成过程中,Fe3S4和Bi2S3的生成的量是与铁源和铋源的量是直接相关的,因此在FBS3中铁源的量是最少的,因此得到的Fe3S4/Bi2S3中Fe3S4的含量最少。

Figure 1. XRD patterns of different Fe3S4/Bi2S3 nanocomporites
图1. 不同Fe3S4/Bi2S3复合材料的XRD图
分析Fe3S4/Bi2S3复合材料的形成机制,由于合成过程中使用乙二醇作为溶剂,而乙二醇在高温下会发生脱水,分别为分子内脱水与分子间脱水。分子间脱水会使多个乙二醇分子聚合。而分子间脱水则会形成乙醛这种具有还原性的物质,乙醛会将溶液中添加的Fe3+还原为Fe2+。此时,溶液中共存的Fe2+、Fe3+会与S2−一同形成Fe3S4,添加的Bi3+也会与S2-发生反应,生成Bi2S3。因此在合成过程中就得到了Fe3S4和Bi2S3的复合物。
由于FBS3中的Fe3S4含量较少,为了验证其是否具有磁性。用磁铁吸引悬浊液中的FBS3一段时间后,结果如图2(d)所示。FS、FBS1和FBS3的磁性如图2(a)~(c)所示。这些材料都具有一定的磁性。

Figure 2. The magnetic recovery of FS (a), FBS1 (b), FBS2 (c) and FBS3 (d)
图2. FS (a)、FBS1 (b)、FBS2 (c)和FBS3 (d)的磁性回收图
为了探究Fe3S4/Bi2S3复合物中Fe3S4的含量对其BET比表面积与粒径的影响。选取Fe3S4、Bi2S3、FBS1、FBS2和FBS3为研究对象,对其对氮气吸附–脱附等温线进行测定,结果如图3所示。从图上可以看出其吸附等温线都为II型,经过计算可得其BET比表面积与粒径,数据见表2。从表上可知,Fe3S4的粒径为466.8 nm,Bi2S3的粒径为431.4 nm。而将二者复合后发现,当Fe3S4/Bi2S3复合物中Fe3S4的含量较少时,FBS3的粒径仅为264.9 nm。这表明较少的Fe3S4与Bi2S3复合会降低Fe3S4/Bi2S3的平均粒径,并增大其BET比表面积。关于少量的Fe3S4会抑制Fe3S4/Bi2S3的粒径的机制还不明确,其原因可能是在合成过程中Fe3S4和Bi2S3的合成先后的所造成的。

Table 2. BET surface area and nanoparticle size of BS, FBS1, FBS2, FBS3 and FS
表2. BS、FBS1、FBS2、FBS3和FS的BET比表面积和粒径
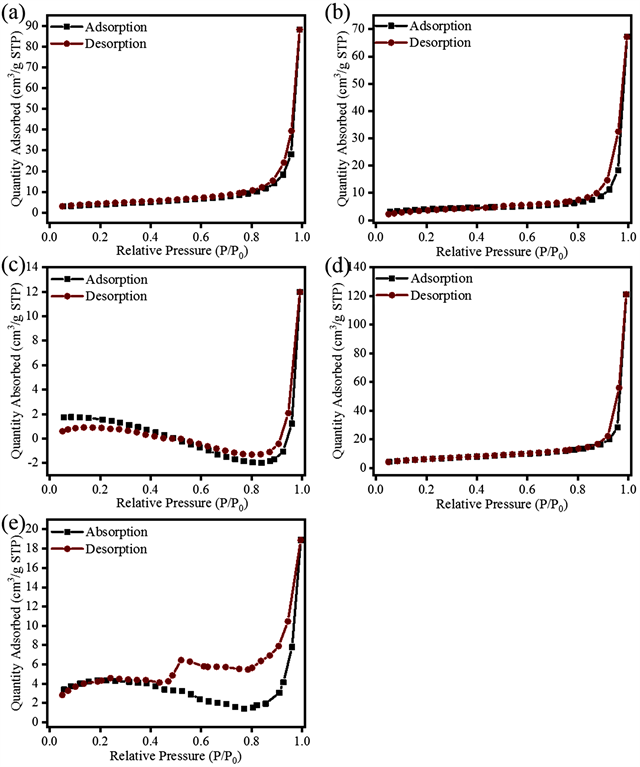
Figure 3. N2 adsorption-desorption isotherms of BS (a), FBS1 (b), FBS2 (c), FBS3 (d), and FS (e)
图3. BS (a)、FBS1 (b)、FBS2 (c)、FBS3 (d)和FS (e)的氮气吸附–脱附等温线曲线图
3.2. 不同样品对Cr(VI)的光催化还原效果影响
为了探究Fe3S4、Bi2S3、FBS1、FBS2和FBS3光催化还原Cr(VI)的效果,选取pH值为5的Cr(VI)溶液作为处理对象,结果如图4(a)所示,其对一阶动力学方程的拟合图见图4(b),拟合数据见表3。可以看出,Fe3S4对Cr(VI)暗吸附30分钟后就已经达到了吸附饱和,然后随着光照的进行,Cr(VI)的浓度依然没有下降,这表明Fe3S4不具备光催化还原Cr(VI)的能力。而将Fe3S4和Bi2S3进行复合后,相对于Bi2S3而言,FBS2和FBS3光催化还原Cr(VI)的效果增强,而复合后的样品中,FBS1的光催化还原Cr(VI)效果最差。为了分析光催化还原Cr(VI)的过程,用拟一阶都动力学方程对其进行分析,拟一阶动力学方程为In(C0/Ct) = kt,式中C0表示在吸附平衡后溶液中Cr(VI)的浓度,Ct表示光照一定时间后溶液中Cr(VI)的浓度,k表示催化速率常数,t表示光催化时间。如表3可知,FBS3对Cr(VI)的催化速率常数要高于FBS2、FBS1、Bi2S3和Fe3S4。这表示少量的Fe3S4有利于提升Fe3S4/Bi2S3对Cr(VI)的催化还原效果。

Figure 4. Photoreduction effect diagram (a) and first order kinetic equation fitting diagram (b) of BS, FBS and FS for Cr(VI) under different illumination times
图4. 不同光照时间下样品BS、FBS和FS对Cr(VI)的光催化还原效果图(a)和其对Cr(VI)的光催化还原动力学方程拟合图(b)

Table 3. First order kinetic equation fitting data table for photoreduction of Cr(VI) by BS, FBS and FS
表3. BS、FBS和FS对Cr(VI)的光催化还原的一阶动力学方程拟合数据表
为了探究材料在光催化还原Cr(VI)后表面的吸附Cr的价态,对FBS3样品进行XPS测试,其Cr 2p的XPS精细谱图如图5所示。结合能为586.6 eV和576.8 eV的峰对应Cr(III)的Cr 2p 3/2和Cr 2p 1/2轨道,FBS3表面只有Cr(III),这表明经过120分钟的光照后,Cr(VI)在FBS3表面被还原为了Cr(III),证实了FBS3具有较好的光催化还原Cr(VI)的能力。
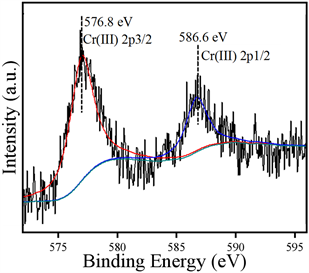
Figure 5. The XPS spectra of Cr 2p on FBS3 after photoreduction of Cr(VI)
图5. 光催化还原Cr(VI)后FBS3表面的Cr 2p 轨道的XPS精细谱图
3.3. 不同pH值条件下样品对Cr(VI)的光催化还原效果影响
为了探究溶液pH值对Fe3S4/Bi2S3光催化还原Cr(VI)效果的影响,选取FBS3为研究对象来处理不同pH值的Cr(VI)溶液,结果如图6所示。可以看出随着pH值的升高,FBS3对Cr(VI)的光催化还原效果逐渐变差。这是由于Cr(VI)在酸性条件下被还原时需要消耗溶液中的H+,这表明Cr(VI)在被FBS3光催化还原的同时溶液的pH值会升高,而在碱性条件下被还原则会产生OH−,Cr(III)与OH-形成沉淀从而吸附到FBS3表面,抑制催化还原反应。因此在pH值为2的Cr(VI)溶液中,其中的H+数量充足,且产生的Cr(III)不会形成沉淀,这使得FBS3对酸性条件下的Cr(VI)还原效果较好。然而当pH值大于5时,溶液中的H+数量已不足,同时随着光催化还原Cr(VI)的进行,Cr(VI)溶液的pH值提升至碱性,使得Cr(VI)在被还原为Cr(III)后吸附到FBS3的表面,从而抑制FBS3与Cr(VI)接触,使FBS3对Cr(VI)的光催化还原效果降低。
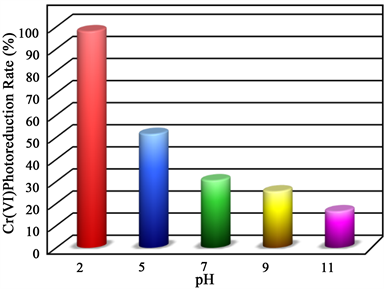
Figure 6. The photoreduction rate of Cr(VI) by FBS3 under different pH value
图6. 不同pH条件下FBS3对Cr(VI)的光催化还原去除率
3.4. Fe3S4/Bi2S3对Cr(VI)的光催化还原稳定性
光催化剂的稳定性也是考察光催化剂的光催化性能的其中一个方面。为了探究Fe3S4/Bi2S3对Cr(VI)的光催化还原稳定性,以FBS3为研究对象进行光催化还原Cr(VI)的循环实验,结果如图7(a)所示。可以看出,FBS3在3次光催化还原Cr(VI)实验后,其对Cr(VI)的去除率已经由52%降至了21%,这有可能是
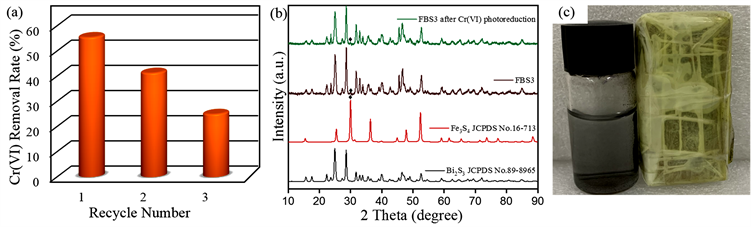
Figure 7. Cycling performance (a), XRD pattern and (b) magnetic recovery (c) of FBS3 for photoreduction of Cr(VI)
图7. FBS3对Cr(VI)的光催化还原循环效果图(a),以及光催化还原Cr(VI)后的XRD图(b)和磁性回收图(c)
由于FBS3在光催化还原Cr(VI)后材料表面的Cr(III)和Cr(VI)没有被洗脱完全,导致后续吸附Cr(VI)的能力降低,进而影响了材料下一次光催化还原Cr(VI)。为了探究FBS3在光催化还原Cr(VI)后的结构与组成是否发生了变化,对反应后的材料进行了XRD表征,结果如图7(b)所示。可以看出,FBS3在光催化还原Cr(VI)后,其XRD没有变化。同时从图7(c)可以看出,FBS3在光催化还原Cr(VI)后材料依然保持着磁性。
4. 结论
1) 在合成过程中通过改变铁源与铋源的添加比例得到了不同Fe3S4:Bi2S3比例的Fe3S4/Bi2S3。
2) 当Fe3+:Bi3+的比例为1:2时,Fe3S4/Bi2S3的比表面积大于其他比例的FBS材料以及纯的Bi2S3,同时其平均粒径也更小,对Cr(VI)也具有更强的光催化还原效果。
3) Fe3S4/Bi2S3对酸性条件下的Cr(VI)具有更大的光催化还原效果,同时pH值越高,其对Cr(VI)的光催化还原效果越差。
4) Fe3S4/Bi2S3在光催化还原Cr(VI)后依然保持着磁性,但是其对Cr(VI)的光催化循环稳定性还有待提升。
NOTES
*通讯作者。