1. 引言
重金属污染问题目前已经成为全球各国广泛关注的最严重的环境问题之一,其中重金属对土壤及地下水的污染,以其危害的严重性和治理的艰难性,成为迫切需要研究和解决的问题 [1] [2],因此,研究土壤中的多组分反应性重金属的吸附和运移规律,对于分析、评价和预测土壤和地下水中的重金属污染及其动态变化过程具有十分重要的意义。
多组分反应重金属溶质在多孔介质中的吸附运移系统(下文中简称系统)主要包含多孔介质中流体运动过程、多孔介质与流体之间发生的化学反应及溶质交互过程、溶质在流体中发生的运移过程,这三个过程相互耦合相互影响 [3] [4] [5]。20世纪20~40年代,Langmuir、Feundlich、Brunauer等国内外学者,逐步提出了固液界面反应中吸附脱附过程常用的有等温吸附理论和表面络合理论,众多的实验研究表明Langmuir、Feundlich、Langmuir-Fruendlich (Slips)、BET等4种吸附等温模型可以用来描述水体中各种重金属吸附脱附过程。20世纪80年代,Lichtner、Yeh和Tripathi逐步提出了反应溶质运移连续介质模型的基本理论和数值方法。近年来Steefel和MacQuarrie,Xu和Pruess,许天福、盛金昌等学者进一步发展了单组分、多组分反应溶质运移理论,以及多孔介质热–流–固–化(THMC)多维耦合问题研究 [6] [7] [8] [9]。
除多孔介质THMC多维耦合宏观性质研究外,反应过程微观过程理论尚未成熟,正逐步吸引各界学者进行尝试研究,常用理论模型基础有Nilson提出的对流扩散模型(CDE)、考虑吸附速率差别的两点模型、考虑不动水影响的动水不动水两区模型、随机模型,此外,格子Boltzmann模型、时序迭代演进算法、分子动力学模拟等新的方法也逐渐被应用到溶质运移的研究中来 [10]。
在考虑多组分溶质在吸附运移过程中多组分之间的相互影响方面,目前研究得比较多的是在物理吸附方面对公共吸附点位竞争而产生的影响,或者通过竞争吸附实验来给出半经验公式并确定参数。重金属形态对于重金属的吸附脱附作用及化学反应活性有着至关重要的作用,而目前主要单独分析来评价污染程度 [11] [12] [13] [14]。本文将综合考虑多组分重金属之间的竞争吸附、离子交换反应及重金属形态等因素影响,来分析多组分反应重金属溶质在多孔介质中吸附运移过程这个复杂动态系统。
2. 多组分重金属之间的竞争吸附与反应
2.1. 单组分重金属吸附动力学模型
单组分重金属在吸附点位出发生如下的吸附脱附可逆过程 [15] [16] [17]:
(1)
式中:M为液体溶质形态的重金属离子,B为多孔介质固体形态的吸附点位,B~M为吸附了重金属离子的吸附点位;由于吸附的重金属离子可能是多价的,而吸附点位也可能是不同的形态,n表示一个重金属离子的平均需要n个吸附点位来吸附。
正向吸附反应的速率为:
(2)
式中:
,
分别为溶质吸附反应、不饱和点位吸附反应的反应级数,s为已吸附点位的密度(摩尔浓度),
为吸附反应速率常数,
为吸附反应活化能。
逆向脱附反应的速率为:
(3)
式中:
分别为饱和点位脱附反应的级数,s为已吸附点位的密度(摩尔浓度),
为脱附反应速率常数,
为脱附反应的活化能。
则吸附脱附反应的净速率公式为:
(4)
在温度稳定时,为吸附活化能
和脱附反应活化能
接近常数,因而可记
,
。反应净速率公式可简化为
。
假定
,
,令反应净速率
,可以得到Langmuir-Fruendlich (Slips)等温吸附公式,因此将此假定称为Langmuir-Fruendlich假设。
2.2. 多组分重金属竞争吸附与反应动力学模型
溶液中有
种重金属
,它们各自发生如下的吸附反应:
(5)
反应的动力学方程(依据Langmuir-Fruendlich假设)为:
(6)
式中:
和
为相互独立的重金属
吸附和脱附速率常数,只与重金属、吸附剂、pH、温度等条件相关。
吸附平衡时,
,则反应平衡常数为:
(7)
对于不同重金属之间会发生相互影响,考虑发生如下竞争吸附,重金属
在重金属
的已吸附点位同位替换出重金属
:
(8)
反应的速率公式为:
(9)
由于i与j的对称性,同像置换反应互为可逆反应,可以知道:
竞争吸附达到平衡时:
(10)
反应的平衡常数为:
(11)
式中:
和
为相互独立的重金属
吸附和脱附速率常数,当
和
确定时,
也就确定了,可以用
来表示
,而
,
,所以
只有下半角元素
是相互独立的,为重金属i离子与重金属j的已吸附点位发生点位交换反应的反应速率常数。
在含有多种重金属的溶液中,重金属
的吸附速率为:
(12)
式中:重金属
的总的吸附速率为
;重金属
的总的脱附速率为
。
当吸附脱附达到平衡时,系统满足
,整理得:
(13)
写成矩阵的形式为:
(14)
式中:
;
;
;
。
也可以写成如下的形式:
(15)
式中:
为吸附分配矩阵,对于单种重金属,即为吸附分配系数。
3. 渗流化学耦合模型
系统所包含的三个过程包括了多孔介质中渗流场与固体流体中化学场的相互耦合过程,其中化学场不仅要考虑化学物质在固液界面及液体中发生的化学反应和吸附脱附过程,还要考虑不同化学物质之间相互影响,如重金属不同活性而引起的离子交换反应,竞争吸附等。下面针对流场运动过程、吸附脱附与化学反应过程、溶质运移过程,分别介绍其控制方程。
3.1. 渗流控制方程
多孔介质中的渗流过程可以用渗流连续性方程和达西定律来描述,连续性方程为 [18]:
(16)
对于不可压液体为:
多孔介质中的水流运动用Darcy定律来模拟:
(17)
3.2. 溶质运移控制方程
对流扩散方程 [19]:
(18)
3.3. 吸附及反应控制方程
不同重金属组分之间的影响、土壤的吸附和降解作用以及在一定时间和位置所固有的源汇强度可以反应在对源项的影响上面,具体如下:
(19)
式中:i和
为重金属的序号和总共考虑的种数,
为第i种重金属与其浓度
正相关的一阶降解系数,
为土壤对第i种重金属溶质的净吸附速率(已吸附浓度
的单位为mol/L,与浓度的单位相同),
为第i种重金属溶质的其他的源汇项,溶液浓度场
,吸附浓度场
,
为其他重金属溶质的浓度对第i种重金属溶质浓度的影响。
含有多种重金属的溶液中,重金属
的吸附速率为:
(20)
综上所述:渗流控制方程反应了系统中溶液的运动,溶质运移控制方程反应了不同组分溶质随水流迁移过程,吸附及反应控制方程反应了溶液中与固体骨架之间的溶质交互作用以及不同组分重金属之间所发生的反应,如离子交换反应,将这三个方程耦合在一起,可得到渗流–化学耦合的控制方程。
4. 数值模拟与算例分析
4.1. 数值模拟算法
考虑两种重金属溶质的竞争吸附以及一阶降解作用的运移模型可以用以下的耦合方程组来表示:
(21)
由于特征有限单元法的数值弥散和数值振荡一般比较小,所以采用特征有限单元法求解该耦合模型,具体如下:对于时间导数采用有限差分法或者特征差分法,对于空间分布,用已知的前一时刻的物理量分布使用加权余量有限单元法,建立各个物理量关系的线性方程组,从而求得下一时刻的物理量分布,随时间的逐步变化,求得各个耦合物理量随时间的变化过程。
4.2. 算例分析
我们考察稳定均匀二维渗流场下的多组分反应重金属溶质在多孔介质中的吸附运移情况,如图1所示。
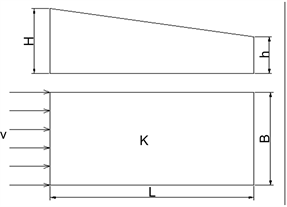
Figure 1. Schematic diagram of the structure of the multi-solute transport system
图1. 多溶质运移系统结构示意图
土壤的饱和渗透系数选取
,长度为
,干密度1550 kg/m3,饱和含水率38%,孔隙率55%,总密度2140 kg/m3;
为弯曲度,
为纵向弥散度,
为横向弥散度,静水中分子扩散系数
;水流水平速度
,垂直速度
;对于边界的设定:上游为第一类边界条件,设定上游浓度为恒定浓度;
下游为平流边界;上下两侧为无流通量/对称边界。对于计算区域进行网格剖分,如图2所示。
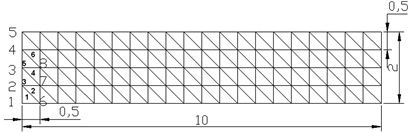
Figure 2. Schematic diagram of meshing node and element numbering
图2. 网格剖分节点与单元编号示意图
考场流场中两种重金属(Cu和Zn)的吸附运移过程,它们的脱附反应系数分别取1.0 × 10−5, 1.4 × 10−4,Langmuir吸附系数取7.3025,2.2890 L/mmol,则吸附反应系数为7.3 × 10−5, 3.205 × 10−4 L/mmol,竞争吸附系数和竞争脱附系数分别取
,
,在这些反应系数的前面都乘以一个反应速率调整系数
,以控制反应的速率。
4.3. 参数影响分析
1) 反应速度的影响
取
,
,迭代
步的结果如图3所示。
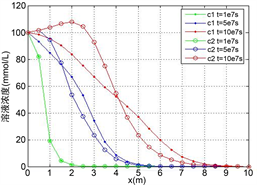 (a)
(a) 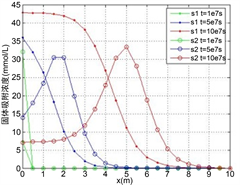 (b)
(b)  (c)
(c)
Figure 3. The distribution of two heavy metals concentration along the axis when
,
, (a) Solution concentration; (b) Solid adsorption concentration; (c) Total concentration
图3.
,
时的两种重金属沿程浓度分布。(a) 溶液浓度;(b) 固体吸附浓度;(c) 总浓度
保持其他参数不变,将反应速率调整系数变为
,结果如图4所示。
由以上的结果,我们可以得到以下的结论:
由图3,图4所示,多组分重金属在稳定渗流场的多孔介质中运移时,开始都是以各自的吸附反应为主,竞争吸附的影响很小,尤其是在反应速率比较小的时候这种情况更加明显,此时,由于Zn的吸附速率比较快,固体吸附浓度明显比Cu要高,而相应的,溶液浓度比Cu要低;当各自的吸附达到一定的程度的时候,此时固体吸附的Zn和溶液中的Cu都达到了一定的浓度,它们之间的离子交换反应产生明显的效果,溶液中的Cu离子置换出固体吸附的Zn,使得Zn的吸附浓度变小,而溶液浓度变大,加上运移过来的溶液中的Zn,而此时由于固体吸附浓度较高,吸附和脱附所产生的净吸附速率很小,从而使得此时溶液中的Zn浓度高于源溶液的浓度,而固体吸附浓度变小,总的溶液浓度和固体吸附浓度都在变高,与单种吸附类似,总的溶液浓度小于总的源溶液浓度;各个组分重金属的吸附脱附速率以及离子交换反应的速率,最终的平衡态是每种的重金属的固体吸附浓度都保持一个稳定值;根据总浓度的分布图可知,不论反应速率的大小多少,可以将重金属作为一个整体来分析,也满足单种重金属的吸附运移规律,吸附的速率越小,会使得重金属固体吸附的总浓度越小,对应位置的溶液浓度越大。
重金属的固体吸附总浓度已知的时候,但是由于吸附的历史的不同,其中的各组分的浓度分配百分比也不同,固体吸附的总浓度会首先达到最大吸附浓度,但是还没有达到平衡,其中比较显著的是离子交换反应,化学活性较低的离子会交换出活性较高的已吸附离子,直到最终达到一个合适的分配比,使得各个反应达到平衡。
 (a)
(a)  (b)
(b) 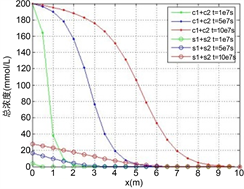 (c)
(c)
Figure 4. The distribution of two heavy metals concentration along the axis when
,
, (a) Solution concentration; (b) Solid adsorption concentration; (c) Total concentration
图4.
,
时的两种重金属沿程浓度分布。(a) 溶液浓度;(b) 固体吸附浓度;(c) 总浓度
2) 降解与反应的共同作用
取反应速率调整系数为
,取降解速率取降解系数为:
,
的工况,计算结果如图5所示。
 (a)
(a) 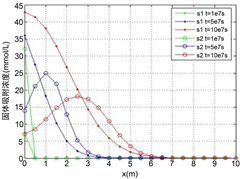 (b)
(b) 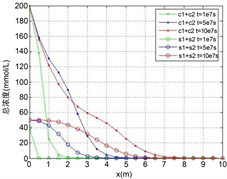 (c)
(c)
Figure 5. The distribution of two heavy metals concentration along the axis when
,
, (a) Solution concentration; (b) Solid adsorption concentration; (c) Total concentration
图5.
,
时的两种重金属沿程浓度分布。(a) 溶液浓度;(b) 固体吸附浓度;(c) 总浓度
由图5所示,降解系数越高,近程因降解作用而吸附速度降低,远程因运移的浓度较高而吸附速度增加。将同时考虑竞争吸附作用和降解作用的重金属溶质运移计算结果,与单独计算竞争吸附作用影响和单独计算降解作用影响的计算结果相比较,可以发现竞争吸附作用和降解作用对于重金属溶质运移来说都是非常重要的,不可忽略的,尤其是这两种速率都不低的情况,如果不考虑将直接导致计算结果失真。
5. 结论
本文通过渗流控制方程、溶质运移控制方程、多组分溶质吸附反应控制方程耦合,建立了多组分重金属在多孔介质中的渗流–化学耦合模型。通过数值模拟分析结果可知多组分反应重金属在多孔介质固体吸附的总浓度会达到最大吸附浓度后,各组分比例尚未平衡,随着离子交换速率、不同组分离子吸附–降解速率的变化,化学活性较低的离子会交换出活性较高的已吸附离子,直到最终达到一个合适的分配比,使得各个反应达到平衡。在接近平衡态时,降解作用将与吸附作用、离子交换作用同样重要,最终在多组分的吸附–降解–交换中达到多项综合平衡。相同多组分重金属在不同类型多孔介质特性、不同温度中的竞争吸附机制也有所差异,实践中应通过实验进行测量确定。本文通过多种溶质竞争吸附机制的研究,可为土壤、岩石、地下水等重金属污染治理提供相关理论分析和定量研究的方法。
基金项目
中国电建集团华东勘测设计研究院有限公司201科研课题(KY2019-ZD-03)。
NOTES
*通讯作者。