摘要:
目的:为了总结合并严重左心功能不全冠心病患者行冠状动脉旁路移植术(CABG)外科治疗的临床经验,降低左心功能不全患者的住院死亡率及并发症发生率。方法:回顾性分析作者所在单位青岛大学附属医院近3年525例冠状动脉搭桥患者,其中左室功能不全(定义为左心室射血分数 ≤ 为35%)患者102例,总结纳入组病例的基本特征、术前共病、手术策略、围术期并发症、住院死亡率等。结果:其中使用乳内动脉桥患者:73例,住院死亡:27例,CABG:42例,OPCABG:60例。术后心肌梗死、术后低心排、术后肾衰竭、术后肺部感染为主要的术后并发症。围手术期不良事件发生的主要预测因子有:COPD、急诊手术、术前应用IABP、合并二尖瓣手术。结论:严重的左心室功能不全在普通心脏外科人群中很常见。左心功能低下冠心病患者冠状动脉搭桥术术后并发症风险高,死亡率高,但围手术期风险与术后远期存活率相比要低。
Abstract:
Objective: To summarize the clinical experience of coronary artery bypass grafting (CABG) in the treatment of coronary heart disease with severe left ventricular insufficiency, and to reduce the in-hospital mortality and complication rate of patients with severe left ventricular insufficiency. Methods: A retrospective analysis was made on 525 patients with coronary artery bypass grafting in the affiliated Hospital of Qingdao University in recent 3 years, including 102 patients with left ventricular dysfunction (defined as left ventricular ejection fraction ≤ 35%). The basic characteristics, preoperative comorbidities, surgical strategies, perioperative complications and hospital mortality were summarized. Results: Among them, 73 cases were treated with internal mammary artery bridge, 27 cases died in hospital, 42 cases were CABG, and 60 cases were OPCABG. Postoperative myocardial infarction, postoperative low cardiac output, postoperative renal failure and postoperative pulmonary infection were the main postoperative complications. The main predictors of perioperative adverse events were COPD, emergency surgery, preoperative application of IABP and mitral valve surgery. Conclusion: Severe left ventricular dysfunction is common in general cardiac surgery. Patients with lower LVEF after cardiac surgery have a high risk of complications and mortality after coronary artery bypass grafting, but the operative mortality is relatively low. Among patients with left ventricular insufficiency, coronary artery bypass grafting with mitral valve surgery has the highest mortality. Accurate preoperative assessment and risk stratification are essential for these patients, and careful perioperative management is mandatory.
1. 介绍
冠状动脉旁路移植术(CABG)是严重三支左主干冠状动脉病变(CAD)患者的标准治疗手段。然而,冠心病合并严重左心室(LV)功能不全患者的最佳治疗策略[射血分数(EF) ≤ 35%]尚不清楚,在这一危重的患者亚群中,手术结果仍然不可预测,尽管最近有了令人鼓舞的改善,但总体上手术死亡率及术后并发症任不满意。多年来,几位作者对这一问题进行了非常深入的研究,包括患者的选择标准、术前心肌活力测试、不同停搏液对心肌保护的不同影响、利用动脉移植物进行完全心肌血运重建的价值、非体外循环或不停跳心脏体外循环技术的作用以及围手术期更广泛地使用主动脉内球囊反搏(IABP)或非肾上腺素能肌力药物 [1] - [6]。目前国内尚未对左室功能不全冠心病患者的救治形成系统的共识或指南,因此本文通过对本院左室功能不全行冠状动脉搭桥术的患者进行回顾分析,为降低手术风险,改善患者预后提供依据。
2. 研究对象及方法
2.1. 研究对象
选择2010年01月至2020年01月102例左室功能不全行冠状动脉搭桥术患者为研究对象。左室功能不全诊断标准:心脏超声EF ≤ 35%。入选患者男性:77例,女性25,合并糖尿病患者32例,合并高血压患者42例,合并COPD患者28例。
2.2. 研究方法
回顾性分析病例的基本信息、心功能分级、术前合并症、术前IABP的应用、术前药物应用、手术策略、围术期并发症、住院结局等,术前基线资料包括:性别、年龄、体重、高血压史、糖尿病史、心肌梗死史、颈动脉狭窄史、左室射血分数(EF)。
2.3. 治疗方法
不停跳冠状动脉搭桥术占41%,停跳冠状动脉搭桥术占59%。术前行B超探查乳内动脉、锁骨下动脉、大隐静脉。所有手术均给予气管插管全身麻醉,获取乳内动脉及大隐静脉备用。单纯不停跳搭桥手术式如下:全身肝素化(1 mg/kg),应用心肌固定器行靶血管固定,修剪合适长度LITA (左乳内动脉),7/8-0 Prolene线连续缝合行LITA-LAD (前降支)端侧吻合。应用侧壁钳或易扣,3.5 mm Punch于主动脉根部小弯侧打孔,6-0 Prolene线连续缝合行SVG1 (大隐静脉)/SVG2/SVG3与AAO (升主动脉)端侧吻合。心包斜窦近左肺下静脉处缝置牵引线,套入纱布条协助心脏搬动。置入分流栓,按照需求依次吻合对角支、回旋支及右冠状动脉再血管化。体外循环下搭桥术式:给予肝素(3 mg/kg),常规建立体外循环,降温后阻断升主动脉,主动脉根部灌注停跳液,先吻合静脉桥血管与远端靶血管、乳内动脉及前降支,复温,左心系统排气,开放主动脉阻断钳,心脏复跳后,然后行桥血管与升主动脉吻合。桥血管排气后开放无损伤钳,并行循环,偿还氧债,至血压、心率、心律、心电稳定后,停体外循环。检查各吻合口通畅,无漏血,鱼精蛋白中和肝素,彻底止血,放置纵隔、心包引流管各一根自上腹部引出。清点器械、纱布无缺,常规关胸素,彻底止血关胸。术后常规行流量仪测定桥血管流量,如流量不满意则再次吻合。
体外循环组平均体外循环组时间135 min,主动脉阻断时间80 min。手术指标还包括了乳内动脉使用情况、是否合并瓣膜、主动脉、心室成型术。围术期指标包括呼吸机辅助通气时间、重症监护病房(intensive care unit, ICU)治疗时间,住院时间,主动脉内球囊反搏(intra-aortic balloon pump, IABP)的使用情况,病死率及死亡原因,术后急性肾衰竭的发生率,二次开胸止血、围术期心梗、心律失常、脑梗、感染等合并症发生情况。
2.4. 统计学方法
采用SPSS 21.0统计学软件进行分析。应用SPSS 22.0统计学软件进行数据处理。符合正态分布的计量资料采用均数 ± 标准差(x ± s)表示,不符合正态分布的计量资料采用M (P25, P75)表示;计数资料用百分数表示。多因素分析采用二分类多因素非条件Logistic回归模型,计算各因素的OR值及其95% CI,筛选围术期死亡的高风险因素。以P < 0.05为差异有统计学意义。
3. 结果
3.1. 纳入组患者的基线资料及手术策略
在研究期间内共有525名搭桥患者,其中术前EF ≤ 35%,纳入研究的共有102名。纳入组患者的基线特征、手术策略等总结如表1所示。患者的平均年龄为64.74岁,平均体重为67.83 kg,术前EF平均为29.19%。心绞痛为最常见的并发症,占纳入组的52%,其次为高血压、陈旧性心肌横死、糖尿病、COPD,所占比例依次为:45.1%、43.1%、31.4%,27.5%。死亡组和存活组具有明显统计学差异的为:COPD (13.5% vs 66.7%, P < 0.001)、EF、急诊手术(9.5% vs 25.9%, P = 0.034)、术前应用IABP (21.6% vs 59.3%,P = 0.001)、合并二尖瓣手术(16.2% vs 48.1%, P = 0.002)。在本次研究中,患者的年龄、体重、患有高血压、糖尿病、陈旧性心肌梗死在两组中没有统计学差异。并且在其他研究中常见的术前应用血小板抑制剂药物,在本研究中亦未见统计学差异。


Table 1. Baseline and intraoperative characteristics of patients undergoing CABG with an ejection fraction ≤ 35%: comparison of survivors and dead patients
表1. 射血分数 ≤ 35%行CABG患者的基线和术中特征:存活者与死亡患者的比较
3.2. 围术期及术后情况分析
如表2所示,在纳入组中,围术期死亡27例(26.5%),围术期发生急性肾功能衰竭17例,心肌梗死(肌钙蛋白CTnI > 0.5 μg/L且合并心电图变化) 12例,新发房颤21例,术前IABP使用32例,术后低心排31例,术后肺部感染29例,再次插管27例,气管切开15例。详见表2。并且在死亡组中,术后心肌梗死(4.1% vs. 22.2%, P = 0.001)、术后低心排(10.8% vs 85.2%, P = 0.004)、术后肾衰竭(6.8% vs 51.9%, P < 0.001)、术后肺部感染(16.2% vs 63%, P < 0.001)的发生率显著提高,与存活组相比具有明显的统计学差异。

Table 2. Postoperative complications and prognosis data for patients with EF ≤ 35% receiving surgical treatment: Comparison of survival and death patients
表2. EF ≤ 35%接受外科治疗的患者术后并发症和预后数据:存活和死亡患者的比较
3.3. 不同级别射血分数的死亡率
我们总结了不同级别射血分数患者的围术期死亡率,与预测一致的是,射血分数越低的组,其死亡率越高,如图1所示,在EF ≤ 20%组中,死亡率高达68.5%。但是25%~30%组与30%~35%组的死亡率却差异不大。
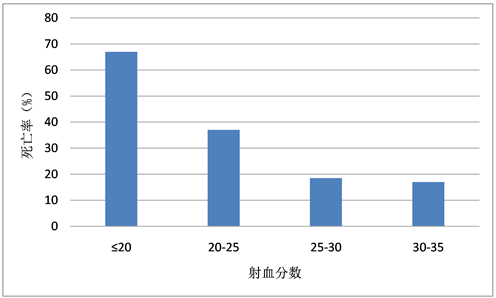
Figure 1. Mortality of different levels of ejection fraction
图1. 不同级别射血分数的死亡率
3.4. 影响围手术期死亡的多因素分析
在本研究我们将围术期死亡作为因变量,以术前应用IABP、合并二尖瓣瓣膜手术、术后肺部感染、术后急性肾损伤、术后流量等作为自变量,进行多因素logistic回归分析,如表3所示。术前应用IABP (OR = 12.232, P = 0.003)、合并二尖瓣手术、术后急性肾衰竭具有强烈的死亡预测性。

Table 3. Logistic regression analysis of multiple factors affecting perioperative death
表3. 影响围术期死亡的多因素Logistic回归分析
4. 讨论
在临床手术患者中,左心功能不全的患者占到了10%的比例。大部分左心功能不全患者是由缺血性心肌病引起的,接受冠状动脉搭桥术是本类病人目前最常见、有效的治疗手段,大多数左室功能不全心脏外科研究都是在接受冠脉搭桥术的低LVEF患者身上进行的 [7]。绝大多数研究表明,在接受冠状动脉旁路移植术的低EF患者中,心肌血管重建的围手术期风险与术后远期存活率相比要低 [8]。在这种情况下,越来越多的此类患者及心外科医师选择行冠状动脉搭桥治疗。由于心脏储备功能的下降,其手术风险高,预后差,术前仅关注LVEF是远远不够的,还需要在此类病人进行手术之前进行全面的分析。在此基础上,我们的研究可能对临床治疗提供经验及线索。
在EF ≤ 35%的患者中,COPD、急诊手术、术前应用IABP、合并二尖瓣手术被确定为死亡率的独立预测因素。但是术前使用IABP作为病情危重的标志,而不是导致较差结果的主要原因。Zangrillo等人表明,IABP改善了接受冠状动脉旁路移植术的高危患者的预后 [9]。结合本研究结果,严重心功能不全的冠心病患者术前应积极应用IABP。急诊手术与预后不良具有明显的相关性,所有的急诊手术术前均需进行充分的全身情况评估,判断患者是否可暂缓手术,是否存在循环难以维持的情况。
本次研究中总体的死亡率高达26.5%,在合并二尖瓣手术的情况下,死亡率升至52%。我们的结果证实,在左心室射血分数降低的患者中,当CABG与二尖瓣手术相关时,预后较单独的CABG明显变差。值得注意的是,中重度和重度二尖瓣反流情况下的LVEF不能用来描述左室收缩功能,由于部分每搏量返向左心房,对全身灌注没有贡献 [10]。此外,这些患者的EF降低可能是由缺血性心肌病引起的。在最近一项缺血性心力衰竭外科治疗(STICH)试验的子分析中,发现存在严重的二尖瓣返流是接受冠状动脉旁路移植术的左心室功能不全患者30天死亡率的预测因子。但与不做二尖瓣手术相比,同期接受二尖瓣手术的患者30天存活率更高 [11]。本次研究中我们还发现,在排除合并瓣膜、主动脉的同期手术情况下,体外循环下冠状动脉搭桥术和非停跳冠状动脉搭桥术的围术期预后没有统计学差异。
在本研究中,随着LVEF的下降,死亡率逐渐升高。但是LVEF 25%~30%组与LVEF 30%~35%组的死亡率之间的差异却非常小。这说明左心功能低下的患者,通过充分的术前评估、术前心功能调整、恰当的外科治疗、及时合理的重症监护,完全可以获得良好的预后。使低LVEF不再成为外科手术禁忌。
大量研究表明,肾功能衰竭和慢性阻塞性肺病是心脏围手术期的危险因素 [12] [13]。同时,当患者合并COPD时,术前需重点评估患者肺功能,加强呼吸道管理,可行雾化治疗。而术后的急性肾衰竭具有强烈的死亡预测性,这要求我们术后要定期检测肾功能变化,当肾功能出现异常时要给予充分重视,必要时可采取激进的CCRT治疗,以避免恶性事件的发生。我们的研究结果清楚地表明,这些情况在左心室功能降低的患者中具有更明显的相关性。在本研究中,术后并发症的发生率比以往文献报道的要高。特别是,与最近在普通心脏外科人群中进行的大型研究的数据 [14] [15] 相比,在低EF的高危人群中,我们发现术后AKI、AF和LCOS的发生率更高。相反,我们观察到心肌梗死的发生率较低。一种可能的解释是,心脏手术后心肌梗死可能与心肌保护不准确、围手术期血流动力学不稳定、术后血栓前状态冠状动脉血运重建的复杂性、手术技能而不是LVEF本身有关 [16]。必须考虑以下局限性:第一,研究的回顾性设计;第二,它涵盖了相对较长的时期,在此期间,手术适应症和围手术期护理都可能发生变化;第三,缺乏长期随访。这项研究是单中心的,没有验证组。它们可能会在更大的多中心研究中得到进一步改进;然而,分析的截止点是基于相关的临床参数,并且是根据国际指南选择的。我们意识到LVEF仍然是心脏手术后临床结果的最强预测因子之一,我们不能排除本研究中没有考虑的其他参数可能起到相关作用。
5. 结论
严重的左心室功能不全在普通心脏外科人群中很常见。左心功能低下冠心病患者冠状动脉搭桥术术后并发症风险高,死亡率高,但围手术期风险与术后远期存活率相比要低。准确的术前评估和风险分层对这些患者至关重要,仔细的围手术期处理是强制性的。