1. 绪论
常规化疗主要针对肿瘤细胞本身,通常忽略周围环境的影响。在化疗过程中不仅存在严重的不良反应,如:免疫抑制和骨髓抑制,还对某些恶性肿瘤具有多药耐药性,体现出非常差的治疗和预后效果 [1] [2] [3]。根据斯蒂芬·佩格特(Stephen Paget)提出的“种子和土壤”用于人类乳腺癌复发和转移的独特模式 [4],研究员们近年来试图开发一种新的肿瘤治疗策略,即破坏肿瘤赖以生存的环境作为实现治疗目标的治疗手段 [5] [6]。
肿瘤微环境(Tumor microenvironment, TME)是一个复杂的开放动态系统,由肿瘤细胞,细胞外基质(ECM),各种基质细胞及其分泌的细胞因子和趋化因子,脉管系统等组成,是肿瘤所依赖的细胞环境 [7] [8]。TME中已经发现的成分,特别是CAF、TEC和TAM对肿瘤细胞的行为具有重要影响。CAF被认为是与肿瘤侵袭和转移密切相关的最重要的基质细胞 [9] [10],TEC是TME血管生成以形成多药耐药性和免疫逃逸的肿瘤屏障的关键细胞成分 [11],TAM具有双重作用,M1型TAM促进肿瘤清除,而M2型则加速肿瘤恶化和耐药性。一些研究表明,使用伊马替尼(一种靶向PDGFR,c-kit和v-ab1的分子药物)降低实体瘤组织中CAF细胞的间质液压力,增强药物递送从而抑制卵巢癌的扩散 [12]。一些研究人员发现,分子靶向药物贝伐单抗可通过特异性作用于卵巢癌中过表达的血管内皮生长因子(VEGF)的活性形式来有效抑制TME的血管生成 [13]。据报道,COX-2抑制剂塞来昔布抑制卵巢癌上皮细胞的恶性表型可诱导TME中M2型TAM向M1的转化,并逆转免疫耐受性。综上所述,有理由相信针对TME多个关键成分的协同调节有望在抑制肿瘤生长、增殖、血管生成、侵袭和转移方面取得出色的效果。
但是,由于不同组织和器官的构成不同,相应的肿瘤微环境也有所不同,肿瘤微环境中各组成部分间的相互作用情况也不同。体外建立肿瘤微环境模型可以用以模拟肿瘤细胞对其他细胞的肿瘤化作用,并且能够深入研究肿瘤相关细胞对肿瘤细胞行为的影响。卵巢是位于女性盆底的实质器官,表面覆盖单层立方或扁平上皮,内部分为皮质和髓质两个部分。卵巢癌主要发生在上皮部位,易向周围进行扩散。在2018年全球癌症统计中卵巢癌占3.4%,而致死率高达4.4% [14],病发率居于其生殖相关癌症的第二位(5~9例/10万),卵巢上皮癌(Epithelial Ovarian Cancer, EOC)病死率位于第一。中国是一个人口大国,相比而言,发病人数和死亡人数明显多于其他国家,因此卵巢恶性肿瘤的早期筛查、诊断和治疗方式的选择成了现在急需解决的难题之一。卵巢癌微环境模型用于模拟体内卵巢癌真实情况,探究微环境中各部分的交互作用,从而探索出针对卵巢癌微环境的治疗方式。
与传统的肿瘤治疗方式不同,以肿瘤微环境作为靶向治疗目标的治疗方式,主要为了破坏肿瘤获取营养物质的途径,扰乱肿瘤细胞与细胞或与周围环境的交互通路,从而达到间接治愈肿瘤的目的。因此体外肿瘤微环境模型可以模拟体内肿瘤细胞与肿瘤周围环境的情况。
目前体外构建的肿瘤微环境模型主要通过改变细胞的生长形式来实现,如球状体和悬滴 [15],3D生物打印技术 [16],水凝胶支架 [17],聚合物支架 [18] [19] 和基于微流体的动态肿瘤模型 [20] [21] 等,这些方式仅片面地模仿了肿瘤微环境。实体肿瘤在体内不仅是三维生长,并且还会与周围环境发生交互作用。因此,众多方法中大多缺少微环境这一要素。微环境较为复杂,每个成分对肿瘤细胞都有较大影响,而每个成分之间又会有相互关联,因此体外构建肿瘤微环境成为棘手的问题。肿瘤微环境靶向治疗的研究中,体外肿瘤微环境模型的建立则是关键之处,是整个系统的重要组成部分,为靶向治疗提供物质基础。而肿瘤微环境中成分的获取是建立模型前需要解决的首要任务,因此本文将从物质基础研究出发,通过体外诱导培养获取肿瘤相关细胞并完成相关细胞的鉴定为肿瘤微环境靶向治疗奠定实验模型基础。
在本文中,将Transwell细胞用于建立二维间接细胞培养系统。首先,将SKOV3与HUVEC、CNLMG在孔板中进行共培养,以达到肿瘤细胞将正常细胞诱导为肿瘤相关细胞的目的。其次,根据肿瘤相关细胞表达的特征蛋白,结合其他生物学评价方法,鉴定肿瘤相关细胞的相关性 [22] [23]。然后,通过迁移和侵袭,流式细胞术实验等方法研究了肿瘤相关细胞对肿瘤细胞的生物学影响,进一步说明了肿瘤相关细胞在肿瘤细胞的发生和发展中起着重要的作用。这也为肿瘤治疗药物筛选和特定配体的靶向生物淘选奠定了基础。
2. 材料和方法
2.1. 材料和仪器
本实验所用到的主要材料试剂为:DMEM培养基、胎牛血清、胰蛋白酶、CCK-8试剂盒、青霉素–链霉素双抗溶液、Matrigel基质胶等。所用到主要仪器设备如表1所示。

Table 1. Main apparatus and equipments
表1. 主要仪器设备
2.2. 细胞培养
将从四川大学生物治疗国家重点实验室获得的SKOV3细胞和从华拓生物科技有限公司购买的HUVEC和CNLMG细胞系置于含有10%胎牛血清的DMEM培养基中,然后将其放入条件为5% CO2、37℃的培养箱中培养。
2.3. 体外诱导培养模型的建立
肿瘤细胞与环境细胞被置于同一环境中培养,肿瘤细胞分泌的细胞因子作用于环境细胞,使环境细胞的遗传物质发生改变。环境细胞表达出异常蛋白,最终被诱导成为肿瘤相关细胞。以HUVEC和SKOV3为例的诱导培养模型如图1所示。将HUVEC以5 × 103个/孔的密度接种于上室中,同时,将SKOV3细胞以5 × 104个/孔的密度接种于下室中。上室和下室分别加入1.5 mL/0.4 mL (6孔板/24孔板)和2.5 mL/0.8 mL (6孔板/24孔板) DMEM细胞培养基,然后将其放入培养箱中培养。次日,将上室转移至下室中,使两者在同一环境中培养。

Figure 1. Model of cell inductive culture
图1. 细胞诱导培养模型
2.4. 细胞形态分析
将细胞进行消化计数后,按合适的密度种植于6孔板中,加入培养基呈十字摇匀,避免聚集于孔板中间,然后放入培养箱中继续培养直至细胞全部贴壁,于次日放于显微镜明场下观察细胞形态。随后,拿出培养板,PBS洗涤5 min,重复3次。吸干液体后,加入4%多聚甲醛,覆盖板底即可。静置30 min后,PBS清洗3次。Triton通透10 min,PBS清洗3次。将DAPI储存液用PBS缓冲液稀释成浓度为1~10 μg/mL工作液,加入工作液覆盖板底即可。关闭日光灯,静置染色5~10 min后,PBS洗涤3遍,加入封片剂。最后将其放置于荧光显微镜下观察,并且拍照记录。
2.5. 细胞增殖试验
CCK-8试剂盒检测在不同时间点的单独和诱导培养细胞的细胞活力以找寻最佳的共培养时间,随后测定最佳共培养时间点的细胞活性。将SKOV3、HUVEC和与两者共培养的细胞种植在24孔细胞培养板和24孔Transwell细胞培养板中。分别在第1,3,5,7和9天测量不同细胞的活性。实验组和对照组均设置6个平行孔。在指定时间用冷PBS洗涤细胞2遍,另注入新鲜培养基。接着,将40 μL和80 μL CCK-8分别加入上室和下室中,轻轻摇匀以充分混合。在恒温培养箱中放置2 h后,将上清液混匀转移到96孔板中,随后放入自动酶标仪,按照检测要求于450 nm处进行分光光度测量。
2.6. 肿瘤相关细胞标志性蛋白的测定
于共培养的最佳时间点将实验组中小室移出,PBS清洗3次后加入培养基,放入培养箱中单独培养一天,取出全部上清液于离心管中,加入新培养基后把小室移入继续进行共培养。将取出的上清液充分混匀,每根管取1 mL于离心管中,放入离心机以2500 rpm/min的速度在4℃条件下离心20 min,收集澄清上清。根据ELISA测试盒的操作说明测定上清液中的蛋白含量。用预冷PBS洗涤3次相关细胞和正常细胞,每瓶添加400 μL含有蛋白酶抑制剂混合物的蛋白质提取试液,几分钟后,用刮棒快速将培养瓶中的细胞刮下,将液体转移至EP管中于冰上裂解30 min,每隔10 min混匀一次。以12,000 rpm/min高速离心15 min,获取全细胞裂解物。将裂解物在SDS-PAGE凝胶中电泳并转移至PVDF膜。本研究中使用的一抗包括:抗-α-SMA,抗-FAP,抗-VEGF,抗-TEM。使用Super Signal West Dura化学发光底物显现结果。
2.7. 肿瘤细胞迁移和侵袭实验
细胞迁移和侵袭实验均采用孔径为8 μm的Transwell小室构建交互作用模型。上室底部滤膜预先铺盖100 μL以1:8稀释的matrigel基质胶,然后将孔板放入培养箱中孵育6 h充分凝固。将对数生长期的肿瘤细胞以5 × 105个/mL的密度接种于凝胶上,每孔加200 μL。下室分为3组,每组加等体积的相关细胞、正常细胞和添加了胎牛血清的培养基,每组分别设置6个平行孔。24 h后,将小室装进对应的下室,上室用PBS清洗3次,添加不含血清的DMEM培养基再培养24 h后,用棉签小心地擦掉小室上的凝胶和细胞,Hoechst染色。显微镜100倍下计数膜上,下,左,右,中5个视野穿过膜的细胞个数,取每组的平均值进行统计学处理。细胞迁移实验则不用铺胶,装配小室后均改用无血清培养基继续培养12 h进行染色计数,其余步骤均相同。细胞侵袭实验如图2所示。
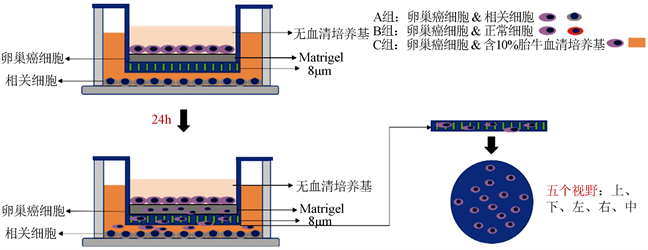
Figure 2. Schematic diagram of tumor cell invasion experiment
图2. 肿瘤细胞侵袭实验示意图
2.8. 流式细胞实验
实验分为单层培养SKOV3和共培养SKOV3两组,将培养至4天的细胞悬浮转移至离心管中,随后放入离心机收集细胞,倒掉上清,用冷PBS洗涤2~3遍,添加适量冷70%乙醇,放于室温固定1 h或者在4℃环境固定过夜。离心收集细胞,PBS洗涤细胞2次,注入500 μL 50 μg/mL浓度的碘化丙啶(Propidium Iodide, PI),再加100 μg/mL RNase A,0.2% Triton X-100。4℃或者避光孵育30~50 min或者室温20 min。随后,弃上清,PBS洗涤2遍,500 μL PBS再次混匀细胞,转移至24孔板中,待流式检测细胞周期。
2.9. 肿瘤细胞耐药性检测
将共培养前后的SKOV3消化计数后,以2 × 104个/mL的密度接种于96孔板中,每孔200 μL,分别设置不加药物的空白组,每组6个复孔。待细胞完全贴壁,往实验组加入药物溶液,空白组加入等量的无血清培养基,继续在37℃条件下培养箱中培养24 h。小心吸取旧的培养基,并用PBS洗涤3遍。采用倒置荧光显微镜在明场模式和暗场模式(固定曝光条件)下进行观察并拍照。
基于CCK8方法,检测药物抑制共培养前后肿瘤细胞增殖能力的程度。采用浓度为25 μg/mL为基准的药物DOX,将浓度为1 mg/mL药物储存液用无血清DMEM培养基稀释至25 μg/mL。
2.10. 数据处理及统计学方法
实验数据表示为平均值 ± 标准偏差(x ± s)。采用IBM SPSS Statistics统计软件包进行数据分析,使用单因素方差分析组内样本比较,使用t检验进行两组之间的样本比较。
3. 结果与讨论
3.1. 诱导培养前后细胞的形态学变化
正常细胞被诱导培养后,形态发生了显著变化。如图3所示,在明场下,诱导培养前的HUVEC和CNLMG细胞边界清晰,呈接触抑制生长。然而,诱导培养后的HUVEC和CNLMG细胞形态朝卵巢癌细胞形态发展:大小不一、聚集生长、边界模糊和无明显接触抑制。共培养前后的SKOV3细胞无明显变化。由此可见,诱导培养后的HUVEC和CNLMG形态高度符合肿瘤细胞形态特征,而卵巢癌细胞形态基本不受影响。
DAPI染色发现,诱导培养前HUVEC和CNLMG细胞的细胞核主要呈圆形和椭圆形,两者均无明显巨核现象,核膜光滑且完整。诱导培养后HUVEC和CNLMG细胞的细胞核特征为:形态不一,呈椭圆形、圆形、蚕豆形等(黄色箭头),出现巨核、双核(红色箭头),且出现核膜不光滑不完整等现象(绿色箭头)。综上可推论,卵巢癌细胞可使正常细胞的形态朝肿瘤细胞形态发展。由此可初步推断,正常细胞可以被癌细胞诱导为肿瘤相关细胞。
3.2. 肿瘤相关细胞标志物蛋白的表达
对于HUVEC而言,如图4(a)所示,诱导培养的HUVEC比单独培养的HUVEC表达出更多的VEGF。TEM1是肿瘤内皮细胞的标志物,而在图4(b)图中,诱导培养的HUVEC过表达此种蛋白。由此可见,HUVEC细胞已经被肿瘤细胞所捕获,并且已表达出与肿瘤细胞有关的标志蛋白。在TME中,VEGF的过表达会促使血管在低氧的环境下迅速增生,增强血管的通透性,促进肿瘤细胞对营养的获取进而利于肿瘤细胞的增殖。肿瘤细胞分泌出能促进HUVEC快速生长的细胞因子,因此两者之间发生相互促进的交互作用。这也从另一个角度印证了CCK8的结果。
Western blot 实验结果如图4(c)所示,可以明显看到,诱导培养的HUVEC表达更多的VEGF,而单独培养的HUVEC则表达较少。诱导培养的HUVEC过表达TEM1,而单独培养的HUVEC则表达较少甚至不表达此种蛋白,这与ELISA检测上清液蛋白含量的结果是吻合的。因此,进一步地说明了HUVEC细胞被SKOV3诱导成为了肿瘤相关血管内皮细胞。
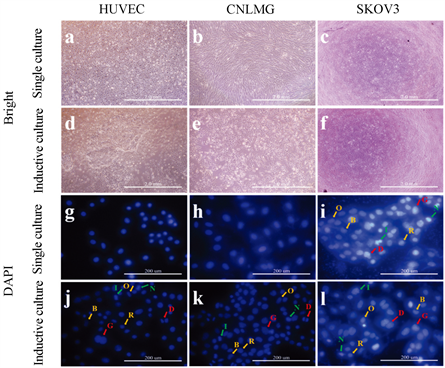
Figure 3. Cell morphology and fluorescence images of single and inductive culture
图3. 单独和诱导培养的细胞形态和荧光图像
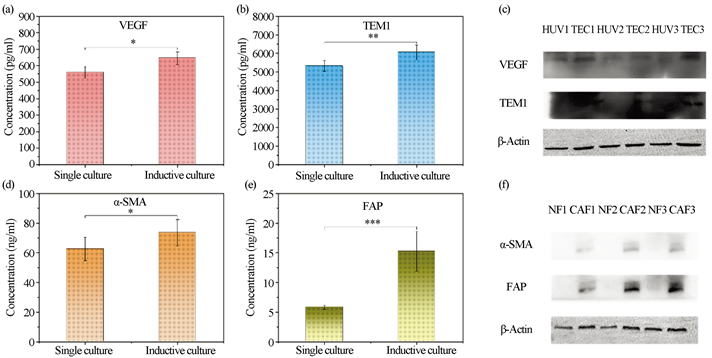
Figure 4. Protein expression of single culture and inductive culture: (a) Protein expression of VEGF in cell supernatants; (b) Protein expression of TEM1 in cell supernatants; (c) Western blot experiment to detect protein expression of VEGF and TEM1; (d) Protein expression of α-SMA in cell supernatants; (e) Protein expression of FAP in cell supernatants; (f) Western blot experiment to detect protein expression of α-SMA and FAP. n = 6, x ± s. Compared with single culture, *p < 0.05, **p < 0.01, ***p < 0.001
图4. 单独培养和诱导培养的蛋白质表达:(a) 细胞上清中VEGF的蛋白表达;(b) TEM1在细胞上清液中的蛋白表达;(c) 蛋白质印迹实验检测VEGF和TEM1的蛋白表达;(d) 细胞上清中α-SMA的蛋白质表达;(e) FAP在细胞上清液中的蛋白质表达;(f) 蛋白质印迹实验检测α-SMA和FAP的蛋白质表达;n = 6,x ± s。与单独培养相比,*p < 0.05, **p < 0.01, ***p < 0.001
对于CNLMG而言,之前有大量研究者提出肿瘤相关细胞的验证,CAF表达α-SMA,而正常成纤维细胞(Normal fibroblast, NF)则不表达α-SMA,也有研究者提出CAF过表达此种蛋白。与此同时,他们还提出CAF过表达FAP,NF则表达较少此种蛋白。图4(d)和图4(e)结果表明,诱导培养的成纤维细胞比单独培养的成纤维细胞表达更多的α-SMA和FAP。图4(f)中条带的粗细也可以明显地看出CAF比NF表达更多的标志蛋白α-SMA和FAP。由此可以说明诱导培养的成纤维细胞朝着肿瘤相关细胞发展。
3.3. 单独培养和诱导培养的细胞活性
使用CCK-8试剂盒检测在不同时间点的单层和双层共培养细胞的细胞活力。结果如图5所示,图5(a)中诱导培养细胞活性在前3~5天显著增加,诱导培养的SKOV3细胞活性在前3天随着时间增加而增加,在第3天达到峰值,然后下降直至死亡;前5天诱导培养的HUVEC的活性随着时间的推移而增加,在第5天到达峰值,随之逐渐下降。为了找寻两种细胞最佳的诱导培养时间,用CCK8检测单独和诱导培养至第4天的细胞活性,结果如图5(b)所示,诱导培养的SKOV3细胞数量约为单独培养的2.3倍,诱导培养的HUVEC细胞数量约为单独培养的1.5倍。诱导培养的细胞均比单独培养的细胞表现出更高的细胞活性,即说明拥有更强的增殖能力。因此,将4天作为后续实验的诱导培养时间。
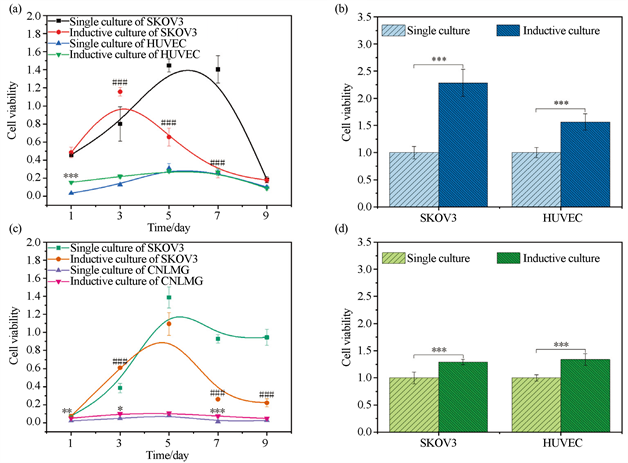
Figure 5. Cell viability of single or inductive culture. (a) Cell viability at different time of HUVEC and SKOV3 cells. (b) Cell viability on day 4 of HUVEC and SKOV3 cells. n = 6, x ± s. Compared with single culture of SKOV3, ###p < 0.001; Compared with single culture of HUVEC, ***p < 0.001; Compared with single culture, ***p < 0.001. (c) Cell viability at different time points of CNLMG and SKOV3 cells. (d) Cell viability on day 4 of CNLMG and SKOV3 cells. n = 6, x ± s. Compared with single culture of SKOV3, ###p < 0.001; Compared with single culture of CNLMG, *p < 0.05, **p < 0.01, ***p < 0.001; Compared with single culture, ***p < 0.001
图5. 单独或诱导培养的细胞活性:(a) HUVEC和SKOV3细胞在不同时间的细胞活性;(b) HUVEC和SKOV3细胞在第4天的细胞活性;n = 6,x ± s。与单独培养的SKOV3相比,###p < 0.001;与单独培养的HUVEC相比,***p < 0.001;与单独培养相比,***p < 0.001;(c) CNLMG和SKOV3细胞在不同时间点的细胞活性;(d) CNLMG和SKOV3细胞在第4天的细胞活性;n = 6,x ± s。与单独培养的SKOV3相比,###p < 0.001;与单独培养的CNLMG相比,*p < 0.05,**p < 0.01,***p < 0.001;与单独培养相比,***p < 0.001
图5(c)中诱导培养细胞的活性在前4~5天显著增加,诱导培养的SKOV3细胞活性在前5天随着时间的增加而增加,在第5天达到峰值,然后下降;诱导培养的CNLMG细胞活性在第5天到达峰值,随之逐渐下降。用CCK8检测单独和诱导培养至第4天的细胞活性,结果如图5(d)所示,诱导培养的SKOV3细胞数量约为单独培养的1.3倍,诱导培养的CNLMG细胞数量约为单独培养的1.4倍。诱导培养的细胞均比单独培养的细胞表现出更高的细胞活性。
总的来说,诱导培养的HUVEC和CNLMG细胞与肿瘤细胞呈相互促进,相辅相成的作用,而相互促进的速度取决于HUVEC和CNLMG细胞本身的生长速度,若增殖速度较快,则相互促进的程度越强;若增殖速度越慢,则相互促进的程度越弱。
3.4. 肿瘤相关细胞对SKOV3迁移和侵袭能力的影响
通过迁移和侵袭实验,图6用三个组上层肿瘤细胞在12小时和24小时穿过膜后小室膜上的细胞数量来反映肿瘤细胞的迁移和侵袭能力。一组表示孔板的下层只有含血清的培养基作为空白对照组,二组代表孔板下层接种正常细胞,三组则表示孔板下层接种肿瘤相关细胞。(I)中三组迁移的肿瘤细胞数量分别为:166 ± 67,208 ± 29,395 ± 43;侵袭的肿瘤细胞数量分别为:69 ± 24,200 ± 34,390 ± 28。(II)中迁移的肿瘤细胞数量分别为:147 ± 60,219 ± 45,425 ± 65;侵袭的肿瘤细胞数量分别为:122 ± 34,269 ± 26,406 ± 42。从(I)和(II)中都能看出第三组的数量最多,也就说明肿瘤相关细胞可以大大增强肿瘤细胞的迁移和侵袭能力。

Figure 6. Migration and invasion experiments: (I) Migration and invasion experiments of Blank, HUVEC and TEC. n = 6, x ± s. (II) Migration and invasion experiments of Blank, NF and CAF. n = 6, x ± s
图6. 迁移和侵袭实验:(I)空白组,血管内皮细胞组和肿瘤相关内管内皮细胞组n = 6,x ± s。(II)空白组,成纤维细胞组和肿瘤相关成纤维细胞组。n = 6,x ± s
3.5. 肿瘤相关细胞对SKOV3细胞周期的影响
通过对比共培养前后SKOV3细胞周期的检测,进一步验证肿瘤相关细胞对肿瘤细胞增殖能力的影响。结果如图7所示,共培养前的SKOV3细胞在每个阶段的占比是:Dead为0.02%,G0~G1期为62.25%,S期的占比为12.32%,G2~M期为25.27%。共培养后的SKOV3细胞在每个阶段的占比是:Dead为0.03%,G0~G1期为62.02%,S期的占比为16.06%,G2~M期为21.70%。对比共培养前和共培养后的细胞周期发现,两者在Dead和G0~G1期这两个阶段没有明显差异,后者在S期的占比较大,而S期正是DNA复制阶段。由此可知,共培养后的SKOV3细胞在S期的占比会增多。但是后者在G2~M期的占比相对前者少,说明该时刻细胞的分裂数较前者少。而通过细胞增殖实验发现,共培养后的SKOV3表现出更高的细胞活性。结合两个实验结果可知,SKOV3细胞的增殖能力主要由S期中所复制的DNA数量决定。由此可知,肿瘤相关细胞可增强SKOV3细胞的增殖能力。
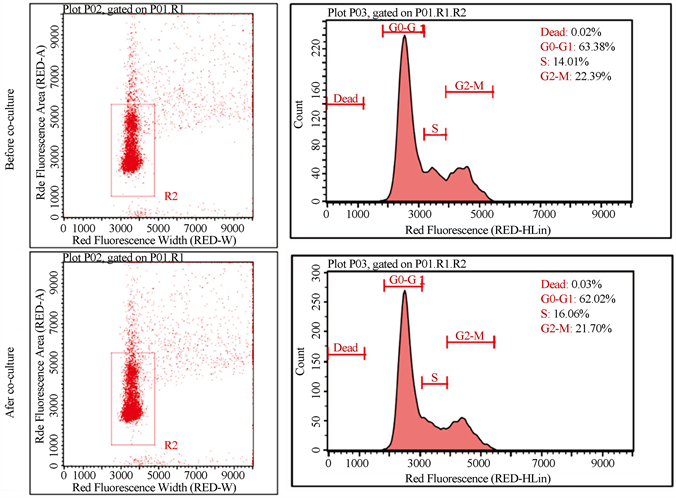
Figure 7. Cell cycle of SKOV3 cells before and after co-culture
图7. 共培养前和共培养后SKOV3的细胞周期
3.6. 肿瘤相关细胞增强了SKOV3细胞的耐药性
通过荧光实验,探究了共培养前后的SKOV3对游离DOX药物的获取情况。结果如图8(a)所示,在明场下,共培养前后的SKOV3细胞均有红色的DOX药物聚集在细胞表面,而共培养后的SKOV3聚集较少的DOX。由此可知,共培养前的SKOV3对药物的刺激更加敏感,药物作用较强。通过对比共培养前后SKOV3的荧光强度发现,共培养前的SKOV3中的荧光较强,而共培养后的SKOV3中的荧光较弱,此荧光不仅在分布在细胞质中,细胞核中也大量聚集。通过此结果可初步验证肿瘤相关细胞可增强肿瘤细胞的耐药性。
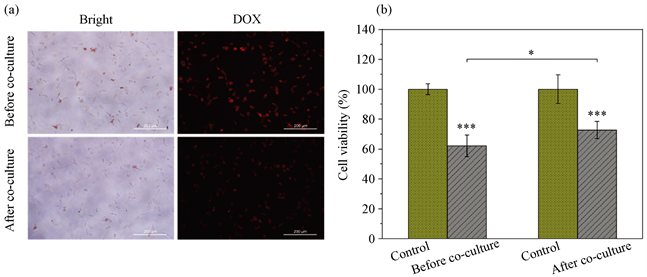
Figure 8. Drug resistance of ovarian cancer cells. (a) SKOV3 resistance testing before and after co-culture. (b) Anti-proliferative effect of free DOX drugs on SKOV3 cells before and after co-culture. ***p < 0.001 vs Control; *p < 0.05 vs single-cultivated cells
图8. SKOV3细胞的耐药性:(a) 共培养前后的SKOV3抗耐药性测试;(b) 游离DOX药物在共培养前后对SKOV3细胞的抗增殖作用;与对照相比,***p < 0.001;与单独培养的细胞相比,*p < 0.05
CCK8检测细胞活性结果如图8(b)所示,与Control相比,实验组在24小时内均表现出显著的抑制作用。对比两组实验组发现共培养后的SKOV3比共培养前的SKOV3表现出更高的细胞活性,进一步说明共培养后的SKOV3细胞的耐药性较共培养前的高。因此,可以认定肿瘤相关细胞可以一定程度地增强卵巢癌细胞的耐药能力。
4. 结论与展望
HUVEC和CNLMG与SKOV3细胞诱导培养后,两种正常细胞的细胞形态都朝着肿瘤细胞形态发展。增殖实验结果表明,相关细胞与肿瘤细胞是相互促进,互补的。诱导培养后的HUVEC细胞表达更多的VEGF和TEM1,诱导培养后的CNLMG细胞过表达α-SMA和FAP。通过比较诱导培养前后的肿瘤细胞形态,肿瘤相关细胞对卵巢癌细胞的形态几乎没有影响。细胞活力和流式细胞仪证实肿瘤相关细胞显着增强了SKOV3细胞的增殖能力。迁移和侵袭实验表明,肿瘤相关细胞可以大大增强肿瘤细胞迁移和侵袭能力。另外,在荧光图像中,与共培养前的肿瘤细胞相比,共培养后的肿瘤细胞吸收更少的药物并且具有更强的细胞活性。因此,共培养后肿瘤细胞的耐药性更强。在本研究中,采用Transwell技术构建的体外共培养系统可以有效地获得肿瘤相关细胞,并证实肿瘤相关细胞对卵巢癌细胞的生物学行为具有一定程度的影响。
尽管目前诱导培养出CAF和TEC并且鉴定了它们的肿瘤相关性,但是肿瘤微环境中的成分是复杂的。而本研究诱导培养出两种TME的组成部分,考虑可以涉及更多肿瘤微环境中的成分。因此,TME中肿瘤相关巨噬细胞的诱导培养也是重要的研究方向。
致谢
感谢国家自然科学基金(项目号:51372157)对本研究的资助。
NOTES
*通讯作者。