1. 引言
植物病害是危害农业生产的自然灾害之一,阻碍农作物生长发育,引起产量降低,给农户造成巨大经济损失。化学药剂是农业生产上植物病害防控的主要方式,防治效果显著的同时,长期以来的不合理使用造成的环境污染、生物多样性破坏、病原菌抗药性增强、农产品质量下降等负面问题也日益加剧 [1] [2] [3] [4]。随着人们环保意识以及食品安全意识的不断增强,生物防治受到了植物保护工作者的重视,其中环境相容性好、高防效、作用谱广、对人畜低毒的微生物农药受到青睐 [5]。
细菌、真菌、放线菌,甚至病毒和原生动物等均可作为微生物农药应用于植物病害的生物防治中 [5] [6] [7] [8] [9]。但细菌具有的分布广泛、种类多样、繁殖速度快、代谢活动复杂、对病原菌作用方式多样等的特点,使其成为主要的微生物农药开发源。
植物内生菌(endophyte)是指那些在其生活史的一定阶段或者全部阶段生活于健康植物的各种组织和器官内部,又不引起植物明显病害的微生物,它们与植物之间存在一种复杂的微生态关系 [10]。目前,内生菌泛指一切生活在植物体内的腐生、寄生和共生的真菌、细菌、放线菌等微生物 [10]。内生菌具有重要的生物学和生态学价值,能够促进宿主生长,增强宿主植物抗逆境、抗病虫害作用,增加宿主植物的他感作用等 [11]。植物内生菌可产生丰富多样的具有生物活性的代谢产物,在生物医药、植物病虫害防控等方面也发挥着重要的作用 [12]。但植物内生细菌因与植物互利共生、抗逆性强、危害小、定殖快的优点,成为微生物农药研究的主要对象 [13] [14]。
防风(Saposhnikovia divaricata (Trucz.) Schischk.)属于被子植物门、双子叶植物纲、伞形科、防风属植物,多年生草本。防风根部具有治疗感冒头痛、风湿痹痛、风疹瘙痒、破伤风等功效。随着临床研究的深入,根部有效成分还可以治疗风湿性关节炎、类风湿关节炎、肩关节周围炎等关节性顽疾。
本研究采用常规方法对采自云南的防风内生细菌进行分离,从根部筛选出一株对多种病原细菌和病原真菌具有光谱抗性的内生细菌,命名为FFR3,并从微生物的培养、形态及分子生物学入手,对其进行鉴定。采用硫酸铵沉淀、乙醇醇沉、不同有机溶剂分级萃取FFR3胞外抑菌物质,以金黄色葡萄球菌和丁香假单胞杆菌桑致病变种为指示菌,对其抑菌物质种类进行初步分析,探讨了抑菌物质的特性,为新型微生物农药的开发提供一定的理论依据。
2. 材料与方法
2.1. 供试材料
植物材料:防风(Saposhnikovia divaricata (Trucz.) Schischk.),采自云南省曲靖市师宗县高良乡岭黑村老庄科。
病原真菌:核盘菌(Sclerotinia sclerotiorum)、禾谷丝核菌(Rhizoctoniazeae)、串珠镰胞菌(Fusarium moniliforme)、辣椒疫霉(Phytophthora capsici)和灰霉菌(Botrytis cinerea)。
病原细菌:梨火疫病菌(Erwinia amylovory)、稻黄单胞菌水稻致病变种(Xanthomonas oryzae pv. oryzae)、苏云金芽孢杆菌(Bacillus thuringiensis)、金黄色葡萄球菌(Staphylococcus aureus)、丁香假单胞杆菌桑致病变种(Pseudomonas syringae pv. mori)。
2.2. 培养基
LB培养基:胰蛋白胨10 g,酵母浸膏5 g,氯化钠10 g,琼脂15~20 g,蒸馏水1 L (pH 7.4)。
PDA培养基:马铃薯200 g,削皮,洗净切小块,加适量蒸馏水煮沸20 min,四层纱布过滤。滤液中加入葡萄糖20 g,琼脂15~20 g,蒸馏水定容至1000 mL。pH自然。
NB培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g,蒸馏水1000 mL (pH 7.4~7.6)。
KB培养基:蛋白胨20 g,甘油10 mL,K2HPO4 1.5 g,MgSO4∙7H2O 1.5 g,水1000 mL (pH 7.0~7.2)。用于丁香假单胞杆菌桑致病变种的培养。
2.3. 内生细菌菌株的筛选
防风成熟根,流水洗净表面附属物,切成3~4 cm长小段,1%次氯酸钠溶液浸泡2 min后,无菌水冲洗多次,再用75%乙醇浸泡2 min,无菌水冲洗多次。根在超净工作台中晾干表面水分,切成0.5~1 cm长小段,纵切成两半,切面贴附于PDA平板中,28℃培养3~7天。期间分离根周边生长的可挑取细菌菌落,并转接于新的PDA平板进行纯化。纯化后菌株接种于PDA培养基斜面,4℃冰箱中保存备用。其中一株命名为FFR3的菌株经初筛后用于实验。
取最后一次清洗的无菌水100 μL涂布于PDA培养基平板,培养后无菌生长,表明根表面附生菌已清除,分离菌株为防风根部内生细菌。
2.4. 内生细菌FFR3的鉴定
2.4.1. 电镜形态学鉴定
将FFR3接种于LB液体培养基中,37℃震荡培养24 h后(120 rpm),取250 μL菌液加入到含有3 mL LB液体培养基的六孔板中,加入细胞爬片,封口膜密封。静置4 h后,置于摇床中37℃振荡培养(30 rpm)。24 h和72 h后取出细胞爬片,经前固定、清洗、后固定、脱水、干燥、镀金等,扫描显微镜下观察菌细胞形态。
2.4.2. 分子生物学鉴定
采用细菌基因组DNA提取试剂盒(天根生物科技有限公司)提取内生菌基因组DNA,使用通用上游8F (5'-AGAGTTTGATCCTGGCTCAG-3')和下游1510R (5'-TACGGYTACCTTGTTACGACTT-3')引物进行PCR扩增。50 μL PCR扩增体系:10×buffer 5 μL,dNTP (10 mmol/L) 1 μL,上下游引物各1 μL,细菌基因组DNA 2 μL,MgCl2 (15 mmol/L) 0.5 μL,Taq酶0.5 μL,ddH2O 39 μL。PCR反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸60 s,25个循环,最后72℃延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后委托南京金斯瑞生物科技有限公司完成测序工作。
菌株FFR3的16S rRNA基因在NCBI数据库中进行BLAST比对,筛选同源序列。选择同源性较高的序列,采用MEGA(version 6.06)软件包中的neighbor-joining法构建系统进化树分析系统发育地位。
2.5. 内生细菌FFR3的广谱抗性分析
2.5.1. 对病原细菌的抑制效应分析
采用平板涂布法分析FFR3对病原细菌的抑制效应 [15]。取直径6 mm的在PDA培养基上生长24 h的FFR3小块,接种在涂有病原细菌菌悬液的PDA平板中(丁香假单胞杆菌桑致病变种用KB培养基,下同。),于37℃培养箱中培养3 d,分析FFR3对病原细菌的抑制效果。抑菌圈直径(mm) = 总直径 − FFR3小块直径(6 mm)。
2.5.2. 对病原真菌的抑制效应分析
采用平板对峙法分析FFR3对病原真菌的抑制效应 [16]。在PDA培养基上以真菌菌块(f = 6 mm)为中心,距离1 cm左右的三个位置点接FFR3菌株,28℃培养箱中静置培养3 d,分析FFR3对病原真菌的抑制效果。菌株与病原真菌之间的距离表示抑制效果的强弱。
2.5.3. 对病原真菌的形态影响
取出预先浸泡在75%乙醇中的盖玻片并晾干,在2.5.2方法的基础上,成30˚角斜插在真菌菌块和FFR3之间。28℃培养箱中静置培养3天后,取出盖玻片,菌丝面朝下,盖在洁净的载玻片上,光学显微镜下观察菌丝形态。
2.6. 内生细菌FFR3胞外抑菌物质抑菌效果检测
将菌株FFR3分别接种在LB培养基、NB培养基和PD培养基中(50 mL/150 mL),120 rpm、37℃条件下震荡培养3 d。培养液在8000 rpm、4℃条件下离心20 min,收集上清液并用0.2 μm无菌滤膜过滤除菌。将灭菌干燥后的滤纸片(f = 6 mm)完全浸泡在上述除菌上清液中30 min,用于分析胞外抑菌物质对病原菌的抑菌效果。
参照2.5.1的方法,将滤纸片取出晾至微干,贴在涂有病原细菌菌悬液的培养基平板中。37℃培养箱中培养3 d,观察对病原细菌的抑制效果。
参照2.5.2的方法,取直径6 mm病原真菌小块贴在PDA培养基平板中央,以真菌菌块为中心,距离1 cm左右的位置贴附晾至微干的滤纸片,28℃培养箱中培养3 d,观察对病原真菌的抑制效果。
2.7. 内生细菌FFR3胞外抑菌物质的初步分离
将FFR3接种在LB液体培养基中,在120 rpm、37℃条件下震荡培养3 d,8000 rpm、4℃条件下离心20 min后得到含胞外抑菌物质的上清液。
2.7.1. 蛋白质或多肽类物质的分离
分别将上清液用20%、30%、40%、50%、60%、70%硫酸铵分级沉淀,10000 rpm离心20 min,弃去上清,获得蛋白质或多肽类物质沉淀。用PBS缓冲溶液(0.1 moL/L, pH 7.2)将沉淀悬浮,悬浮液在透析袋(截留分子质量8000~14000 D)中透析去盐后冷冻干燥。用PBS缓冲液将沉淀配制成1 mg/mL稀释液,采用2.6滤纸片法测定蛋白质或肽类物质的抑菌性。
2.7.2. 多糖类物质的分离
分别将上清液用20%和40%的乙醇醇沉,收集沉淀获得多糖类物质。用PBS缓冲溶液(0.1 moL/L, pH 7.2)将沉淀配制成1 mg/mL稀释液,采用2.6滤纸片法测定多糖类物质的抑菌性。
2.7.3. 次生代谢物的分离
以等体积石油醚、二氯甲烷、乙酸乙酯对上清液进行分级萃取,萃取后旋转蒸发仪浓缩。甲醇溶解沉淀物配成10 mg/mL稀释液,以甲醇为对照,采用2.6滤纸片法测定次生代谢物的抑菌性。
2.8. 内生细菌FFR3胞外硫酸铵沉淀抑菌物质的稳定性
在得到的最佳硫酸铵沉淀条件下,以指示菌为实验对象,采用2.6滤纸片法检测FFR3胞外抑菌物质对温度、蛋白酶和酸碱(pH)的稳定性。
2.8.1. 抑菌物质的温度稳定性
将溶解于PBS缓冲液(0.1 moL/L, pH 7.2)的等体积1 mg/mL抑菌物质溶液分别在30℃、50℃、70℃、80℃、90℃、100℃水浴中处理30 min,在121℃的灭菌锅中灭菌30 min,检测胞外抑菌物质对温度的稳定性。
2.8.2. 抑菌物质的蛋白酶稳定性
分别滴加20 μL浓度为1 mg/mL的蛋白酶K和胰蛋白酶于2 mL PBS缓冲液溶解的抑菌物质溶液中,颠倒混匀(轻缓),37℃静置反应10 min后,以相同浓度的不做处理的溶液作为对照,检测胞外抑菌物质对蛋白酶的稳定性。
2.8.3. 抑菌物质的酸碱稳定性
用浓度为1 mol/L的盐酸和氢氧化钠溶液分别将1 mg/mL的抑菌物质的pH调节为2、4、6、8、10、12,颠倒混匀(轻缓),室温静止5 min后,检测抑菌物质对酸碱的稳定性。
3. 结果与分析
3.1. 内生生防细菌FFR3的筛选
实验从防风根中共筛选出内生细菌14株,经初步分析,编号为FFR3的菌株对多种病原细菌和真菌有明显的抑制作用。菌株FFR3的菌落中间薄,边缘厚且有褶皱,粘稠难以分离。接种24 h内颜色为透明状,之后逐渐变暗,接近暗橘色(图1);革兰氏染色后,菌细胞部分呈红色,部分呈紫色(图2),属于革兰氏可变菌。
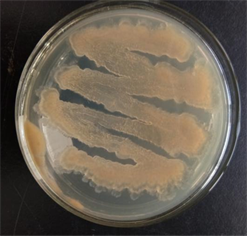
Figure 1. Colony morphology of strain FFR3
图1. 菌株FFR3的菌落形态
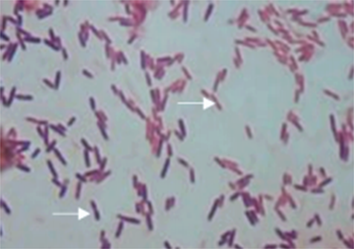
Figure 2. Gram staining of strain FFR3 (10 × 100). Left arrow: Gram- positive bacteria (G+); Right arrow: Gram-negative bacteria (G−)
图2. 菌株FFR3的革兰氏染色(10 × 100倍)。左箭头:革兰氏阳性菌(G+);右箭头:革兰氏阴性菌(G−)
3.2. 内生生防细菌FFR3的鉴定
光学显微镜和扫描电子显微镜形态分析表明,在培养24 h内,FFR3菌细胞呈杆状,主要以无丝分裂方式繁殖,表面多糖分泌物较多(图3(a)和图3(c))。培养72 h后,部分菌细胞变椭圆形,菌体一端膨大后细胞壁变薄,随后破裂释放出芽孢;或者向内凹陷碎裂,芽孢随之释放(图3(b)和图3(d))。推测FFR3在不同的环境中可通过两种不同的方式繁殖,具体繁殖方式可能受培养时间、培养基成分、湿度等影响。结合FFR3的16S rRNA序列和进化树分析(图4),鉴定该菌株为类芽孢杆菌(Paenibacillus spp.)。
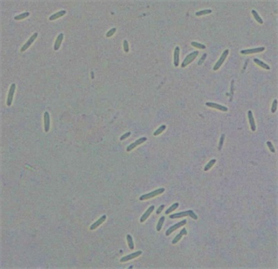 (a)
(a) 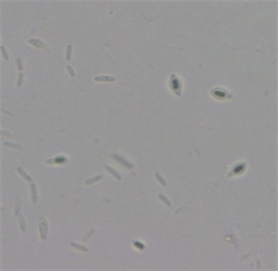 (b)
(b)  (c) (d)
(c) (d)
Figure 3. Morphology of strain FFR3. (a) and (b) Morphology under optical microscope (10 × 100); (c) and (d) Morphology under scanning electron microscope (×10,000)
图3. 菌株FFR3的形态。(a)和(b) 光学显微镜形态(10 × 100);(c)和(d) 扫描电镜形态(×10,000)

Figure 4. Phylogenetic tree of strain FFR3 based on 16S rRNA gene sequence
图4. 依据菌株FFR3的16S rRNA基因序列构建的系统发育树
3.3. 内生生防细菌FFR3的广谱抗性
3.3.1. FFR3对病原细菌的抗性
菌株FFR3与病原细菌共培养3 d后结果如表1所示。抑菌圈直径越大,抑制效果越显著。FFR3对实验用5种病原细菌均具有一定的抑制效果,其中对金黄色葡萄球菌的抑菌效果最好,抑菌圈直径可达24.70 ± 5.30 mm;对丁香假单胞杆菌桑致病变种和梨火疫病菌的抑制效果相当;对稻黄单胞菌水稻致病变种和苏云金杆菌的抑制效果较弱。FFR3对5种病原细菌的抑制强度有一定的差异性,后述实验以抑菌效果强的金黄色葡萄球菌和丁香假单胞杆菌桑致病变种为监测菌。

Table 1. Inhibitory effects of strain FFR3 on pathogenic bacteria
表1. 菌株FFR3对病原细菌的抑制效果
注:表中同列数据后不同小写字母表示差异显著(P < 0.05)。
3.3.2. FFR3对病原真菌的抗性
共培养3 d后,菌株FFR3对病原真菌的抑制效果如表2所示。菌株与病原真菌之间的抑菌距离越大,抑菌效果越好。FFR3对5种供试病原真菌均具有一定的抑制效果,其中对核盘菌、禾谷丝核菌和辣椒疫霉的抑制效果最好,对串珠镰胞菌和灰霉菌的抑制强度相对较弱。灰霉菌是一种广寄主性的、能够引起多种植物致病的病原真菌。截止2013年,世界上尚未发现任何一种植物对灰霉菌产生抗性 [17] [18]。核盘菌是危害作物和蔬菜的世界性重要病原菌,防治主要依靠化学农药 [19] [20]。综合实验可行性以及病原菌研究背景,后续实验选择核盘菌和灰霉菌为监测菌。

Table 2. Inhibitory effects of strain FFR3 on pathogenic fungi
表2. 菌株FFR3对病原真菌的抑制效果
注:表中同列数据后不同小写字母表示差异显著(P < 0.05)。
3.3.3. FFR3对病原真菌菌丝体形态的影响
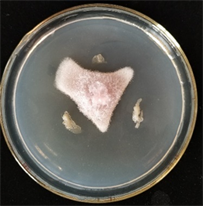
FFR3对核盘菌表现出明显的抑制,抑制边缘的菌丝颜色比正常菌丝深,菌丝密且短(图5(a))。核盘菌的正常菌丝表面光滑饱满(图5(b));受FFR3影响菌丝呈脱水皱缩状态,原生质体透明,菌体扁平(图5(c));新生菌丝受FFR3影响后脱水,最终被破坏脱落(图5(d))。
FFR3显著抑制灰霉菌的生长(图6(a));正常菌丝表面光滑(图6(b));受抑制菌丝皱缩断裂,较正常菌丝变短变细(图6(c)),且环状或U型打环(图6(d))。
3.4. 内生生防细菌FFR3胞外抑菌物质的初步分析
3.4.1. 产抑菌物质优势培养基筛选
采用2.6滤纸片法筛选不同发酵培养基中FFR3胞外抑菌物质的抑菌强度,以抑菌圈直径减去滤纸片(f = 6 mm)直径表示抑菌强度。PDA培养基发酵产物对2种监测病原细菌均无抑制作用;NB培养基发酵
 (a)
(a) 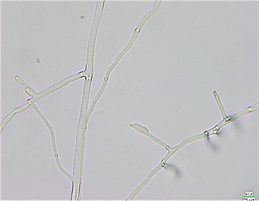 (b)
(b) 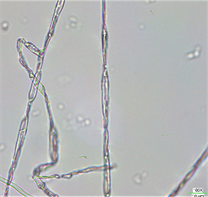 (c)
(c) 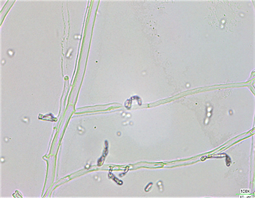 (d)
(d)
Figure 5. Effects of strain FFR3 on the morphology of Sclerotinia sclerotiorum. (a) Confrontation test of strain FFR3 and Sclerotinia sclerotiorum; (b) Normal hyphae of Sclerotinia sclerotiorum (10 × 40); (c) and (d) Confrontation hyphae of Sclerotinia sclerotiorum (10 × 40)
图5. 菌株FFR3对核盘菌形态的影响。(a) FFR3与核盘菌对峙实验;(b) 核盘菌正常菌丝(10 × 40);(c)和(d) 核盘菌对峙培养菌丝(10 × 40)
 (a)
(a)  (b)
(b)  (c)
(c)  (d)
(d)
Figure 6. Effects of strain FFR3 on the morphology of Botrytis cinerea. (a) Confrontation test of strain FFR3 and Botrytis cinerea; (b) Normal hyphae of Botrytis cinerea (10 × 40); (c) and (d) Confrontation hyphae of Botrytis cinerea (10 × 40)
图6. 菌株FFR3对灰霉菌形态的影响。(a) FFR3与灰霉菌对峙实验;(b)灰霉菌正常菌丝(10 × 40);(c)和(d) 灰霉菌对峙培养菌丝(10 × 40)
产物对丁香假单胞杆菌无抑制作用,但对金黄色葡萄球菌抑制效果显著;LB培养基发酵产物对2种监测菌均有抑制作用,且彼此间无显著差异(表3)。此结果表明,抑菌物质可能是多种物质,不同的培养基对不同产物的产生效果不同,对不同病原细菌的抑制效果也不同。LB培养基发酵液的抑菌谱广且抑菌强度稳定,因此采用LB发酵培养基进行后续实验的菌株培养发酵。

Table 3. Antibacterial effects of fermentation broth with different medium
表3. 不同培养基发酵液抑菌效果
注:表中数据后不同小写字母表示差异显著(P < 0.05)。
3.4.2. 盐析和醇沉法分离胞外抑菌物质
以金黄色葡萄球菌和丁香假单胞杆菌两种病原细菌为监测菌,以LB培养基为发酵培养基,以硫酸铵盐析和乙醇醇沉法分离FFR3胞外物质,采用2.6滤纸片法检测抑菌效果,结果如表4所示。多糖溶于水而不溶于乙醇,随着乙醇的加入,发酵液中的多糖产物逐步析出。20%和40%的醇沉产物对2种监测菌均无抑制作用,表明多糖类物质不是抑菌物质的成分。发酵产物中加入硫酸铵,可有效降低蛋白质(或肽类)的溶解度,使蛋白质(或肽类)脱水凝聚沉淀。20%、30%和40%硫酸铵沉淀对2种监测病原细菌均有较好抑制效果;50%硫酸铵沉淀仅对金黄色葡萄球菌表现抑制作用,70%硫酸铵沉淀仅对丁香假单胞杆菌表现抑制作用,且抑制效果均较弱。因此推测,FFR3的抑菌产物可能是蛋白类(或肽类)物质,可用20%、30%和40%硫酸铵初步盐析分离。
3.4.3. 有机溶剂萃取胞外抑菌物质
液体中混合物各组分在不同有机溶剂中的溶解度不同,利用不同的有机溶剂可有效的萃取发酵液中的不同组分。FFR3发酵液不同萃取相对金黄色葡萄球菌均有一定的抑制作用,其中以乙酸乙酯相和二氯甲烷相的抑制效果最强。仅乙酸乙酯相对丁香假单胞杆菌表现出一定的抑制效果,且与LB发酵液的效果相当(表5)。石油醚是一种极性小的有机溶剂,可有效萃取混合液中小极性脂溶性的化合物,如油脂、蜡、挥发油以及固醇、三萜化合物等物质;二氯甲烷的极性比石油醚略大,可溶解色素、酯类等小极性物质;而乙酸乙酯对游离生物碱、有机酸、黄酮及苷元等中等级性化合物的萃取效果较好;水可提出糖类、无机盐、氨基酸等水溶性的成分。不同监测菌对不同次级代谢产物的敏感度不同,可利用有机溶剂的萃取成分差异性筛选出最有效的代谢产物。FFR3胞外抑菌物质主要分布在二氯甲烷相和乙酸乙酯相,推测某些生物碱或者黄酮类物质参与了FFR3的抑菌效应。

Table 4. Antibacterial effects of alcohol precipitation and salting-out components in FFR3 fermentation broth
表4. FFR3发酵液醇沉和盐析成分的抑菌效果
注:“-”无抑制作用,“+”有抑制作用,“++”抑制作用较强。

Table 5. Antibacterial effects of antibacterial substances extracted by different organic solvents
表5. 不同有机溶剂萃取的抑菌物质的抑菌效果
注:表中同列数据后不同小写字母表示差异显著(P < 0.05)。
3.5. 内生生防细菌FFR3蛋白类(或肽类)抑菌物质的稳定性
3.5.1. 对温度的稳定性
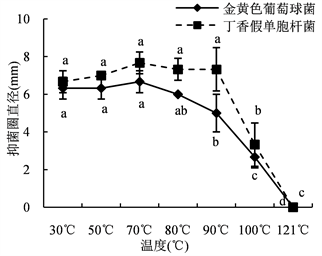
30%和40%的硫酸铵沉淀对指示菌的抑制效果受到温度的影响。当温度低于90℃时,30%硫酸铵沉淀的抑菌效果比较稳定;在温度达到100℃时,沉淀的抑菌活性大幅下降;在高压蒸汽灭菌条件下,沉淀失去抑菌活性(图7(a))。40%硫酸铵沉淀在温度低于80℃时对丁香假单胞杆菌的抑制效果稳定保持,在温度低于90℃时对金黄色葡萄球菌的作用效果比较稳定,而后随温度升高急剧下降,在高压蒸汽灭菌条件下,失去抑菌活性(图7(b))。表明FFR3的蛋白类(或肽类)抑菌物质对温度具有良好的耐受性。
3.5.2. 对蛋白酶的稳定性
蛋白酶K是一种高活性蛋白酶,可有效降解生物样品中的蛋白质;胰蛋白酶属肽链内切酶,能把多肽链中赖氨酸和精氨酸残基中的羧基侧切断,是特异性最强的蛋白酶。经蛋白酶处理后,30%和40%的硫酸铵沉淀对2种监测菌的抑制活性均明显下降(图8),表明抑菌物质对蛋白酶敏感,属于蛋白质(或肽类)物质。
 (a)
(a) 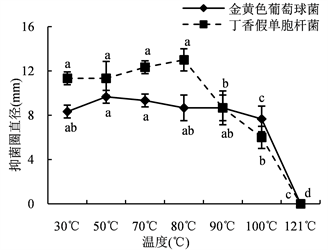 (b)注:图中同一组数据上不同小写字母表示差异显著(P < 0.05)。
(b)注:图中同一组数据上不同小写字母表示差异显著(P < 0.05)。
Figure 7. Effects of ammonium sulfate precipitation on antibacterial activities by different temperatures. (a) Antibacterial activity of 30% ammonium sulfate precipitation; (b) Antibacterial activity of 40% ammonium sulfate precipitation
图7. 温度对硫酸铵沉淀抑菌活性的影响。(a) 30%硫酸铵沉淀的抑菌活性;(b) 40%硫酸铵沉淀的抑菌活性
 (a)
(a) 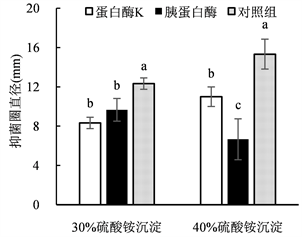 (b)注:图中同一组数据上不同小写字母表示差异显著(P < 0.05)。
(b)注:图中同一组数据上不同小写字母表示差异显著(P < 0.05)。
Figure 8. Effects of ammonium sulfate precipitation on antibacterial activities by different proteases. (a) Antibacterial activity to Pseudomonas syringae pv. Mori; (b) Antibacterial activity to Staphylococcus aureus
图8. 蛋白酶对硫酸铵沉淀抑菌活性的影响。(a) 对丁香假单胞杆菌的抑制活性;(b) 对金黄色葡萄球菌的抑制活性
3.5.3. 对酸碱的稳定性
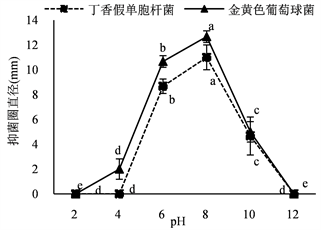
30%的硫酸铵沉淀和40%的硫酸铵沉淀的抑菌活性均受pH值的影响很大,在中性条件下抑菌活性比较稳定,在强酸性和强碱性条件下不稳定,在pH值达到10以上或者5以下抑菌活性急剧下降,说明该抑菌物质的活性pH范围比较广(图9)。
 (a)
(a) 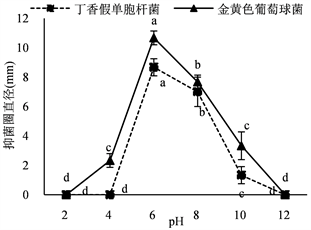 (b)注:图中同一组数据上不同小写字母表示差异显著(P < 0.05)。
(b)注:图中同一组数据上不同小写字母表示差异显著(P < 0.05)。
Figure 9. Effects of ammonium sulfate precipitation on antibacterial activities by acid-base. (a) Antibacterial activity of 30% ammonium sulfate precipitation; (b) Antibacterial activity of 40% ammonium sulfate precipitation
图9. 酸碱性对硫酸铵沉淀抑菌活性的影响。(a) 30%硫酸铵沉淀的抑菌活性;(b) 40%硫酸铵沉淀的抑菌活性
4. 结论
本研究从中草药防风的根中共筛选出内生细菌14株,其中一株命名为FFR3的菌株对多种病原细菌和病原真菌具有明显的抑制活性,具有光谱抗性。FFR3属于革兰氏可变菌,接种后24 h内以无丝分裂繁殖方式为主,72 h后产生内生孢子。通过形态学和分子生物学鉴定该菌株为类芽孢杆菌(Paenibacillus spp.)。
菌株FFR3可使真菌菌丝脱水皱缩进而断裂,菌丝变短变细,菌丝环状或U型打环,从而破坏病原真菌菌丝体,达到抑制病原真菌的效果。
通过硫酸铵沉淀、乙醇醇沉、不同有机溶剂分级萃取LB发酵液中的胞外抑菌物质,以金黄色葡萄球菌和丁香假单胞杆菌桑致病变种为指示菌,可初步判定抑菌物质为蛋白质(或肽类)类物质、生物碱或者黄酮类物质。
硫酸铵沉淀的蛋白质(或肽类)类物质具有良好的热稳定性,在低于80℃时保持良好的抑菌活性;在蛋白酶K和胰蛋白酶处理后,活性明显下降;在pH 6~8即中性范围内对指示菌的抑制效果较高,在pH值达到10以上或者5以下抑菌活性急剧下降。
类芽孢杆菌分布广泛,对人畜安全和无污染,美国环保署将其列为可在商业上应用的微生物之一,2006年也被我国农业部列为免做安全鉴定的一级菌种,是一种重要的植物病害生物防治微生物。此外,类芽孢杆菌在环境污染治理、食品、医药等领域均有广阔的应用前景 [21] [22]。
基金项目
2020年江苏科技大学大学生创新计划项目。
NOTES
*通讯作者。