1. 引言
碲是一种P型半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,“是当代高技术新材料的支撑材料” [1]。碲以其良好的金属性能广泛的应用于冶金、医药、玻璃陶瓷、石油化工以及新兴领域如太阳能、半导体和航空航天等领域,且已经成为了重要的战略资源 [2] [3]。然而,碲作为半导体材料在新兴领域应用,其半导体材料的性能取决于碲的纯度,即使半导体材料中的杂质含量达到ppm级,也可能产生高能级并影响高科技设备电子性能 [4] [5]。因此,近年来,从不同原材料中提纯碲成为研究热点。
工业化生产的碲主要来自于铜电解精炼阳极泥,碲含量通常在2%~10%,绝大多数以Ag2Te、Cu2Te、Au2Te等形式存在 [6];其他少量来源于铅精炼产生的碱浮渣、碲铋金矿、硫酸厂的泥浆以及硫酸厂和冶炼厂的烟尘等。目前国内外从铜阳极泥中提取碲的方法主要有纯碱焙烧法、硫酸化焙烧法、氧化酸浸法、氧化碱浸法、氯化法、萃取法等 [7] [8] [9]。然而上述方法只能获得粗碲及氧化碲粉,必须对该粗产品进行提纯。高纯碲是制备半导体化合物材料的重要原料,其制备方法主要包括化学法、电沉积法、真空蒸馏法、水热合成及区域熔炼法等 [8] [10] - [16]。然而,每种方法都有其自身的缺点,例如,气相沉积和喷雾热解可能会导致高能耗和高设备成本,水热合成法很难进行大规模生产。再如电沉积法,碲的年产量低、电流密度为40 A/m2且能耗高,通常直收率仅为70% [7]。基于本课题组前期研究 [17],为了提高碲的回收率及生产效率,降低高纯碲的生产成本,本文采用二氧化硫还原工艺,以氯离子作为催化剂,进行了氧化碲粉催化还原制备精碲的研究及工业生产。工业实践表明碲的直收率达到97.5%以上,与电沉积相比人力成本减少80%,宜于大规模生产。
2. 实验
2.1. 实验原料
盐酸(分析纯AR,36%~38%)由成都市科隆化学品有限公司提供,氨水(分析纯AR,25%~28%)购买于湖南汇虹实际有限公司,二氧化硫(纯度为99.99%)购置于湖南茂盛化工新科技有限公司,去离子水为中南大学自制。
实验所用氧化碲粉由某公司提供,其主要化学成分如表1所示。由表1可知,氧化碲粉中碲含量为62.66%,杂质Na、S含量较高,分别为3.95%、2.13%,其它元素含量均小于1%。此外对原料进行XRD分析,其结果如图1所示,由图1可知,除氧化碲外未检测出其它物质的特征衍射峰。

Table 1. Chemical composition of tellurium oxide (wt.%)
表1. 氧化碲化学成分组成(wt.%)
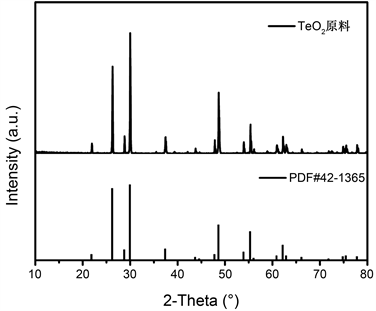
Figure 1. XRD pattern of tellurium oxide sample
图1. 氧化碲原料XRD谱图
2.2. 实验步骤及工艺流程
2.2.1. 盐酸浸出
将一定浓度盐酸溶液倒入圆底烧瓶,按一定液固比进行反应,在搅拌速率为300 r/min条件下浸出,经过滤获得TeCl4溶液,分别考察浸出温度、时间、液固比以及盐酸浓度对碲浸出效果的影响 [18]。
2.2.2. 催化还原
取一定量TeCl4溶液置于圆底烧瓶并加热至85℃,在搅拌速率为300 r/min条件下将SO2气体按体积流量为1 L/min通入上述溶液,研究还原时间对碲还原率的影响。
2.2.3. 洗涤除杂
还原碲粉经去离子水洗涤3次(液固比3:1,时间为20 min/次)。水洗后碲粉采用氨水洗涤,分别研究洗涤时间、温度以及氨水浓度对杂质去除的影响。
2.2.4. 铸锭
还原碲粉经过洗涤除杂后于中频炉内铸锭。分段控制中频炉温度,升温100℃~120℃,当水蒸气蒸发后继续升高温度,在铸锭温度为590℃,铸锭时间1 h。铸锭后除去表层氧化碲,即为合格碲锭。
2.2.5. 氧化碲粉制备精碲实验流程图
以氧化碲粉为原料制备精碲实验流程如图2所示:
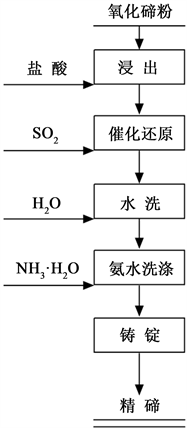
Figure 2. Test flow chart for tellurium ingot (Te 99.99%)
图2. 碲锭(Te 99.99%)制备试验流程图
2.3. 分析与检测
氧化碲粉样品经酸溶解,采用电感耦合等离子发射光谱仪(ICP-OES,IRIS IntrepidⅡ XSP)分析样品主要化学成分。采用日本理学D/max-TTR Ⅲ型X射线衍射仪(XRD)分析固体物相。固体样品微观形貌通过日本电子株式会社JSM-6300型场发射电镜(SEM)观察。精碲样品质量检测按照国内行业标准YS/T 222-2010采用差减法计算分析。具体分析如下,碲粉经ICP-MS分析杂质元素含量,碲粉总质量减去杂质含量即为碲粉质量如(1)计算:
其中:
为碲粉质量,
为碲粉总质量,
为碲粉中11种所要求元素总质量。
3. 结果与讨论
3.1. 盐酸浸出
3.1.1. 浸出温度对碲浸出效果的影响
盐酸浓度为9.4 mol/L、浸出时间为60 min和液固比为4:1的条件下,浸出时间对碲浸出率的影响如图3所示。

Figure 3. Influence of leaching temperature on leaching effect
图3. 浸出温度对浸出效果的影响
由图3可知,浸出温度从40℃升高到60℃过程中,碲的浸出率呈现明显增长趋势,从85.6%升高至97.6%。浸出温度的升高,有利于固液相传质传热加快,提高氧化碲浸出率。浸出温度进一步提高至80℃,碲的浸出率未发生明显的变化。温度升高,反应能耗增加且盐酸挥发量增加,因此,浸出温度选择60℃为宜。
3.1.2. 浸出时间对碲浸出效果的影响
浸出温度60℃、液固比4:1、盐酸浓度9.4 mol/L的条件下,浸出时间对浸出效果的影响如图4所示。由图4可知,浸出时间由30 min延长至60 min过程中,碲的浸出率由86.7%升高至97.6%,这表明60 min是氧化碲氯化浸出所必需的反应时间。进一步延长浸出时间至150 min,碲的浸出率呈现小幅度波动,由97.6%降低至97.0%。从碲浸出率及节能方面考虑,浸出时间选择60 min为宜。

Figure 4. Influence of leaching time on leaching effect
图4. 浸出时间对浸出效果的影响
3.1.3. 液固比对碲浸出效果的影响
浸出温度60℃、浸出时间60 min、盐酸浓度9.4 mol/L的条件下,液固比对浸出效果的影响如图5所示。图5显示,液固比由1:1升高到3:1的过程中,碲的浸出率由70.5%提高到97.6%;继续增大液固比,碲的浸出趋于稳定。液固比的增加,促进了固相氧化碲与液相盐酸的传质能力,有利于反应的正向进行;但液固比过大,浸出液产生量将增加,综合考虑,液固比选择3:1为宜。
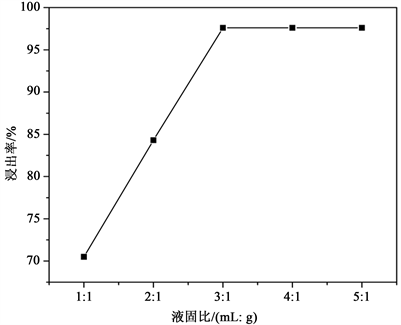
Figure 5. Influence of liquid to solid ratio on leaching effect
图5. 液固比对浸出效果的影响
3.1.4. 盐酸浓度对浸出效果的影响
浸出温度60℃、浸出时间60 min、液固比3:1、盐酸浓度对浸出效果的影响如图6所示。由图6可见,盐酸浓度由3 mol/L升高至9.4 mol/L,碲的浸出率由84.6%提高到97.6%;随着盐酸浓度进一步升高到12 mol/L,碲的浸出率基本维持不变,其原因是盐酸浓度过高,HCl挥发量增加,盐酸损失较大,氧化碲的浸出效果减弱。综上所述,盐酸浓度选择9.4 mol/L为宜。

Figure 6. Influence of hydrochloric acid concentration on leaching effect
图6. 盐酸浓度对浸出效果的影响
本实验中盐酸具有双重作用,首先其作为提取剂溶解氧化碲粉,通过过滤除去不溶性物质。氧化碲与盐酸反应生成可溶性四氯化碲如方程(2)所示,反应方程吉布斯自由能与温度函数如图7所示。
(2)
其次,盐酸中氯离子具有催化作用 [19],催化二氧化硫还原单质碲。在硫酸体系中,碲以硫酸氧碲的形式存在。
的催化作用在于改变溶液中离子的存在形态,当体系中有氯离子存在时,溶液中的碲发生如下变化 [20]:

的存在破坏了碲氧双键的稳定性,同时消除了硫酸根离子的阻隔效应,从而降低反应的活化能,有利于还原反应的进行。
3.2. 催化还原
在盐酸体系中,二氧化硫还原反应如方程(3)所示 [21]:
(3)
反应式(1)与反应式(2)的标准吉布斯自能与温度关系如图7所示。由图7可知,氧化碲的溶解以及碲的还原均是吉布斯自由能增加的反应,升高温度不利于反应正向进行,且碲的还原反应受温度影响较大。因此本实验中选择盐酸代替硫酸作为提取剂用于碲的回收。

Figure 7. Standard Gibbs free energy of reaction (1) and (2)
图7. 反应式(1)与反应式(2)的标准吉布斯自能
由上述热力学计算可知,85℃下氯离子催化二氧化硫还原单质碲的实验是可行的。因此,碲的催化还原实验在反应温度85℃,搅拌速率为300 r/min条件下通入SO2还原盐酸浸出液实现的。实验中SO2通气量为1 L/min,研究还原时间对碲还原率的影响如图8所示。
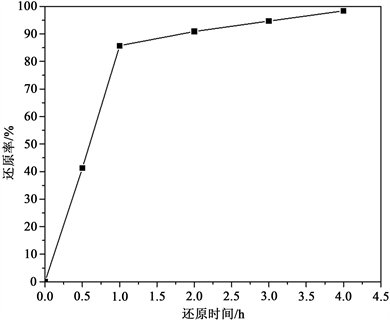
Figure 8. Influence of reaction time on tellurium reduction rate
图8. 还原时间对碲还原率的影响
由图8可知,当反应时间从0 h增加到1 h时,碲的还原率迅速增加到88.56%。随后碲的还原率增加缓慢,在4 h时达到99.9%。产生该现象的主要原因为溶液中Te4+的浓度显著降低,溶液中二氧化硫的溶解度处于饱和平衡,这会导致碲的还原速率显著降低,同时造成二氧化硫浪费。该过程同时产生盐酸和硫酸,造成还原后液pH降低,此时二氧化硫的还原电势升高不利于碲的还原,从而降低碲的还原速率。然而本实验从最佳还原率考虑,选择还原时间为4 h,其还原碲粉质量检测如表2所示,其还原碲直收率如表3所示。还原碲粉XRD和SEM图如图9所示。
由图9(a)可知,氨水洗涤后碲粉XRD衍射峰与碲的标准卡片(PDF#36-1452)完全吻合且没有其它杂峰出现,说明所得碲粉纯度高结晶性好 [22]。图9(b)为碲粉的SEM图,由图可知,碲微米颗粒形状规整约为5~10 μm,结晶性好,该结果与XRD物相结果一致。由于碲微米颗粒形状规整,说明还原过程中碲的还原结晶为连续过程,杂质硅难以进入到碲粉颗粒内部,从而容易脱出杂质硅。

Figure 9. (a) XRD pattern of refined tellurium powder; (b) SEM image of refined tellurium powder
图9. (a) 精碲粉XRD图谱;(b) 精碲粉的SEM图
由表2可知,还原碲粉中铁、钠、硫、硅杂质元素含量超过了YS/T222-2010碲锭中Te9999标准,由于碲粉粒度<100目,杂质吸附夹杂碲粉表面,可通过洗涤去除。表3显示,二氧化硫还原氧化碲浸出液,碲的还原率达到99.9%,碲的直收率为97.50%。

Table 2. Chemical composition of reductive tellurium powder
表2. 还原碲粉成分分析

Table 3. Reductive rate and recovery rate of tellurium
表3. 碲还原率及直收率
在湿法冶金过程中,特定的反应条件下,φ−pH图能直观地反应各物种稳定存在的区域和电极电位,为浸出提供热力学上的依据。Te-H2O体系中可能发生的反应及其在298.15 K下体系中各反应的φ−pH表达式如表4所示 [23]。

Table 4. Thermodynamic relations of Te-H2O system
表4. Te-H2O系的热力学关系式
图10为标准大气压温度为298.15 K时(所有物质活度均为1) Te-H2O系电位pH图,图中虚线a、b之间为水的热力学稳定区域 [24],c为SO2的φ−pH曲线。水溶液中单质Te可以稳定存在。当单质Te被还原时,不同pH条件下,还原产物不同,pH < 2.82时,Te 被还原为H2Te;2.82 < pH < 11时,Te被还原为 HTe−;11 < pH < 14时,Te被还原为Te2−。由图可知正价态的Te易被二氧化硫还原,且Te4+的还原电位高于+4的硫,然而氯离子体系中碲的还原会产生硫酸和盐酸,造成pH下降。该结果导致二氧化硫还原电势升高,+4价的硫容易被还原,不利于碲的还原。
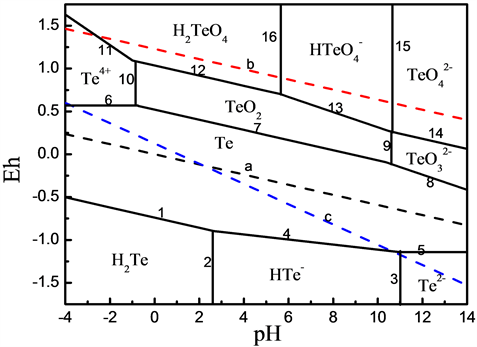
Figure 10. φ-pH diagram of Te-H2O system (1 atm, 298.15 K, a = 1)
图10. 标准大气压及298.15 K时(所有物质活度均为1) Te-H2O系电位pH图
3.3. 还原碲粉洗涤除杂
还原碲粉中硫、钠、铁等杂质是以可溶性硫酸盐形式存在,可通过水洗去除。在液固比3:1、洗涤时间20 min和洗涤4次,水洗后碲粉结果如表5所示。据表2与表5可知,水洗可以有效去除碲粉中铁和钠杂质,但杂质硫和硅仍超标。
由于还原碲粉中硅杂质主要以硅酸形式吸附在碲粉表面,选择氨水可除去部分硅。本实验研究洗涤时间、温度以及氨水浓度对杂质去除的影响,其氨水正交洗涤实验如表6所示。

Table 5. Influence of water washing and ammonia washing on tellurium quality
表5. 水洗及氨水洗涤对碲粉质量的影响
表6正交实验可知,氨水洗涤后碲粉杂质硅含量从0.0063%下降至0.00012%,硅杂质下降率98.1%,硅指标符合Te9999标准。然而氨水浓度太高,容易产生氨氮废气,综合考虑氨水最佳洗涤条件为:洗涤时间为2 h、温度45℃以及氨水浓度为1 mol/L。氨水洗涤碲粉结果如表5所示。实验结果证明还原碲粉中杂质硅主要以硅酸形式吸附在碲粉表面,碱性条件下原硅酸溶解,原硅酸以硅酸根的形式进入到溶液中被脱出。

Table 6. Experiment results on impurities removal from reductive tellurium by ammonia washing
表6. 还原碲粉氨水洗涤除杂试验结果
3.4. 铸锭
熔铸温度600℃、恒温时间60 min的条件下,铸锭结束后取样分析碲锭杂质元素含量,并与YS/T222-2010碲锭标准中Te9999比较,结果如表7所示。

Table 7. Impurity content in refined tellurium
表7. 精碲杂质含量
由表7可知,铸锭后碲锭中的杂质硫基本被除去,杂质硅含量也<0.0009%,所有杂质元素均符合YS/T222-2010碲锭标准中Te9999要求。
4. 结论
1) 最佳盐酸浸出条线下即浸出温度为60℃、浸出时间为60 min、液固比为3:1、盐酸浓度为9.4 mol/L时,碲的浸出率为97.6%。
2) 搅拌速率为300 r/min和SO2通气量为1 L/min条件下,85℃反应4 h碲的还原率达99.9%且碲的直收率为97.5%。
3) 还原碲粉中铁、钠、硅和硫等杂质分别经水洗、氨水洗涤和铸锭脱除,获得精碲产品符合YS/T222-2010标准中Te9999牌号。
基金项目
湖南省重点研发计划项目(项目名称:碱渣砷酸钠安全处置与资源化关键技术研究,项目编号:2017SK2254)。
NOTES
*通讯作者。