1. 引言
前两篇《帕米卡®制剂抗病毒抗肿瘤作用及瞻望》和《帕米卡®对几种荷瘤小白鼠的效果观察》报道了帕米卡概况、有效性、前景以及在肺癌、乳腺癌、黑色素瘤荷瘤小白鼠模型中的有效性(P < 0.05~0.0001),阐明了使用帕米卡非特异性免疫促进剂作为广谱抗肿瘤抗感染治疗的可行性 [1] [2]。本篇通过细胞生物学水平实验研究进一步揭示了帕米卡是TLR3和TLR4的激动剂,在体外能够引起非特异免疫响应显著活化对TLR3受体的敏感性,抑制肿瘤细胞增殖和转移的作用及其机理,增强了作为广谱抗癌抗病毒制剂的信心。本文实验是与中国医学科学院药物研究院及香港InvivoGen公司协作完成。
2. 材料和方法
2.1. 帕米卡TLR3、TLR4配体检测
样品:帕米卡3 mg/ml信福(北京)医药科技有限公司制备2018.01.15;细胞系:人肺癌细胞A549分化的双基因细胞(A549-dual cell)含有胚胎碱性磷酸酶(SEAP)报告基因和荧光素酶基因,二者是稳定结合的报告基因结构。HEK-Blue hTLR3细胞在A549-dual cell基础又携带人TLR3基因,携带的分泌胚胎碱性磷酸酶(SEAP)报告基因通过TLR3激动剂活化NK-kB和AP-1 (细胞内转录激活因子)产生SEAP产物和分泌荧光素酶检测活化活性;HEK-Blue hTLR4能过表达人TLR4受体蛋白和NK-kB诱发的SEAP报告基因,工作原理与HEK-Blue hTLR3细胞相同。
方法:帕米卡3 mg/ml稀释至1 mg/ml→100 µg、25 µg、6.25 µg、1.56 µg、391 ng、97.7 ng、24.4 ng、6.1 ng,从100 µg/ml开始。在96孔板中分别加入20 µl/孔试验样品或参考品,HEK-Blue Null1 hTLR3细胞、HEK-Blue hTLR4细胞约50,000细胞,总体积200 µl/孔。置37℃ 5%CO2温箱16~24小时,使用酶标仪或分光光度计在630 nm检测读取OD值。
计算:OD值﹣非诱导平均值NI,取平均值,以直方图表示。
2.2. 帕米卡在肿瘤细胞的细胞生物学作用机理研究
样品:帕米卡3 mg/ml:信福(北京)医药科技有限公司制备,批号:20171101;阳性对照药:PD1:BioXcell公司,货号BE0033-2 24MG批号:662817J3;CCK8试剂盒:Dojindo日本公司;Annexin V-FITC/PI双染法检测细胞凋亡试剂盒:Neobioscience公司;TUNEL-POD试剂盒:Leica公司。上述试剂均为分析级。LL2鼠癌细胞、A549人癌细胞:中国医学科学院基础医学研究所提供,细胞在10%胎牛血清、1%青、链霉素MEM培养液中置5%CO2 37℃孵箱内培养。
方法:
RT-qPCR (实时荧光定量PCR技术):用Invitrogen公司生产的Trizol试剂溶解帕米卡处理和未处理细胞,用DNA酶1 (Fermentas 公司)消化样品中的DNA,提取细胞RNA,经反转录酶M-MLV转录成cDNA,再以cDNA为模板,用罗氏公司的2 × TaqMix480II预混液,按照如下条件试验:95℃ 5分钟,95℃15秒→65℃30秒,经45周期,以荧光检测扩增合成目的的片段。TLR3引物为:5’-CCAGACCTAGC ACAACTGACTCC-3’ (forward) and 5’-AGCAGCCAGAAGCAGAACTACAGA-3’ (reverse); β-actin, 5’-GA GATTACTGCTCTGGCTCCTA-3’ (forward) and 5’-GGACTCATCGTACTCCTGCTTG-3’ (reverse) [3],通过三次重复试验分析qPCR产物。该技术是在反应体系中加入荧光集团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析。
细胞活性试验:LL2细胞以7 × 103/孔、A549细胞以5 × 103/孔,加入96孔板中,培养液为10%胎牛血清DMEM,置37℃孵箱24小时,换液加入不同浓度的帕米卡及设对照组和空白孔,继续置37℃孵箱24、48小时后所有细胞孔换入含10%CCK8试剂(Dojindo日本公司)的无血清维持液,在黑暗处孵育2小时,分别在450和650 nm通过微板阅读器(美国BioTek公司)读取OD值,细胞存活% = OD试验值 − OD空白值/(OD对照值 − OD空白值) × 100%。
单层细胞增殖试验:LL2细胞、A549细胞以5 × 104/孔,加入6孔板中,培养液为10%胎牛血清DMEM,置37℃孵箱24小时,换液加入帕米卡100 µg/ml和不加帕米卡的无血清MEM维持液,继续置37℃孵箱48小时后每24小时测定细胞总数。每孔收集细胞用台酚蓝(美国Solarbio公司)染色,用血细胞仪计数比较。
Annexin V和PI双染色法定量检测细胞凋亡试验:LL2细胞、A549细胞以1 × 105/孔加入6孔板中,培养液为10%胎牛血清DMEM,置37℃孵箱24小时,换液加入帕米卡100 µg/ml无血清MEM维持液,同时设不加帕米卡对照组继续置37℃孵箱48小时,收集细胞,用冷PBS洗2次,用结合缓冲液重悬浮细胞,用Annexin V和PI双染色法标记细胞(试剂盒,欣博盛科技公司,中国),细胞凋亡通过美国BD公司流式细胞仪和细胞寻找软件(Cell Quest Software)分析。
细胞分裂周期分析试验:LL2细胞、A549细胞以1 × 105/孔接种在6孔板中,培养液为10%胎牛血清DMEM,置37℃孵箱24小时,换液加入帕米卡100 µg/ml无血清MEM维持液和DMEM孔作为对照,继续置37℃孵箱48小时,收集细胞,置75%乙醇中−20℃ 24小时,用冷PBS洗2次,加入100 µlRNA酶(美国Solarbio公司)重悬浮细胞,37℃水浴30分钟,所有细胞用400 µl PI试剂(美国Solarbio公司)标记,置4℃黑暗处30分钟,用流式细胞仪(美国BD公司)在波长488 nm检测红色荧光。
细胞划痕试验:当细胞长成单层时,在融合的单层上人为制造一个空白区域,称为划痕,划痕边缘的细胞会逐渐进入空白区域使划痕愈合,模拟了体内细胞迁移过程,以研究细胞迁移的体外实验方法。分别将约5 × 104 LL2细胞、A549细胞/孔接种到12孔板中,置37℃ CO2温箱培养24小时,成片的细胞用200 µl枪头划痕,PBS冲洗2次。设加入帕米卡100 µg/ml实验组和未加帕米卡对照组,于0、24、48小时捕获划痕位置,用映像软件测量缝隙距离。
细胞迁移小室试验:LL2细胞、A549细胞分别加入帕米卡100 µg/ml无血清MEM维持液试验组和仅加MEM维持液对照组,置37℃孵箱培养48小时,收集细胞,用无血清MEM悬浮细胞,加入5 × 104细胞/孔至含有嵌入物的24孔膜板(3422 美国康宁公司)即细胞迁移小室中,同时在小室膜板下方加10%胎牛血清作为诱导剂孵育24小时。除去小室膜上未迁移细胞,无水甲醛固定迁移至小室膜下细胞,用结晶紫在暗处染色30分钟,在显微镜下对不同视野拍照。迁移率(%) = (A样品 − A空白/A对照 − A空白) × 100%
侵袭试验:用无血清MEM1:5稀释基质凝胶加入到上述细胞迁移小室,置37℃孵箱培养过夜。定量测定方法:用33%乙酸溶解结晶紫染色的细胞,在分光光度计570 nm处测定OD值,结果帕米卡处理与未处理的LL2细胞、帕米卡处理与未处理的A549细胞比较。侵袭率 = (A样品 − A空白/A对照 − A空白) × 100%。
3. 实验结果
3.1. 帕米卡是具有强烈作用的hTLR3激动剂
HEK-Blue hTLR3是A549 (人肺癌细胞)携带人TLR3和SEAP报告基因与荧光素酶的HEK-Blue Null1细胞。图1结果表明帕米卡能通过激活NK-kB和AP-1通路引起HEK-Blue hTLR3细胞激活的分泌碱性磷酸酶的SEAP报告基因和通过激活干扰素调节因子基因分泌荧光素酶,检测效果优于阳性对照药Poly(I:C) HMV。证明帕米卡是具有较阳性对照药更强烈作用的hTLR3激动剂。

Figure 1. Effect of action of Pamica and Poly(I:C) HMV (positive control drug) in HEK-Blue hTLR3 cells
图1. 阳性对照药Poly(I:C) HMV和帕米卡在HEK-Blue hTLR3细胞作用效果
3.2. 帕米卡也是hTLR4激动剂
HEK-Blue hTLR4细胞是A549细胞携带人TLR4基因和SEAP报告基因与荧光素酶的HEK-Blue Null2细胞,图2结果表明帕米卡能通过NK-kB和AP-1信号传导也能引起HEK-Blue hTLR4细胞分泌碱性磷酸酶的SEAP报告基因和干扰素调节因子基因分泌荧光素酶,效果不如阳性对照药脂多糖,但优于Poly(I:C) HMV,表明帕米卡也是hTLR4激动剂。

Figure 2. Effect of action of Pamica and LPS-EK (positive control drugs), Poly(I:C) HMV in HEK-Blue hTLR4 cells
图2. 阳性对照药脂多糖及Poly(I:C) HMV和帕米卡在HEK-Blue hTLR4细胞作用效果
3.3. RT-QPCR(实时荧光定量PCR)分析
在PCR反应体系中加入荧光基团,利用荧光信号累积实时检测整个PCR进程,最后通过标准曲线对未知模板进行定量分析,将RNA的反转录和c DNA的聚合酶链式扩增相结合检测细胞中基因表达水平。用对起始模板定量分析方法检测帕米卡在体外对LL-2和A549细胞TLR3的扩增。图3结果表明RT-QPCR检测帕米卡经24、48小时处理细胞后上调A549人癌细胞TLR3 mRNA含量,从1.26至1.52,P < 0.01;上调LL/2鼠癌细胞TLR3 mRNA含量,从0.90至1.37,P < 0.001,极其显著地促进细胞TLR3 mRNA,表明帕米卡对TLR3受体具有极其显著的敏感性。
3.4. 帕米卡在体外抑制LL-2和A549 细胞增殖
用CCK8试剂按照细胞存活试验方法检测,图4表明帕米卡经24、48小时以不同剂量处理细胞,24小时抑制LL/2细胞存活数20%,抑制A549细胞数13%,均P < 0.01;48小时抑制LL/2鼠癌细胞存活数52%~67%,抑制A549人癌细胞数45%~61%,P < 0.001,显示帕米卡能极其显著地抑制肿瘤细胞存活率,而剂量依赖性不明显。本文有关研究均采用帕米卡剂量为100 µg/ml。
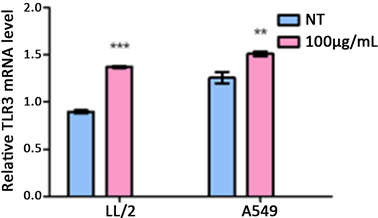 X ± S, N = 3, **P < 0.01, ***P < 0.001
X ± S, N = 3, **P < 0.01, ***P < 0.001
Figure 3. RT-QPCR analysis of TLR3 mRNA levels in LL-2 and A549 cells treated by Pamica in vitro
图3. 实时荧光定量PCR分析帕米卡在体外对LL-2和A549 细胞TLR3 mRNA水平的影响
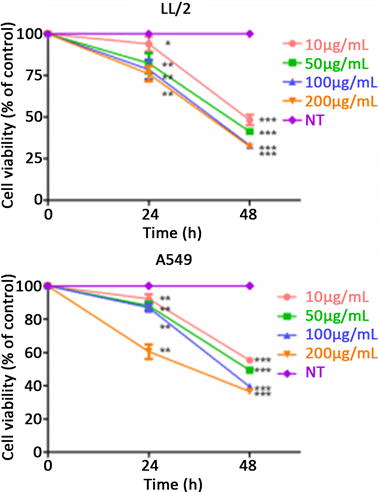 X ± S, N = 4, *P < 0.05, **P < 0.01, ***P < 0.001
X ± S, N = 4, *P < 0.05, **P < 0.01, ***P < 0.001
Figure 4. Viability of A549 and LL/2 cells treated by Pamica with different concentrations (10, 50, 100, 200 µg/ml)
图4. 不同剂量帕米卡(10, 50, 100, 200 µg/ml)经24、48小时处理对A549和LL/2细胞存活率的影响
用测定细胞数的方法进一步检测帕米卡抑制癌细胞的作用:用单层细胞增殖试验方法收集细胞,用台酚蓝染色计算细胞数。图5表明帕米卡经24处理、降低LL/2细胞总数至1.47倍,降低A549细胞总数至1.24倍;经48小时处理细胞后,降低LL/2细胞总数2.07倍,降低A549细胞总数2.07倍,均P < 0.01,表明帕米卡能显著地减少肿瘤细胞数。
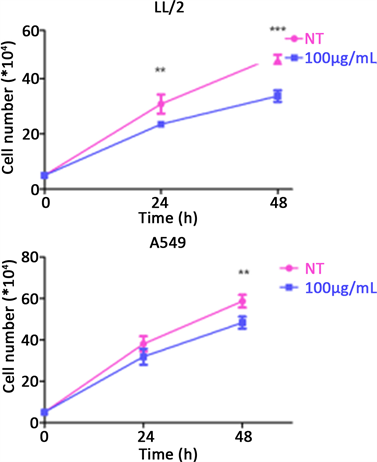 X ± S, N = 3,**P < 0.01, ***P < 0.001
X ± S, N = 3,**P < 0.01, ***P < 0.001
Figure 5. Total cell number of A549 and LL/2 cells treated by Pamica with 24, 48 hours
图5. 帕米卡处理24、48小时对降低LL/2和A549细胞总数的影响
3.5. 帕米卡对LL/2和A549细胞凋亡及细胞分裂周期的影响
用Annexin V和PI双染色法定量检测帕米卡对LL/2和A549细胞凋亡及分裂周期的影响。图6表明帕米卡处理48小时后细胞凋亡率LL/2细胞为11.43% ± 0.46%,对照组为2.73% ± 0.61,A549细胞20.04% ± 0.85%,对照组为0.13% ± 0.06%,统计学测定均P < 0.001。
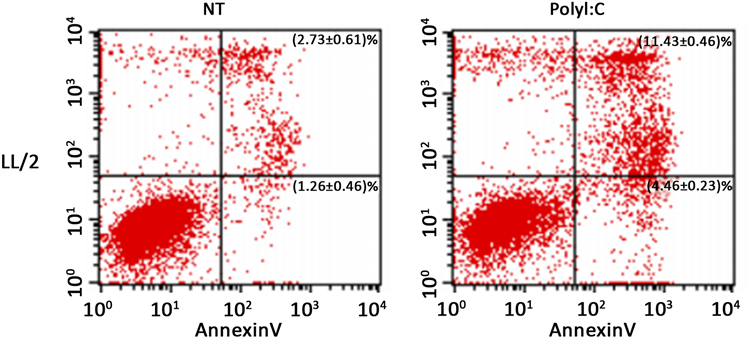
 Data are expressed as ± S, n = 3
Data are expressed as ± S, n = 3
Figure 6. Apoptosis of LL/2 and A549 cells were quantificationally determined with Annexin V/PI staining assay after 48 hours administrated with Pamica
图6. 用Annexin V和PI双染色法定量检测帕米卡处理48小时后对LL/2和A549细胞分裂周期及凋亡的影响(±S, n = 3)

Figure 7. Influence of Cell cycle of LL/2 and A549 cells were analyzed by flow cytometry after 48 hours administrated with Pamica. Data are expressed as ±S, n = 3
图7. 用流式细胞仪分析帕米卡处理LL/2和A549细胞48小时后对细胞分裂周期的影响(±S, n = 3)
为了进一步观察帕米卡是如何影响细胞分裂周期,通过PI染色,用流式细胞仪分析,如图7所示,表明帕米卡处理48小时后LL/2细胞积聚在G1期,而在S和G2期显著降低,抑制总率32.01% ± 0.09%,对照组为17.11% ± 1.12% P < 0.001;A549细胞抑制总率55.16% ± 0.97%,对照组为46.52% ± 0.58% P < 0.001。表明帕米卡极其显著地抑制了细胞在G1期继续分裂,引起细胞凋亡降低了细胞增殖。
3.6. 帕米卡对LL/2和A549细胞转移的影响
下述两项试验从细胞横向和竖向移动试验显示帕米卡抗肿瘤转移效果。文献报道肿瘤细胞在体外的移动和侵袭表明可引起肿瘤的转移 [3]。
3.6.1. 细胞划痕伤口愈合试验
图8划痕试验表明A549对照组细胞几乎完全愈合,但LL/2细胞愈合不明显,表明A549细胞具有
 Data are expressed as ±S, n = 3 * P 0.05, ** P 0.01
Data are expressed as ±S, n = 3 * P 0.05, ** P 0.01
Figure 8. Cell motility measured using wound healing assay after 48 hours administrated Pamica treated and non-treated cell wound area were compared (magnification: ×200)
图8. 帕米卡通过48小时比较对处理与未处理LL/2和A549细胞划痕域运动的作用(图片放大200倍)
较好的转移性质。帕米卡处理LL/2细胞48小时后,划痕域LL/2细胞从1,673,025 µm2减少至902,610 µm2,对照组从1,714,904 µm2减少至749,944 µm2,统计学测定帕米卡处理24小时P < 0.05,处理48小时P < 0.01;帕米卡处理A549细胞48小时后划痕域从1,067,701 µm2减少至525,084 µm2,对照组从1,166,710 µm2减少至363,945 µm2,帕米卡处理A549细胞24和48小时,均P < 0.01。表明帕米卡处理的细胞明显降低了细胞的移动。
3.6.2. 细胞迁移小室和细胞侵袭试验
这两项试验检测帕米卡抑制LL/2和A549细胞纵向移动的作用。图9的左边图表明上述细胞能跨过迁移小室膜,移至小室膜外的作用,在对照组细胞100%未移动下,帕米卡抑制LL/2细胞跨膜移动作用是对照组的85.80% ± 3.31%;帕米卡抑制A549人癌细胞跨膜移动作用是对照组的82.96% ± 1.27%,统计学测定均P < 0.01。
帕米卡抑制肿瘤细胞的侵袭试验即在细胞迁移小室底部加入基底膜胶观察细胞的侵袭能力。图9的右边图表明在对照组细胞100%未有侵袭作用下,帕米卡降低LL/2细胞侵袭至对照组的58.09% ± 1.34%;降低A549人癌细胞的侵袭至对照组的82.26% ± 2.24%,统计学测定均P < 0.01。
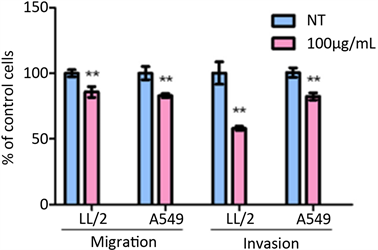
Figure 9. The influence of transwell migration and invasion of LL/2 and A549 cells treated with Pamica (*P < 0.05, **P < 0.01)
图9. 帕米卡对LL/2和A549细胞移动和侵袭作用的影响(*P < 0.05, **P < 0.01)
4. 讨论
癌细胞具有不死性、迁移性和失去接触抑制性,其细胞分裂周期失控不受正常生长调控系统的控制,能持续地分裂与增殖,尤其具有局部移动、浸润和远处转移能力是致人死地最重要的生物学特性。本篇研究揭示帕米卡极其显著有效地抗击肿瘤这些特性:
1) 帕米卡能显著抑制肿瘤细胞存活数及细胞总数:通过CCk8试剂盒细胞活性检测表明帕米卡显著降低肿瘤细胞存活率,通过单层细胞增殖用台酚蓝染色细胞计数也表明帕米卡显著抑制肿瘤细胞总数,克服了肿瘤细胞无限增殖的问题。
2) 帕米卡对肿瘤细胞分裂周期的影响试验证明帕米卡能促进LL/2和A549细胞凋亡,统计学测定P < 0.001;又进一步通过染色经流式细胞仪分析,表明帕米卡能封闭LL/2和A549人细胞在G1期继续分裂,统计学测定P < 0.001,表明帕米卡是封闭了肿瘤细胞在G1期继续分裂引起细胞凋亡,抑制了细胞增殖。进一步揭示了帕米卡能够减少肿瘤细胞、缩小肿瘤体积和抑制了肿瘤细胞无限增殖的作用机理。
3) 帕米卡阻碍肿瘤细胞移动和侵袭试验是从肿瘤细胞横向和竖向移动和侵袭证实了帕米卡具有阻碍肿瘤细胞移动、侵袭。文献报道肿瘤细胞在体外的移动和侵袭可引起体内肿瘤的转移 [4]。在前篇荷瘤小白鼠试验中,帕米卡体内阻止肿瘤转移效果优于传统化疗药紫杉醇和靶向药PD-1 [2],这一作用是十分重要的,因为移动和侵袭而致转移是肿瘤细胞最重要特征,90%肿瘤患者死亡是由于肿瘤转移造成的。
4) 试验证实帕米卡是TLR3、4受体的激动剂。本试验是通过激活HEK-Blue hTLR3和HEK-Blue hTLR4细胞NF-kB和A1信号通路证实证实帕米卡是TLR3、4膜式识别受体的配体。由此,不仅证实了帕米卡是TLR3、4受体的配体,也证明了帕米卡与TLR3、4受体结合后激活了NF-kB和A1 (蛋白激酶-1,activator protein 1, AP-1)信号通路,该通路在调节抗肿瘤抗感染的免疫应答中促进巨噬细胞、NK细胞、T细胞功能特别倾向诱导肿瘤细胞发生凋亡,并诱生IFNα、IFNβ、IFNY、TNFα、白细胞介素等细胞因子的分泌,引起一系列促进非特异性免疫的效果。文献也报道NF-κB和A1等的活化,具有发挥抗病毒抗肿瘤作用 [5] [6]。Bruce BA [7] 和Hoffmann JA [8] 发现TLRs膜式识别受体可以与微生物基本成分结合活化非特异性免疫而获得2011年诺贝尔生理学和医学奖。该试验奠定了帕米卡作用机理的基础。
5) RT-qPCR试验(实时荧光定量PCR技术)证实帕米卡上调A549人癌细胞和LL/2鼠癌细胞TLR3 mRNA,统计学测定P < 0.01~0.001,该结果显示的是帕米卡对TLR3的启动具有极其显著的基因敏感性,这是帕米卡又一重要特性,因为在治疗中需要机体对药物反应的高度敏感性才能达到治疗目的。另外,TLR3广泛存在于上皮细胞和树突状细胞里,还存在NK、T、巨噬细胞中,也在几种肿瘤细胞中表达,有文献报道肿瘤细胞TLRs携带肿瘤抗原,可唤起初次抗肿瘤免疫反应 [9],又通过去除肿瘤抗原防止形成炎性肿瘤环境 [10]。结合上一条试验结果表明帕米卡在具有刺激机体细胞水平的免疫力效果基础上又进一步扩大了作为TLR3受体的敏感性,则进一步说明了帕米卡抗肿瘤抗病毒的作用机理。
6) 本试验所使用的细胞包括LL/2鼠癌细胞、A549人癌细胞包括转基因细胞HEK-Blue hTLR3细胞、HEK-Blue hTLR4细胞,再次证明帕米卡具有广谱抗肿瘤抗病毒效果。
2020.12.28中国新闻网报道:六国出现七种新冠变异病毒,全人类或许到了最凶险的时候。提到只要疫情得不到控制,全球将会变成巨大的病毒培养皿,病毒不断变异,不断有新的亚型诞生。笔者大胆提出不管病毒如何变异提高机体系统非特异性的免疫制剂也许就是当前治疗新冠病毒变异的一条出路。
帕米卡细胞生物学作用机理的研究确定了帕米卡是TLR3、4的配体,确定了能激活Nk-B和A1信号传导通路、确定了具有激活TLR3受体的高度敏感性,确定了促进肿瘤细胞的凋亡降低细胞数、确定了使肿瘤细胞在G1间期降低继续分裂、确定了减少肿瘤细胞移动和侵袭从而抑制了肿瘤细胞的转移。帕米卡在这抗肿瘤这些关键处都给予了肯定回答并具有极其显著的效果,特别是这种效果是非特异的而具有重要的现实意义,进一步增强了用非特异性免疫促进剂开启抗病毒抗肿瘤治疗性革命大门的信心和希望。