摘要:
目的:探究人参皂苷Rb1对糖尿病雄性大鼠心脏结构与功能和心肌纤维化的作用。方法:将24只大鼠随机分为对照组、糖尿病组、糖尿病 + 10 mg/kg Rb1组和糖尿病 + 20 mg/kg Rb1组,通过腹腔注射链脲佐菌素(streptozotocin, STZ)构建糖尿病大鼠模型。糖尿病 + 10 mg/kg Rb1组和糖尿病 + 20 mg/kg Rb1组每天分别腹腔注射10 mg/kg与20 mg/kg的Rb1,持续8周。8周后麻醉大鼠,采用超声心动图测量左室结构和功能参数,测血清血脂、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白介素-6 (interleukin-6, IL-6)和脑钠肽(brain natriuretic peptide, BNP)水平。取大鼠心脏测量左心室重量指数(left ventricular weight index, LVWI)、单位质量心肌组织中羟脯氨酸与胶原蛋白含量、心肌胶原容积分数(collagen volume fraction, CVF)。结果:STZ处理后大鼠血糖均高于16.7 mmol/L,模型构建成功。与对照组相比,糖尿病大鼠组心脏结构和功能参数无显著性改变,而血清TNF-α、IL-6、BNP水平显著性升高,而20 mg/kg人参皂苷Rb1能够降低TNF-α、IL-6和BNP水平,差异有显著性意义(P < 0.05)。糖尿病大鼠LVWI、单位质量心肌组织中羟脯酸与胶原蛋白含量、心肌中CVF显著性增高(P < 0.05)。人参皂苷Rb1能显著降低LVWI、单位质量心肌组织中羟脯氨酸与胶原蛋白含量、心肌中CVF。结论:人参皂苷Rb1具有减轻炎症反应和心肌纤维化、延缓糖尿病心肌病发生发展的作用。
Abstract:
AIM: To investigate the effects of ginsenoside Rb1 on cardiac structure, function and myocardial fibrosis in diabetes rats. METHODS: 24 rats were randomly divided into 4 groups: the control group, the diabetes group, the diabetes + 10 mg/kg Rb1 group and the diabetes + 20 mg/kg Rb1 group. The diabetes rats model was constructed by intraperitoneal injection of streptozotocin (STZ). Intraperitoneal injections of 10 mg/kg and 20 mg/kg Rb1 were administered daily for 8 weeks in the diabetes + 10 mg/kg group and diabetes + 20 mg/kg Rb1 group, respectively. Left ventricular structure and function were measured by echocardiography, and tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), brain natriuretic peptide (BNP) were measured by ELISA. Left ventricular weight index (LVWI), hydroxyproline and collagen content per unit mass in myocardial tissue, and collagen volume fraction (CVF) in myocardium were measured. RESULTS: After intraperitoneal injection of STZ, the blood glucose of rats was higher than 16.7 mmol/L, and the diabetes model was constructed successfully. Compared with the control group, cardiac structure and function parameters did not changed significantly, but serum TNF-α, IL-6 and BNP levels were higher in the diabetes rat groups, and Ginsenoside Rb1 20 mg/kg can reduce their levels significantly (P < 0.05). LVWI, hydroxyproline and collagen content per unit mass myocardial tissue, CVF in myocardium of diabetes rats were increased significantly (P < 0.05). Ginsenoside Rb1 significantly reduced LVWI, hydroxyproline acid and collagen content per unit mass in myocardial tissue, and CVF in myocardium (P < 0.05). CONCLUSION: Ginsenoside Rb1 can alleviate the inflammation and myocardial fibrosis of diabetes rats, and delay the occurrence and development of diabetic cardiomyopathy.
1. 引言
糖尿病心肌病(DCM)是一类发生于糖尿病患者,无冠状动脉疾病、高血压病及瓣膜病的心肌疾病 [1]。DCM患者可出现左室射血时间缩短,充盈末期心室压力升高,左室壁僵硬,心收缩力减弱,以及等容舒张时间延长等一系列异常表现 [2]。其发病机制尚未被完全阐明,可能的机制包括炎症反应、氧化应激、心肌细胞凋亡等 [3] [4]。糖尿病出现明显心肌纤维化主要发生在DCM晚期,是心肌组织成纤维细胞过度增生从而导致细胞外基质大量沉积所致 [5]。
人参皂苷Rb1是人参中提取的二醇类皂苷,具有调节氧化应激、炎症反应、自噬和抗凋亡作用 [6]。Hou Y等 [7] 的研究发现人参皂苷Rb1降低肝脏中的肿瘤坏死因子α (TNF-α)、前列腺素E2 (PGE2)、羟脯氨酸、金属蛋白酶组织抑制因子1 (TIMP-1)的水平,抑制四氯化碳(CCL4)诱导的大鼠肝纤维化。Zheng X等 [8] 的研究发现人参皂苷Rb1通过抑制TGF-β1/Smad和ERK通路,减轻心力衰竭大鼠的心肌纤维化。目前尚无相关研究证实人参皂苷Rb1是否可减轻糖尿病大鼠的心肌纤维化,进而预防糖尿病心肌病的发生与发展。本研究拟通过在链脲佐菌素(STZ)诱导的糖尿病大鼠腹腔中注射人参皂苷Rb1,探究人参皂苷Rb1减轻糖尿病大鼠炎症反应和心肌纤维化的作用。
2. 材料和方法
2.1. 材料
5~6周龄SPF级SD雄性大鼠,购自广东省动物中心。本动物实验方案经过中山大学实验动物伦理委员会审核符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理的相关规定(动物实验伦理批号为:SYSU-IACUC-2018-000173)。实验严格按照《中华人民共和国实验动物管理条例》《实验动物质量管理方法》进行。人参皂苷Rb1购自成都普菲德公司。TNF-α、IL-6、BNP ELISA试剂盒和羟脯氨酸试剂购自南京建成生物工程研究所。
2.2. 方法
2.2.1. 构建糖尿病大鼠模型及分组
24只SD雄性大鼠,按随机数字表随机分为对照(Control)组、糖尿病(DM)组、糖尿病 + 10 mg/kg Rb1 (DM + 10 mg/kg Rb1)组和糖尿病 + 20 mg/kg Rb1 (DM + 20 mg/kg Rb1)组,每组6只。除对照组外,其他组的大鼠空腹12 h后腹腔注射STZ (40 mg/kg)。1周后断尾取血测量血糖,空腹血糖大于16.7 mmol/L,且出现糖尿病症状(多饮、多食、多尿),视作糖尿病模型建立成功,对照组注射等量生理盐水。模型建立成功后DM + 10 mg/kg Rb1组和DM + 20 mg/kg Rb1组每天分别腹腔注射10 mg/kg Rb1与20 mg/kg Rb1,持续8周。
2.2.2. 大鼠心脏超声检查
采用高分辨率超声诊断仪(FUJIFILM公司),探头频率30 MHz。第8周后行经胸超声检查。乙醚麻醉大鼠,取左室长轴切面和乳头肌水平短轴切面,测量左室内径、每搏量、心输出量、左室收缩末容积、左室舒张末容积、射血分数、缩短分数等参数。
2.2.3. 测量血脂和肿瘤坏死死因子-α、白介素-6和脑钠肽
采用ELISA法测定血清肿瘤坏死因子-α (TNF-α)、白介素-6 (IL-6)、脑钠肽(BNP),生化法测定甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)水平。
2.2.4. 计算左心室重量指数
注射人参皂苷Rb1 8周后处死大鼠,取大鼠心脏称重并称量左心室重量,计算左心室重量指数(LVWI),LVWI = 左室重量 ÷ 体重 × 100% [9]。待提取蛋白重量的心脏组织放入液氮中保存,送病理的心脏组织泡入4%多聚甲醛中后续送包埋与切片。
2.2.5. 测量心肌羟脯氨酸
用比色法测定心肌组织中羟脯氨酸含量。60 mg心肌组织加水解液1 ml,沸水浴水解。氯氨T试剂氧化,Ehrlich’s试剂在60℃水浴孵育,550 nm下分光光度法测定显色产物。按羟脯氨酸占胶原蛋白13.4%计算出胶原蛋白含量。
2.2.6. 测量心肌胶原容积分数
取固定于4%多聚甲醛中的心肌组织,脱水至透明后石蜡包埋,切成厚度约6 mm的组织切片,脱蜡后分别用苏木素、伊红染液染色以及Masson染色,最后再次脱水,中性树脂封片,显微镜下观察。用Image J打开Masson染色图片,计算被染为蓝色的胶原纤维部分占总面积的比例,即得出胶原容积分数(Collagen Volume Fraction, CVF)。
3. 结果
3.1. STZ诱导建立糖尿病大鼠模型
为验证STZ能否成功建立糖尿病大鼠模型,注射1周断尾取血测定各大鼠随机血糖,并定期测量大鼠体重。实验结果如图1和图2所示。STZ处理后大鼠血糖均高于16.7 mmol/L,对照组大鼠血糖没有高于16.7 mmol/L。注射STZ后大鼠体重较对照组显著性降低,人参皂苷Rb1对大鼠体重无显著性影响(P > 0.05)。
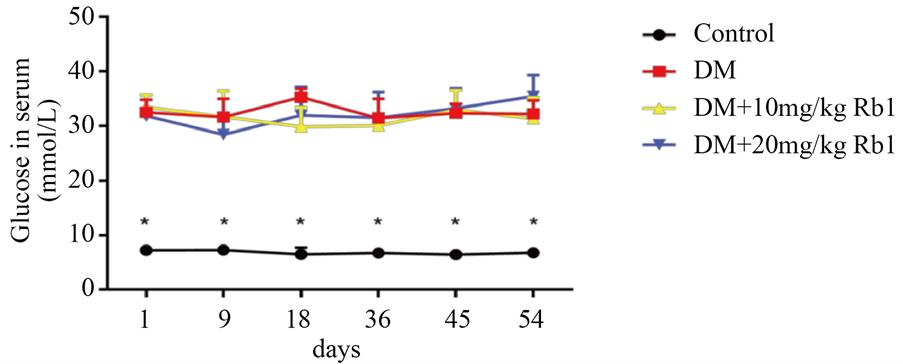
Figure 1. Comparison of the blood glucose in rats from each group (Mean ± SD. n = 6. *P < 0.05 vs Control group)
图1. 各组大鼠血糖比较(
± s. n = 6. *P < 0.05 vs Control group)
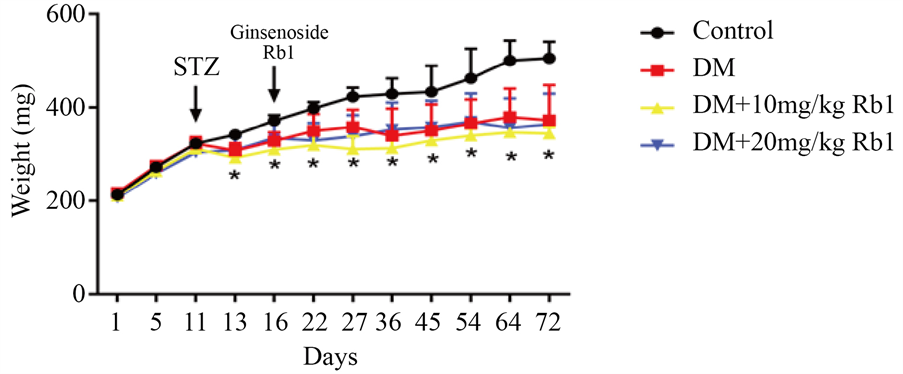
Figure 2. Comparison of the body weight in rats from each group (Mean ± SD. n = 6. *P < 0.05 vs Control group)
图2. 各组大鼠体重比较(
± s. n = 6. *P < 0.05 vs Control group)
3.2. 人参皂苷Rb1对糖尿病大鼠血清TG、LDL-C、TNF-α、IL-6和BNP的影响
四组大鼠血清TG、LDL-C、TNF-α、IL-6和BNP测定结果见表1。结果显示:与对照组比较,糖尿病大鼠组血清TNF-α、IL-6、BNP水平显著升高,而人参皂苷Rb1 (20 mg/kg)组可以降低TNF-α、IL-6和BNP水平,差异有显著性意义(P < 0.05)。

Table 1. Comparison of the serum TG, LDL-C, TNF-α, IL-6 and BNP levels in rats from each group (Mean ± SD, n = 6)
表1. 各组血清TG、LDL-C、TNF-α、IL-6和BNP的比较(
± s,n = 6)
*P < 0.05 vs Control group; **P < 0.05 vs DM group.
3.3. 人参皂苷Rb1对糖尿病大鼠心脏结构和功能的影响
为探讨人参皂苷Rb1对糖尿病大鼠心脏结构和功能的影响,人参皂苷Rb1连续处理8周后,大鼠行气体麻醉行心脏超声检测。结果如表2所示,人参皂苷Rb1 (20 mg/kg)组有改善糖尿病大鼠左心功能的趋势,但差异未达统计学意义(P > 0.05)。

Table 2. Effects of Ginsenoside Rb1 on cardiac structure and function in diabetes rats (Mean ± SD, n = 6)
表2. 人参皂苷Rb1对糖尿病大鼠心脏结构和功能的影响(
± s,n = 6)
P > 0.05 for all.
3.4. 人参皂苷Rb1降低糖尿病大鼠心脏LVWI、羟脯氨酸与胶原纤维含量
实验结果如表3所示,与对照组相比,糖尿病大鼠中LVWI、单位质量心肌组织中羟脯氨酸与胶原蛋白含量显著增高,人参皂苷Rb1 (20 mg/kg)显著降低糖尿病大鼠LVWI,而人参皂苷Rb1 (10 mg/kg)组和人参皂苷Rb1 (20 mg/kg)均可显著降低单位质量心肌组织中羟脯氨酸与胶原蛋白的含量。

Table 3. Effects of Ginsenoside Rb1 on LVWI, hydroxyproline and collagen in diabetes rats (Mean ± SD, n = 6)
表3. GRb1对糖尿病大鼠LVWI、羟脯氨酸与胶原纤维含量影响(
± s,n = 6)
aP < 0.05 vs Control group; bP < 0.05 vs DM group; cP < 0.05 vs DM + 10 mg/kg Rb1 group.
3.5. 人参皂苷Rb1降低糖尿病大鼠心肌中胶原容积分数
Masson染色和胶原容积分数(collagen volume fraction, CVF)测定结果如图3和图4所示,糖尿病大鼠心肌中CVF显著高于对照组,而10mg/kg与20mg/kg剂量的人参皂苷Rb1均可降低糖尿病大鼠心肌CVF。

Figure 3. HE and Masson staining for Morphological characteristics of cardiac and collagen fibers (HE and Masson staining, ×400)
图3. HE染色与Masson染色观察心肌组织形态和胶原纤维(HE染色与Masson染色, ×400)

Figure 4. Cardiac CVF in rats from each group (Mean ± SD. n = 6. *P < 0.05 vs Control group; **P < 0.05 vs DM group)
图4. 各组大鼠心肌CVF (
± s. n = 6. *P < 0.05 vs Control group; **P < 0.05 vs DM group)
4. 讨论
本研究探索了人参皂苷Rb1对糖尿病大鼠心脏结构功能、炎症反应和心肌纤维化的影响。结果显示:糖尿病大鼠血清TNF-α、IL-6和BNP水平显著性升高,LVWI、单位质量心肌组织中羟脯氨酸与胶原蛋白含量、心肌中CVF显著增高,提示持续高糖状态可诱发炎症反应,导致心肌纤维化,进而引起糖尿病心肌病。与对照组相比,人参皂苷Rb1可以显著降低TNF-α、IL-6和BNP水平,可以减轻炎症反应;显著降低LVWI、单位质量心肌组织中羟脯氨酸与胶原蛋白含量、心肌中CVF,提示人参皂苷Rb1可以减轻炎症反应、抗心肌纤维化,具有延缓糖尿病心肌病发生发展的作用。本研究超声心动图检查显示人参皂苷Rb1有改善糖尿病大鼠左心功能的趋势,但差异未达统计学显著性意义,考虑可能与干预时间偏短有关。临床研究发现 [10] [11],人参皂苷Rb1不仅可减轻糖尿病患者的体重、血脂水平和高凝血状态,而且可延缓糖尿病心脏病的发生,包括微血管病变、心肌损伤和心脏自主神经病变。
糖尿病心肌病的发病机制错综复杂,主要有糖脂代谢异常、炎症反应、氧化应激、细胞凋亡、血管活性因子异常以及神经内分泌等因素的参与,众多因素互相影响,相互促进疾病的产生。众多的心肌疾病之间有着类似的病理生理改变与分子机制,同一条通路也可以参与不同心肌疾病的发生,但发挥功能的侧重点各有不同 [12]。人参皂苷Rb1可以减轻糖尿病大鼠缺血/再灌注损伤,减少心肌梗死面积、降低磷酸激酶和乳酸脱氢酶,增加eNOS的表达和NO浓度 [13],以及减少心肌细胞凋亡和caspase-3活性 [14]。另有研究显示人参皂苷Rb1可通过降低肝细胞焦亡相关因子的表达,从而减轻高脂血症大鼠肝脏损伤和脂质沉积 [15]。我们的研究 [16] 证实了人参皂苷Rb1对高糖损伤的H9C2细胞,可下调NF-κB乙酰化水平,以及上调SIRT1水平。首次在细胞水平证明了人参皂苷Rb1可通过SIRT1/NF-κB通路对高糖损伤的H9C2细胞起到抗炎、抗凋亡的作用,显示了其对糖尿病大鼠心肌的保护作用。
总之,糖尿病大鼠存在显著的炎症反应和心肌纤维化。人参皂苷Rb1可以降低炎症反应、降低BNP,显著降低LVWI、单位质量心肌组织中羟脯氨酸与胶原蛋白含量和心肌CVF,提示人参皂苷Rb1具有减轻炎症和心肌纤维化,延缓糖尿病心肌病发生、发展的作用。
基金项目
广东省自然科学基金(No. 2016A030313841)。
NOTES
*通讯作者。