1. 前言
脓毒症是指因感染引起宿主反应失调而导致危及生命的器官功能障碍,可发展为脓毒性休克和多器官功能障碍综合征,具有比较高的病死率 [1]。近年来,随着广谱抗生素、皮质类固醇激素、免疫抑制剂的广泛使用,器官移植及心导管手术的开展,白念珠菌脓毒症已成为重要的院内感染 [2] [3] [4]。炎症小体(Inflammasome)通过模式识别受体(pattern recognition receptor, PRR)识别病原微生物或者宿主来源的危险信号分子 [5],经活化后介导下游通路的炎症因子表达来调控炎症反应,广泛参与机体炎症反应和免疫应答,属于机体的固有免疫。目前研究最深入的炎症小体是Nod样受体蛋白3 [nucleotide-binding domain (NOD)-like receptor protein 3, NLRP3],在机体多种炎症反应中起重要作用 [6],已有研究报道多聚集在细菌性感染,在白念珠菌感染中的作用研究尚少。因此,本研究拟通过建立白念珠菌脓毒症小鼠模型来探讨NLRP3炎性小体在念珠菌所致的脓毒症发病过程中的作用。
2. 材料与方法
2.1. 实验材料
2.1.1. 实验菌株和动物
白念珠菌标准菌株ATCC10231和SPF级C57BL/6雄性小鼠100只(20~25 g,6~8周)分别购买于上海鲁微科技有限公司和上海斯莱克实验动物有限公司。动物饲养于复旦大学附属上海市第五人民医院动物实验室,所有的动物实验均执行“中国动物保健理事会”制定实验动物护使用指南规定,并且经复旦大学附属上海第五人民医院伦理委员会批准了本研究中所涉及的所有相关动物实验。
2.1.2. 设计引物
Primer premier 5.0引物设计软件设计引物,基因序列来自GenBank,PCR引物由上海生工生物工程公司合成。引物序列如下:β-actin:上游5’-TGAGAGGGAAATCGTGCGTGAC-3’;下游5’-GCTCGTTG CCAATAGTGATGACC-3’;NLRP3:上游5’-GGCTGCTATCTGGAGGAACTT-3’,下游5’-CATCTTCAGC AGCAGCCCTT-3’;ASC:上游5’-TGACAGTGCAACTGCGAGAA-3’,下游5’-GTGAGCTCCAAGCCATA CGA-3’;caspase-1:上游5’-ACTGACTGGGACCCTCAAGT-3’,下游5’-GCAAGACGTGTACGAGTGGT-3’。
2.2. 方法
2.2.1. 白念珠菌菌液制备
注射前3天,将白念珠菌CMCC(F)98001标准菌从−80℃冰箱取出,菌株接种在YEPD液体培养基中,37℃摇菌过夜。第2天将100 μl溶液添加到SD琼脂平板上,在30℃培养48下出现菌落后,将酵母细胞悬浮于无菌PBS中并洗涤2次。已有文献研究证实小鼠白念珠菌血流感染的LD50菌液浓度为2.5*108 CFU/mL [7],用麦氏比浊仪法确定菌液的浓度,首先确定0.8麦氏相当2.5*108 CFU/mL的菌液浓度,上述菌液取1/10的浓度2.5*109 CFU/mL,依次稀释10倍的浓度2.5*107 CFU/ml,2.5*106 CFU/ml。取上述4个浓度的菌液等体积的分别经尾静脉注射于4组小鼠体内,每组10只,注射量为1 ml/10g,每日观察小鼠发病和死亡情况。
2.2.2. 实验分组及处理
将小鼠随机分成3组(健康对照组、白念珠菌感染24 h组、白念珠菌感染48 h组),各组20只,将脓毒症组小鼠经2%戊巴比妥钠腹腔麻醉后分别经尾静脉注射白念珠菌菌液(2.5*108 CFU/mL, 0.1 ml/10g),对照组小鼠注射等量的无菌PBS。分别于感染后24小时和感染后48小时安乐死处死小鼠。分别取血液、肝、肺和肾组织匀浆10 μl分别加入90 μl无菌PBS溶液稀释后接种于血平板上,37℃ 24~48 h培养后记录其白念珠菌落计数(CFUs)。
2.2.3. 细胞炎症因子的ELISA
按照ELISA试剂盒(英国R&D公司)说明书进行操作,检测各组器官组织匀浆中细胞因子(IL-1β和IL-18)的含量,用酶标仪在450 nm波长下检测各组样品的吸光度(OD值),并通过标准曲线计算各样品中细胞炎性因子的浓度。
2.2.4. 实时荧光定量聚合酶联反应(qRT-PCR)
按Trizol试剂说明书操作提取总RNA,并检测总RNA的浓度与纯度值。按逆转录试剂盒(美国Thermo公司)说明书进行操作,以β-actin作为内参,根据荧光定量PCR试剂盒说明书,以2 μl cDNA链为模板20 μl的总反应体积进行PCR扩增,其中上下游引物各0.8 μl。反应条件为:95℃ 5 min预变性,95℃变性10 s;58℃退火40 s,72℃延伸30 s,共40个循环。由2-ΔΔCt表示目的基因表达的相对表达量。
2.2.5. Western blot
取各组不同时间节点(24 h, 48 h)小鼠组织(肝、肺、肾)各100 mg样本置于匀浆器中球状部位,用干净的组织剪尽量剪碎组织块。按照RIPA裂解液(上海生工生物工程公司)说明书操作。目标蛋白经SDS-PAGE电泳和PDF转膜后,置于5%封闭液中摇动封闭2 h,封闭后分别用抗NLRP3抗体(1:1000) (美国Santa Cruz公司)、ASC (1:500) (美国Santa Cruz公司)、caspase-1 (1:100) (美国Santa Cruz公司)、β-actin 抗体(1:1000) (北京中杉金桥生物公司)孵育过夜,经TBST洗膜后,加入相应的二抗(1:20,000)室温孵育2 h,然后经TBST洗膜后用ECL曝光、显影、定影,用Image J 1.37c软件测定蛋白条带的光密度并进行定量分析。
2.2.6. 免疫组化染色检测
各组各时间点(24 h, 48 h)的组织标本切片经常规处理后,经PBS冲洗切片后加一抗(1:100~500),置于4℃冰箱过夜。第二日经PBS冲洗后加通用型二抗,室温下孵育25 min后,用PBS冲洗DAB显色,10 min后放在光学显微镜下观察是否显色(阳性细胞为棕黄色颗粒)。使用清水冲洗后,用HE染色2~3 min,后用清水冲洗,放置10 min。60℃温箱20 min烤干后中性树胶封片,后放置60℃温箱烤干过夜,放置荧光显微镜下观察蛋白表达水平并保存图片,阴性对照片用PBS代替一抗。
2.3. 统计分析
采用SPSS22.0统计软件对数据进行统计学分析,呈正态分布的计量数据均使用均数 ± 标准差(
)表示。计数资料的组间比较采用c2检验。符合正态分布的计量资料采用两组t检验,配对的两组比较采用配对t检验,独立的两间数据比较使用两独立样本t检验,多组间数据比较用单因素方差分析,P < 0.05为差异有统计学意义。
3. 结果
3.1. 白念珠菌脓毒症小鼠模型的建立
第一组10只小鼠(2.5*109 CFU)在10小时内全部死亡。第二组10只小鼠(2.5*108 CFU)在24小时内存活8只,48小时后存活4只,存活的小鼠的各器官组织匀浆均有念珠菌培养阳性。第三组10只小鼠和第四组10只小鼠(2.5*107 CFU, 2.5*106 CFU)小鼠在24小时和48小时时间点全部存活,组织匀浆中未能培养出念珠菌。其余两组小鼠感染白念珠菌后出现神志嗜睡,不思饮食,活动缓慢,尾巴毛湿润等症状,并且随着感染时间延长感染症状进行性加重(图1)。因此根据小鼠生存率和小鼠感染白念珠菌后的症状,同时也根据文献报道 [8],我们确定2.5*108 CFU的白念珠菌浓度感染的小鼠建模是成功的,然后选用作为实验组方法。
3.2. 各组小鼠白念珠菌生长情况
血、肝、肾脏、肺组织匀浆中的白念珠菌在感染后24 h及48 h计数显著升高,而且感染48 h后比感染24 h后白念珠菌计数也明显升高(表1),表明白念珠菌脓毒症小鼠动物模型成功建立。
 Mice were infected with 2.5*109 CFU/ml, 2.5*108 CFU/ml, 2.5*107 CFU/ml, 2.5*106 CFU/ml, C. albicans respectively (n = 10/group).
Mice were infected with 2.5*109 CFU/ml, 2.5*108 CFU/ml, 2.5*107 CFU/ml, 2.5*106 CFU/ml, C. albicans respectively (n = 10/group).
Figure 1. Percent survival of mice with different concentrations C. albicans within 4 days.
图1. 不同浓度白念珠菌菌液感染小鼠后4天生存曲线

Table 1. The C. albicans counts in blood samples and tissue homogenates in each group
表1. 各组小鼠不同组织匀浆中的白念珠菌计数
注:与对照组比较:#P < 0.05;与24 h组比较:&P < 0.05。
3.3. 脓毒症组IL-1β和IL-18水平明显升高
与对照组相比,细胞因子IL-1β和IL-18在白念珠菌感染24 h、48 h后的小鼠各组织匀浆中的表达量显著升高(P < 0.05);与24 h组相比,48 h组中的血清及肝、肺匀浆中的IL-1β和血液中的IL-18显著降低,而肾匀浆中IL-1β和肺匀浆中IL-18显著升高,见表2。

Table 2. Levels of IL-1β and IL-18 in serum and tissue homogenate of mice with C. albicans sepsis
表2. 白念珠菌脓毒症小鼠血清及组织匀浆内的细胞因子IL-1β和IL-18水平
注:与对照组比较:#P < 0.05;与24 h组比较:&P < 0.05。
3.4. 脓毒症组NLRP3蛋白表达水平的比较
脓毒症48 h组目的蛋白表达水平显著高于与脓毒症24 h组和对照组,其中肾组织中ASC蛋白水平显著升高(p < 0.05),肝、肺组织中caspase-1 p20蛋白水平显著升高(p < 0.05),肝、肾、肺组织中pro-caspase-1蛋白显著升高(p < 0.05),见图2。
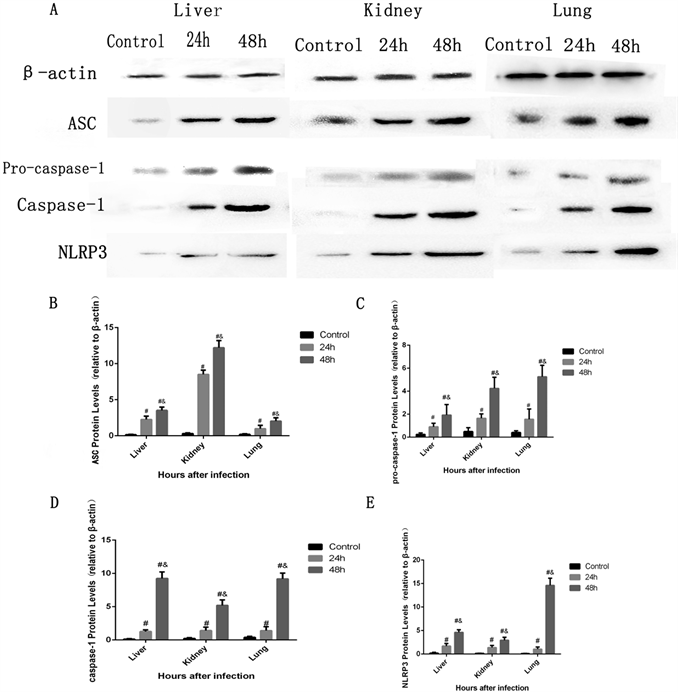 注:A:对照组、24 h脓毒症组及48 h脓毒症组的各组织匀浆(肺、肝、肾)中β-actin,NLRP3,ASC,caspase-1 p20蛋白的Western bloting结果。B~E:上述蛋白分别以β-actin为内参的相对定量表达。数据均以均数 ± 标准差表示。#代表感染24小时后与较对照组比较;&代表感染48小时后比感染24 h后比较。
注:A:对照组、24 h脓毒症组及48 h脓毒症组的各组织匀浆(肺、肝、肾)中β-actin,NLRP3,ASC,caspase-1 p20蛋白的Western bloting结果。B~E:上述蛋白分别以β-actin为内参的相对定量表达。数据均以均数 ± 标准差表示。#代表感染24小时后与较对照组比较;&代表感染48小时后比感染24 h后比较。
Figure 2. NLRP3, ASC, pro-caspase-1 and caspase-1 p20 inflammasome activation in tissues
图2. 各组小鼠组织中NLRP3、ASC、caspase-1 p20、pro-caspase-1蛋白表达
3.5. 脓毒症组NLRP3、ASC、Caspase-1免疫组化结果
免疫组化结果显示NLRP3、ASC和caspase-1蛋白主要在白念珠菌脓毒症组的小鼠肝、肾、肺组织细胞浆质中表达。脓毒症组不同组织中的阳性蛋白的表达量随感染时间而增加,且与肺组织相比,肝和肾组织中表达的阳性蛋白更多。见图3。
3.6. 各组小鼠NLRP3,ASC,Caspase-1 mRNA的表达量的比较
脓毒症组小鼠在感染白念珠菌后肝、肾、肺组织匀浆中NLRP3、ASC、caspase-1 mRNA表达水平显著高于健康对照组(P < 0.05),并且48 h组的NLRP3、ASC、caspase-1 mRNA表达水平显著高于24 h组(P < 0.05),见图4。

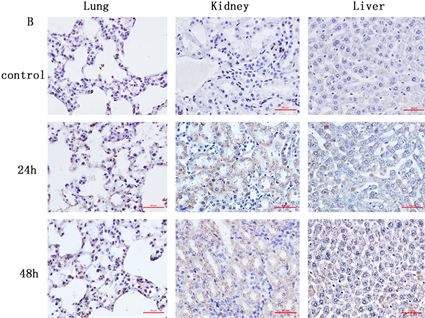
 注:A:各组织中NLRP3蛋白阳性表达;B:各组织中ASC蛋白阳性表达;C:各组织中caspase-1蛋白表达
注:A:各组织中NLRP3蛋白阳性表达;B:各组织中ASC蛋白阳性表达;C:各组织中caspase-1蛋白表达
Figure 3. Expressions of NLRP3, ASC and caspase-1 inflammasome in the tissues determined by immunohistochemistry (×400)
图3. 免疫组化法检测各组小鼠组织中NLRP3,ASC和caspase-1蛋白表达(×400)
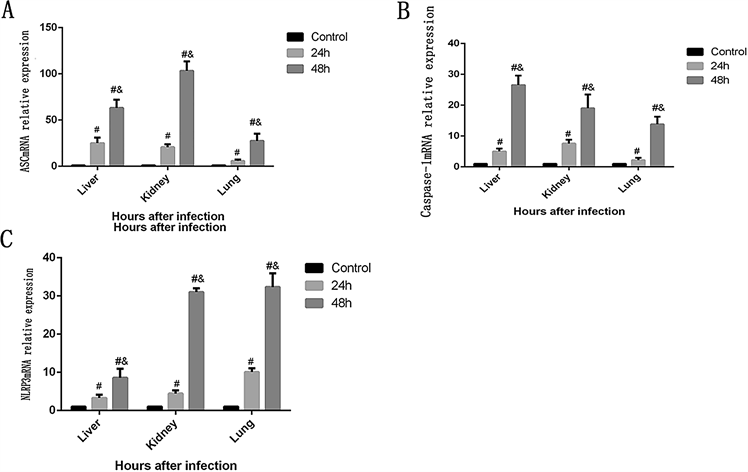 注:A:肺、肝、肾中ASC mRNA的表达量比较;B:肝、肾、肺组织中caspase-1 mRNA的表达量比较;C:肝、肾、肺组织中NLRP3 mRNA的表达量比较。β-actin mRNA的表达量用做内参。#与对照组比较P < 0.05;&代表在各组织中48 h组与24 h组比较P < 0.05。
注:A:肺、肝、肾中ASC mRNA的表达量比较;B:肝、肾、肺组织中caspase-1 mRNA的表达量比较;C:肝、肾、肺组织中NLRP3 mRNA的表达量比较。β-actin mRNA的表达量用做内参。#与对照组比较P < 0.05;&代表在各组织中48 h组与24 h组比较P < 0.05。
Figure 4. NLRP3, ASC and caspase-1 mRNA expression in tissues
图4. 各组小鼠组织中NLRP3,ASC和caspase-1 mRNA的表达
4. 讨论
念珠菌属于条件致病菌,广泛存在于正常人的皮肤和粘膜。近年来,由于各种侵入性操作、放疗、化疗、广谱抗生素、免疫抑制剂和糖皮质激素的广泛应用,使患者的免疫力下降,侵袭性真菌所致脓毒症的发病率不断增加,其中50%以上为白念珠菌感染,成为严重威胁人类健康的感染性疾病。目前,白念珠菌致病的机制尚不明确,研究和阐明白念珠菌致病的分子机制,为白念珠菌感染的防治提供新的治疗靶点,以成为白念珠菌感染防治研究亟待解决的重要问题。
本课题组长期致力于白念珠菌所致侵袭性感染的临床和基础研究,积累了一定的科研临床工作基础 [9] - [14]。
NLRP3炎性小体是目前研究较多的炎性小体,但它在白念珠菌脓毒症中的作用和机制目前尚未清楚。在本项研究中,通过构建白念珠菌脓毒症小鼠模型,应用q-RT PCR、Western blot和荧光免疫方法检测各组小鼠组织匀浆中的NLRP3、ASC、Procaspase-1以及caspase-1 p20 mRNA和相关蛋白表达情况,用以验证NLRP3炎性小体是否参与了白念珠菌脓毒症中的机体免疫反应。研究结果显示,白念珠菌脓毒症小鼠肝脏、肾脏和肺组织中均有NLRP3 mRNA、ASC mRNA、caspase-1 mRNA表达,其表达水平随着感染时间(48小时)而显著升高,NLRP3炎性小体的相关产物(NLRP3、ASC、Procasepase-1及caspase-1 p20)蛋白水平也显著增高,免疫组化结果也证实了白念珠菌感染小鼠后的肝脏、肾脏和肺脏组织细胞浆质中表达NLRP3、ASC和caspase-1蛋白,而健康对照组几乎不表达NLRP3炎性小体相关蛋白。在不同组织中的NLRP3炎性小体蛋白表达水平存在一定的差异,部分蛋白表达水平在感染后随着感染时间出现明显升高,与24 h组相比,48 h后肾脏组织中ASC蛋白水平显著升高,肝脏组织中caspase-1 p20蛋白水平显著升高,而在肺脏组织中变化不明显。免疫组化结果也证实,肝脏肾脏织中表达的NLPR3相关蛋白比肺脏组织更多。
在已有细菌性脓毒症感染研究中,吴丹等 [15] 发现金黄色葡萄球菌能够诱导NLRP3炎性小体蛋白表达升高,朱梦梦等 [16] 也证实了大肠杆菌血流感染与NLRP3炎症小体的激活有关,其表达水平与感染的严重程度有关。通过本研究,我们证实了NLRP3炎症小体除了感知细菌和病毒病原体外,还感知真菌病原体,在宿主防御念珠菌方面起着关键作用。
IL-1β和IL-18炎症因子是NLRP3炎症小体裂解活化的产物,我们的研究发现白念珠菌脓毒症小鼠的重要器官和组织中细胞因子IL-1β和IL-18表达水平比对照组显著升高,IL-1β在肝、肾组织中显著升高。在白念珠菌感染中,NLRP3炎性小体的激活起到重要的调节作用,并且以促进细胞因子IL-1β和IL-18的释放而发挥促炎作用。
有研究证实,口腔上皮细胞通过释放促炎细胞因子(包括IL-1α/β、IL-6和TNF-α)和抗菌肽(如β-防御素)对真菌病原体作出反应。白细胞介素-1α、白细胞介素-1β和白细胞介素-18在宿主抵抗白念珠菌感染中起重要作用,IL-1β在保护宿主免受侵袭性白念珠菌感染方面的意义已得到明确证明 [17]。
因此,我们的研究通过NLRP3炎症小体在在小鼠体内白念珠菌血流感染所致脓毒症发病机制之间建立了明确的联系。一项研究表明,与野生型小鼠相比,缺乏IL-1β的小鼠存活率较低,真菌负荷增加 [18]。利用这个模型,我们确定了IL-1β在宿主防御念珠菌感染中的重要作用。对于白色念珠菌,NLRP3诱导的IL-1β和IL-6已被证明是抗真菌保护性Th17免疫炎症反应的关键介质。这可能是由于这些细胞因子与体内固有免疫细胞(如树突状细胞和NK细胞)的复杂通路,这种通路可能介导特异性抗体和保护性T细胞的反应。
基金项目
上海市闵行区自然科学研究课题(2018MHZ003)。