1. 引言
马铃薯被联合国列为继小麦、水稻和玉米之后世界第四大粮食作物 [1],在世界人口不断增长的时代,增加马铃薯产量对于防止全球营养不良和饥饿至关重要 [2]。致病疫霉(Phytophthora infestans)是马铃薯最具破坏性的病原体 [3],也是卵菌纲的模式生物,它在19世纪爱尔兰马铃薯饥荒期间导致数百万人死亡 [4]。
致病疫霉具有无性和有性生命周期。无性生殖时以孢子囊或菌丝体侵染植物,是田间侵染过程中完成其生活史的主要阶段。有性生殖时,遗传物质重组导致了遗传变异和各地更复杂化的生理小种,产生的厚壁卵孢子又能抵抗冷冻、干燥、干旱、微生物降解,并在土壤中以静止状态持续多年 [5],然后卵孢子萌发出孢子囊或菌丝继续存活,使作物品种抗性丧失,从而对世界马铃薯、番茄和其他50个茄属(Solanum)植物生产构成严重的威胁 [6]。
在科研实验中,能够比较容易收集到足够量的生物样本对进行疫霉菌生态学、生物学、遗传分析、分子分析及致病性的测定等方面具有重要意义。不同的培养条件对疫霉菌的生长、生殖等会产生不同的影响。Mokhtar M. Satour等认为辣椒疫霉 [7] 卵孢子在V8培养基上产量最多;Thawee Kaosiri等对比了CA、CV-8A和SM培养基对棕榈疫霉 [8] 卵孢子数量的影响,其中CA上产量最多;M.A. DOSTER等研究结果显示利用低温,并向培养基中添加玉米油、亚麻子油或小麦胚芽油,会使丁香疫霉 [9] 卵孢子数量增加;Richard C等使用V8-CaCOa液体培养基诱导寄生疫霉 [10] 产生大量卵孢子;孙志宁等 [11] 也比较了CA、V8、RA、BA和OMA产致病疫霉孢子囊情况,其中OMA和BA能产生孢子囊,其余培养基均未产生孢子囊;李岩 [12] 采用玻璃纸胡萝卜琼脂培养大豆疫霉菌,10 d内没有产生卵孢子,表示此方法只适合培养大豆疫霉菌纯营养菌丝。以上大部分方法只是针对所研究的疫霉菌,尚不知道这些方法是否也能适用于致病疫霉。本试验比较了不同培养基对致病疫霉生长、无性生殖、有性生殖的影响,为今后深入研究致病疫霉时能够获得足够量符合条件的生物样本奠定了基础。
2. 材料与方法
2.1. 供试菌株
致病疫霉菌株 HQK8-3 (A1交配型)由内蒙古农业大学农学院周洪友教授惠赠,致病疫霉菌株P7723 (A2交配型)由福建农科院兰成忠研究员惠赠。所有的致病疫霉菌株均于18℃黑暗条件下培养。
2.2. 方法
2.2.1. 培养基制备
1) 黑麦培养基(RA)。参照郑小波的方法 [13],称取50 g黑麦种子,加去离子水1000 mL,浸泡24~36小时,121℃灭菌20 min,经四层纱布过滤除渣,上清液补水至1000 mL,加20 g琼脂。121℃灭菌20 min。
2) 胡萝卜培养基(CA)。参照郑小波的方法 [13],将200 g新鲜的胡萝卜切成小片,加去离子水500 mL,用组织捣碎机捣碎约40秒,经四层纱布过滤去渣,上清液补水至1000 mL,加20 g琼脂。121℃灭菌20 min。
3) 放置玻璃纸的黑麦培养基(CP)。将玻璃纸裁剪为与培养皿大小一致的圆形,121℃灭菌20 min,放入配置好的黑麦培养基上。
2.2.2. 生长曲线的测定及菌落形态观察
分别将菌株P7723和HQK8-3进行对峙培养和单独培养。对峙培养时,将新鲜培养的菌株P7723和HQK8-3,从菌落边缘用蓝枪头扎取菌丝块,两菌块相距3.5 cm,分别接种于不同培养基平皿上。单独培养时,将新鲜培养的菌株P7723和HQK8-3,从菌落边缘用蓝枪头扎取菌丝块,单独接种于不同培养基的中间。所有菌都在18℃条件下黑暗培养8 d,观察供试菌株在不同培养基上的菌落形态。从第三天开始,用十字交叉法测定菌落直径,直至接种后8 d,计算生长速率,每种培养基设置3个生物学重复。生长速率=菌落直径/培养时间,使用SPSS软件分析生长速率的差异。
2.2.3. 卵孢子的数量测定及形态观察
将菌株P7723和HQK8-3在不同培养基上对峙培养,当两种交配类型的菌丝体发生交接开始,在交接面用蓝枪头扎取菌块,在光学显微镜下镜检,观察卵孢子的形态特征,统计每个菌块的卵孢子数量,每种培养基测量3个重复,然后根据菌丝块面积,换算成每cm2菌丝块上产生多少个卵孢。
2.2.4. 卵孢子的活力测定
MTT染色法:将对峙培养的平板,用手术刀收集交接面的菌丝,放入0.05% MTT溶液中,36℃、黑暗静置培养24 h,在光学显微镜下观察,统计不同颜色卵孢子数量,每种培养基至少统计100个卵孢子,计算卵孢子活力率。存活率 = 紫色和红色卵孢子的总数/卵孢子的总数。
2.2.5. 孢子囊的数量测定及形态观察
培养方法同2.2.1与2.2.2,将对峙培养、单独培养在不同培养基上的菌株,从第5天开始,用蓝枪头在菌落的不同位置均匀的扎取菌块,在显微镜下镜检,观察孢子囊的形态特征,并记录每个菌块的孢子囊数量,每种培养基测量3个重复,然后根据菌丝块面积,计算每cm2菌丝块上的孢子囊数量。
2.2.6. 菌丝体生物量的测定
培养方法同2.2.1与2.2.2,当对峙培养的两种交配类型的菌丝体交接第7天时,用手术刀收集交接面的菌丝,单独培养的也在同一天,用手术刀收集整个菌落的菌丝,称量菌丝体重量,每种培养基设3个生物学重复。
3. 结果与分析
3.1. 不同培养基对致病疫霉的生长曲线及菌落形态的影响
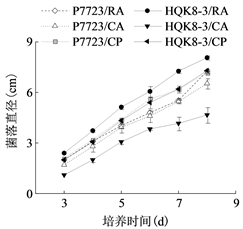
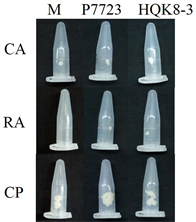
将致病疫霉菌株接种在不同培养基上,每天检测菌落直径,绘制其生长曲线。致病疫霉菌株P7723和HQK8-3的菌落直径随时间的变化如图1(a)所示,在接种3~8天内,菌落直径随时间呈现直线上升趋势。计算菌株P7723和HQK8-3的生长速率(图1(b)),菌株P7723在3种培养基上的生长速率大小顺序为CP > CA、RA,菌株HQK8-3在3种培养基上的生长速率为RA > CP > CA。观察两个菌株在不同培养基上的形态特征(图2),菌株P7723在不同培养基上的菌落特征有较明显差异,在CA平板上的菌落为棉絮状,气生菌丝很多,菌丝较厚、色白,有白色斑点;在CP和RA上,菌落扁平,气生菌丝较少,色较淡。而菌株HQK8-3在3种培养基上的菌落特征没有明显差异,都为棉絮状,气生菌丝很多,菌丝较厚、色白。
 (a)
(a) 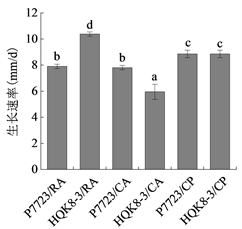 (b)注:(a)图为菌株P7723和HQK8-3在3种培养基上的生长曲线,(b)图为菌株P7723和HQK8-3在3种培养基上的生长速率。RA:黑麦培养基;CA:胡萝卜培养基;CP:放置玻璃纸的黑麦培养基。右图中不同小写字母表示生长速率差异显著(P < 0.05)。
(b)注:(a)图为菌株P7723和HQK8-3在3种培养基上的生长曲线,(b)图为菌株P7723和HQK8-3在3种培养基上的生长速率。RA:黑麦培养基;CA:胡萝卜培养基;CP:放置玻璃纸的黑麦培养基。右图中不同小写字母表示生长速率差异显著(P < 0.05)。
Figure 1. Growth curves and rates of the isolate P7723 and HQK8-3 on three kinds of media
图1. 菌株P7723和HQK8-3在三种培养基上的生长曲线及生长速率
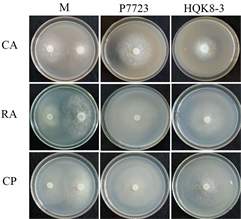 注:CA:胡萝卜培养基;RA:黑麦培养基;CP:放置玻璃纸的黑麦培养基;M:菌株P7723和菌株HQK8-3对峙培养;P7723:单独培养菌株P7723;HQK8-3:单独培养菌株HQK8-3。
注:CA:胡萝卜培养基;RA:黑麦培养基;CP:放置玻璃纸的黑麦培养基;M:菌株P7723和菌株HQK8-3对峙培养;P7723:单独培养菌株P7723;HQK8-3:单独培养菌株HQK8-3。
Figure 2. Colony morphology of the isolate P7723 and HQK8-3 after cultured separately or co-cultured for 7 days
图2. 菌株P7723和HQK8-3单独培养和对峙培养7天时的菌落形态
3.2. 不同培养基对致病疫霉卵孢子数量、形态及活力的影响
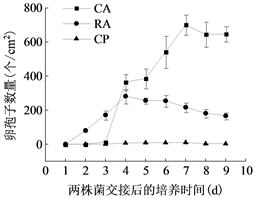
将菌株P7723和HQK8-3在不同培养基上对峙培养,从两个菌株的菌丝发生交接开始观察交接面卵孢子的数量及形态特征。如图3(a)所示,两个菌株在CA上交接3天开始产卵孢子,7天时卵孢子数最多为701个/cm2;在RA上交接2天开始产卵孢子,4天时卵孢子数最多为282个/cm2;在CP上交接4天开始产卵孢子,7天时卵孢子数最多为10个/cm2。三种培养基中CA上的卵孢子数量最高,是RA上的2.48倍,是CP上的70.1倍。
三种培养基上的卵孢子形态无明显差异(图4),均为卵圆形,黄褐色,大小为13.36~28.06 µm,均值22.10 µm,发育早期为单壁,发育成熟时会出现双壁,卵孢子的双壁率随发育时间呈现不断增高的趋势(图3(b))。在两个菌株的交接面内均没有观察到孢子囊,但在非交接面观察到了孢子囊。在CA上,菌株P7723和HQK8-3在交接面外的区域均能产生孢子囊;在RA上,菌株HQK8-3的非交接面会产生孢子囊,菌株P7723的非交接面不会产生孢子囊;在CP上,菌株P7723和HQK8-3的非交接面区域都没有产生孢子囊。
 (a)
(a) 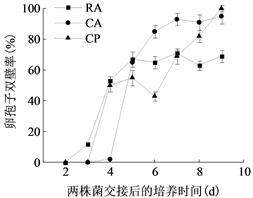 (b)注:(a)图为致病疫霉的卵孢子数量,(b)图为致病疫霉卵孢子的双壁率。CA:胡萝卜培养基;RA:黑麦培养基;CP:放置玻璃纸的黑麦培养基。
(b)注:(a)图为致病疫霉的卵孢子数量,(b)图为致病疫霉卵孢子的双壁率。CA:胡萝卜培养基;RA:黑麦培养基;CP:放置玻璃纸的黑麦培养基。
Figure 3. The number and double wall rate of oospores of P. infestans
图3. 致病疫霉的卵孢子数量及双壁率
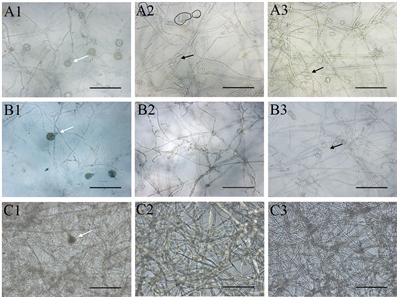 注:A1~A3:胡罗卜培养基;B1~B3:黑麦培养基;C1~C3:放置玻璃纸的黑麦培养基;A1~C1:菌株P7723和HQK8-3的交接面;A2~C2:菌株P7723的非交接面;A3~C3:菌株HQK8-3的非交接面;图中白色箭头所指为卵孢子,黑色箭头所指为孢子囊;显微放大20倍,Bar = 100 µm。
注:A1~A3:胡罗卜培养基;B1~B3:黑麦培养基;C1~C3:放置玻璃纸的黑麦培养基;A1~C1:菌株P7723和HQK8-3的交接面;A2~C2:菌株P7723的非交接面;A3~C3:菌株HQK8-3的非交接面;图中白色箭头所指为卵孢子,黑色箭头所指为孢子囊;显微放大20倍,Bar = 100 µm。
Figure 4. Sexual and asexual reproduction of the isolate P7723 and HQK8-3 in confrontation culture
图4. 菌株P7723和HQK8-3对峙培养时的有性生殖和无性生殖
观察卵孢子的发育过程(图5)。交接1~3天时,两株菌的菌丝接触后,产生卵原细胞的菌丝会穿雄器(图5(A)),此过程较快,不易观察到,之后卵原细胞穿过雄器不断膨大(图5(B));交接3~4天时,卵原细胞会完全膨大(图5(C)),大量的菌丝细胞质向膨胀的卵原细胞流动,卵原壁的表面积扩大,但厚度保持不变,与菌丝壁的厚度相近,在这个阶段,有大量的“功能性”细胞质(核糖体、线粒体、内质网、高尔基体及其囊泡)和细胞核,约占这个卵原细胞原生质空间的60%,剩下的是由类脂体和液泡组成的“储存”细胞质;交接5~6天,在完成扩张阶段后,卵原细胞内形成了一个大的卵球,卵原细胞壁不断增厚(图5(D)),液泡和类脂内含物占卵球细胞质的85%~95%;交接6~7天,卵原细胞发育为成熟的卵孢子(图5(E)),细胞核通常位于卵球的外围,被含有大量细胞质核小体、粗面内质网和线粒体的细胞质所包围;交接8天后,卵原细胞发育为休眠的卵孢子,形成卵质体和细胞核(图5(F)),细胞核一般有1个或多个。在RA和CP上的卵孢子发育过程和在CA上的相同。
 注:A:交接1~2天,卵原细胞穿过雄器;B:交接2~3天,卵原细胞不断膨大;C:交接3~4天,卵原细胞完全膨大;D:交接5~6天,卵原细胞壁不断增厚;E:交接6~7天,成熟的卵孢子,a为卵原细胞,o为雄器;F:交接8天后,休眠的卵孢子,Oop为卵质体,n为细胞核。显微放大100倍,Bar = 10 µm。
注:A:交接1~2天,卵原细胞穿过雄器;B:交接2~3天,卵原细胞不断膨大;C:交接3~4天,卵原细胞完全膨大;D:交接5~6天,卵原细胞壁不断增厚;E:交接6~7天,成熟的卵孢子,a为卵原细胞,o为雄器;F:交接8天后,休眠的卵孢子,Oop为卵质体,n为细胞核。显微放大100倍,Bar = 10 µm。
Figure 5. Oospore development process of P. infestans on the CA medium
图5. 在CA培养基上致病疫霉的卵孢子发育过程
MTT是一种活体染色剂,卵孢子经MTT染色后,红色或紫色的被认为是可存活的,死亡的卵孢子是黑色和未染色的 [14]。在对峙培养7天后,在交接面取样对卵孢子进行MTT染色(图6)。图6(A)和图6(B)为完全膨大的卵孢子,MTT染色后呈紫色和红色,为休眠期可存活的卵孢子;图6(C)和图6(D)为双壁的卵孢子,MTT染色后呈紫色和红色,也为休眠期可存活的卵孢子;图6(E)的卵孢子染色后呈黑色,图6(F)的卵孢子染色后未染色,都为无活力的卵孢子。根据染色情况来统计不同培养基上的卵孢子存活率。卵孢子在CA上的存活率为55%,在RA上为67%,在CP上为48%。
3.3. 不同培养基对致病疫霉孢子囊数量及形态的影响
在不同培养时间检测不同培养基上致病疫霉菌株产孢子囊的数量并观察孢子囊形态特征。在胡萝卜培养基上,菌株HQK8-3和P7723均产孢子囊(图7(a));单独培养时,菌株HQK8-3在11天时孢子囊数量最多,为359个/cm2;菌株P7723在7天时孢子囊数量最多,为18个/cm2。对峙培养时,菌株HQK8-3在13天时孢子囊数量最多,为441个/cm2;菌株P7723在9天时孢子囊数量最多,为52个/cm2。在黑麦培养基上,菌株HQK8-3产孢子囊,菌株P7723不产孢子囊(图7(b));单独培养时,菌株HQK8-3在7天时孢子囊数量最多,为65个/cm2;对峙培养时,菌株HQK8-3在7天时孢子囊数量最多,为99个/cm2。对峙培养时,在两个菌株菌丝交接面内不会产生孢子囊,但在交接面外仍然会进行无性生殖,孢子囊数量也没有减少。不同培养基对两个菌株的孢子囊形态均未产生明显影响(图8)。而在CP培养基上,不管是单独培养还是对峙培养,两个菌株均不产生孢子囊。
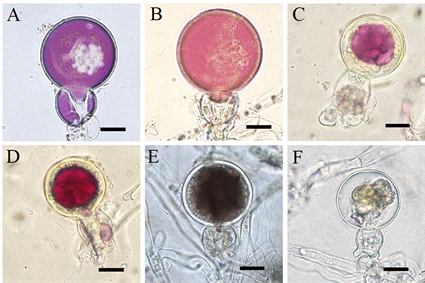 注:A-B:MTT染色膨大的卵孢子,呈紫色或红色,为活菌;C-D:MTT染色双壁的卵孢子,呈紫色或红色,为活菌;E:卵孢子呈黑色,无活力;F:卵孢子未染色,无活力;显微放大100倍,Bar = 10 µm。
注:A-B:MTT染色膨大的卵孢子,呈紫色或红色,为活菌;C-D:MTT染色双壁的卵孢子,呈紫色或红色,为活菌;E:卵孢子呈黑色,无活力;F:卵孢子未染色,无活力;显微放大100倍,Bar = 10 µm。
Figure 6. MTT staining of oospores
图6. 卵孢子的MTT染色
 (a)
(a)  (b)注:CA:胡萝卜培养基;RA:黑麦培养基。
(b)注:CA:胡萝卜培养基;RA:黑麦培养基。
Figure 7. Sporangium yield of P. infestans on different media
图7. 不同培养基上致病疫霉的孢子囊产量
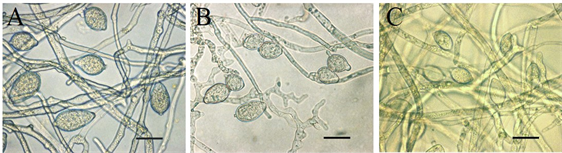 注:A:胡萝卜培养基上菌株HQK8-3的孢子囊;B:黑麦培养基上菌株HQK8-3的孢子囊;C:胡萝卜培养基上菌株P7723的孢子囊;显微放大60倍,Bar = 20 µm。
注:A:胡萝卜培养基上菌株HQK8-3的孢子囊;B:黑麦培养基上菌株HQK8-3的孢子囊;C:胡萝卜培养基上菌株P7723的孢子囊;显微放大60倍,Bar = 20 µm。
Figure 8. Sporangium morphology on different media
图8. 不同培养基上的孢子囊形态
3.4. 不同培养基对致病疫霉菌丝体生物量的影响
在后期实验中,需要在HQK8-3和P7723两个菌株对峙培养的交接面上收集到足够的菌丝,因此,接下来对两个菌株在不同培养基上对峙培养时交接面上收集到的菌丝量及单独培养时的菌丝量进行了检测。将菌株HQK8-3和P7723对峙培养,在两个菌株交接7天后,收集交接面的菌丝并称重(图9(a))。CA上可收集到的菌丝重量为3.8 mg/板,RA上的菌丝重量为0.2 mg/板,CP上的菌丝重量为22.8 mg/板,CP上的菌丝重量是CA上的6倍,是RA上的114倍(图9(b))。
单独培养时,P7723在CA上的菌丝重量为2.4 mg/板,RA上为0.1 mg/板,CP上为27.1 mg/板;HQK8-3在CA上的菌丝重量为10.1 mg/板,RA上为2.7 mg/板,CP上为29.4 mg/板。不同培养基对致病疫霉菌株单独培养和对峙培养时菌丝量的影响相同。两个菌株在CP上收集的菌丝量均显著多于在CA和RA上的菌丝量,菌丝重量都在20 mg以上,在CA上收集的菌丝重量在2 mg~11 mg之间,在RA上收集的菌丝重量小于3 mg (图9)。
 (a)
(a) 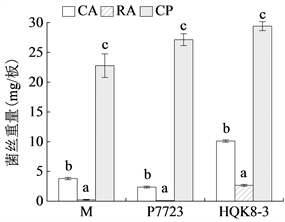 (b)注:CA:胡萝卜培养基;RA:黑麦培养基;CP:放置玻璃纸的黑麦培养基;M:菌株P7723和菌株HQK8-3对峙培养;P7723:单独培养菌株P7723;HQK8-3:单独培养菌株HQK8-3。
(b)注:CA:胡萝卜培养基;RA:黑麦培养基;CP:放置玻璃纸的黑麦培养基;M:菌株P7723和菌株HQK8-3对峙培养;P7723:单独培养菌株P7723;HQK8-3:单独培养菌株HQK8-3。
Figure 9. Mycelium biomass of P. infestans on different media
图9. 不同培养基上致病疫霉的菌丝体生物量
4. 讨论
综上,三种培养方法对致病疫霉菌株的菌丝体、孢子囊、卵孢子形态均未产生影响。在CP上收集的菌丝量明显高于另外两种培养基,但是CP上的卵孢子数量极少,也没有观察到孢子囊,说明放置了玻璃纸的培养方法会影响菌株的有性生殖和无性生殖,因此,该方法不适合检测致病疫霉有性生殖或无性生殖过程时用来收集样品。而CA和RA上两个菌株的交接面均可以产生大量的卵孢子,且在两种培养基上,卵孢子的发育过程相同,虽然在CA上的卵孢子存活率要低于RA上的,但是CA上的卵孢子数量远远高于RA上的。在CA和RA上,单独培养、对峙培养的非交接面均可正常产生孢子囊,CA上的孢子囊数量明显高于RA上的。此外,对峙培养、单独培养时,CA上收集到的菌丝体生物量均明显高于RA上的。因此,根据以上指标,胡萝卜培养基更适合在致病疫霉生长及有性、无性生殖研究中被用来收集生物样本。
CA培养基被许多人作为产卵孢子的培养基,例如,荔枝霜疫霉 [15] 在CA上卵孢子的产量最高,棕榈疫霉 [8] 在CA上产的卵孢子最多,培养大豆疫霉 [16] [17] [18] 卵孢子时也用CA,上述结果与本研究结果相同。本文中致病疫霉卵孢子的形态与烟草疫霉 [19]、辣椒疫霉 [20]、大豆疫霉 [21] 等相似。DON E. HEMMES等 [22] 使用电镜观察辣椒疫霉卵孢子发育形态,接种后77~100小时卵孢子为单壁,117小时后卵孢子变为双壁,190小时发育为成熟卵孢子,本试验结果与辣椒疫霉相似,致病疫霉卵孢子的发育过程也是从单壁变为双壁,并且在菌丝交接后的6~7天发育为成熟的卵孢子。兰成忠等 [23] 的研究结果显示,辣椒疫霉在OMA、CA和RA培养基可产生孢子囊,王良华 [24] 的研究结果显示大豆疫霉在PDA培养基上生长缓慢,在利马豆、玉米粉、V8汁等培养基上生长较快,在RA和V8上可产生孢子囊 [25],但本研究中致病疫霉菌株P7723在RA上不产孢子囊,在CA上只产生极少量孢子囊,而菌株HQK8-3在这两种培养基上均可产生大量孢子囊,这可能与致病疫霉菌株的具体特性有关。李岩 [9] 采用胡萝卜和玻璃纸胡萝卜培养基培养大豆疫霉菌,两种培养基均产生孢子囊,玻璃纸胡萝卜培养基上菌丝生长速度比胡萝卜培养基上的慢,10天内胡萝卜培养基产生了卵孢子,而玻璃纸胡萝卜培养基没有产生卵孢子,在产卵孢子方面与本研究结果相同,说明在培养基上放置玻璃纸这种方法只适合培养大豆疫霉或致病疫霉纯营养菌丝,不适合用来培养致病疫霉和大豆疫霉卵孢子。
NOTES
*通讯作者。