1. 前言
肺动脉高压(pulmonary hypertension, PH)的特征是肺血管重构导致肺动脉压(pulmonary arterial pressure, PAP)升高,随着时间的推移,右心室功能障碍,左心室充盈不足或受压,最终导致过早死亡早死 [1]。近年来,由于对发病机制的研究和靶向药物的开发,PH患者的预后得到了显著改善。
安立生坦是一种高选择性的内皮素A受体(endothelin A, ETA)拮抗剂。可拮抗ETA的血管收缩作用,同时保留内皮素B受体(endothelin B, ETB)清除内皮素(endothelin-1, ET-1)的作用 [2]。迄今为止,一些已发表的随机双盲安慰剂对照临床试验表明,安立生坦可显著改善PH患者的运动能力、症状、心肺血流动力学,并减缓临床恶化。随着安立生坦的临床应用逐渐广泛,其不良反应如周围水肿、鼻塞、头痛等逐渐被报道。因此,有必要评估安立生坦在临床患者中的安全性和有效性。
大多数安立生坦临床研究包括的样本量有限。为了提高准确性,结合个别研究的结果并得出单一的主要效应,我们对安立生坦的不良反应和有效性进行了系统回顾和荟萃分析。
2. 研究方法
2.1. 数据来源及搜索
检索数据库包括PubMed,Embase,Cochrane Library,和ClinicalTrials.gov (至2020年6月)。检索关键词为“ambrisentan and pulmonary hypertension”,并以“human、English、randomized-controlled trial”为限制条件。为了尽量避免遗漏文献,在阅读文献时,详细检查其参考文献。
2.2. 文献纳排标准
纳入标准:1) RCT研究;2) 研究对象为人类;3) 研究对象患有任何一种疾病;4) 研究对象中至少有一组接受安立生坦治疗;5) 研究中分别报道了安立生坦组及对照组的疗效及不良反应。对于有多个研究组的文献,我们纳入与纳入标准相符的研究组。
排除标准:1) 不能提取准确数据;2) 个案报道、综述、文献实验室研究或动物实验;3) 会议摘要或会议报告。
2.3. 数据提取及文献质量评价
两名研究者独立进行文献检索,并获取所有可能符合纳入标准文章的全文进行仔细阅读,如遇意见不统一,进行讨论,如仍有分歧,与第三位研究者讨论协商。从每项研究中提取的数据包括第一作者姓名、发表年份、研究设计、研究持续时间、研究人群特征(年龄、性别和患者数量)、干预措施(活性药物)、结果(主要结果和次要结果)、随访时间和所有报告的不良事件。
我们使用Gummesson [3] 改良Jadad [4] 评分来评估研究的质量。改良Jadad评分总分为5分,小于等于3分为低质量,大于等于4分为高质量。
2.4. 偏倚评估
我们使用Cochrane系统评价手册5.1.0中描述的标准来评估纳入研究中的试验水平偏倚风险 [5]。两名评审员独立评估研究的偏倚风险。通过讨论和协商一致解决了所有分歧,同时绘制漏斗图以评估出版偏倚。
2.5. 统计学方法
本文使用Review Manager 5.4进行Meta分析。个体研究和荟萃分析估计值用森林图呈现,对于非连续性变量计算其比值比,对于连续变量则计算其标准化均数差值和95%置信区间(confidence intervals, CIs)。异质性通过I2检验进行评估,该检验衡量了研究之间总变异的百分比。对于每个荟萃分析,进行了效应分析;若研究间异质性低(I2 < 50%),则使用固定效应模式;若研究间异质性检验有意义或高度不一致时(I2 ≥ 50%)选用随机效应模式 [6],并通过敏感性分析探讨异质性来源。如果研究没有报道数据的平均值和标准差,我们通过Greenland [7] 建议的方法从图表中计算得出。P < 0.05表明存在统计学显著差异。
3. 研究结果
3.1. 文献检索结果
通过检索数据库:PubMed,Embase,Cochrane library,ClinicalTrials.gov,共得到相关文献252篇,严格按照纳入排除标准进行筛查共得4篇文献共包含5个随机对照实验(文献筛选流程见图1)。最终,共493名患者被纳入研究,其中治疗组,318人,对照组175人。表1显示了纳入研究的基本特征。偏倚风险在图2中显示。
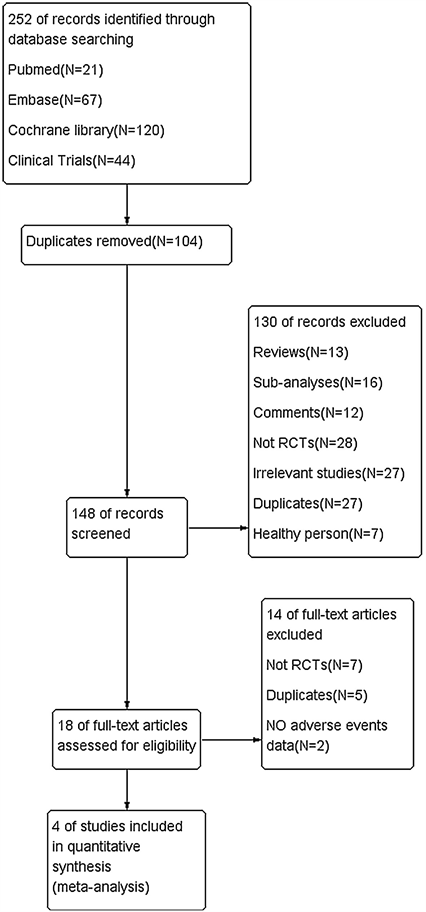
Figure 1. Flow chart of the selection process
图1. 文献筛选流程图.

Table 1. The baseline characteristics and Jadad score of six studies included in meta-analysis
表1. 全部纳入研究的基本特点
PAH = 肺动脉高;CTEPH = 慢性血栓栓塞性肺动脉高压;IPAH = 特发性肺动脉高压;SSc = 系统性硬化病。

Figure 2. Risk of bias summary
图2. 所有文献的偏倚评估,+ 低风险;-高风险;? 风险未知
3.2. 文献质量评价
采用了Gummesson [3] 改良的Jadad [4] 评分对研究进行质量评估。根据4项评定标准:随机试验、隐藏分配、双盲、失访率。5项研究Jadad评分均大于等于4分,均符合高质量标准(表2)。
3.3. 疗效分析
3.3.1. 6MWD
5项研究均6MWD作为主要终点事件,各研究之间无统计学异质性(P = 0.74, I2 = 0%)。与安慰剂相比,安立生坦组6MWD增加了37.53 m (95% CI = 20.88~54.18, P < 0.00001)。根据安立生坦的治疗剂量进行亚组分析,6MWD分别在5 mg组增加了38.03 m (95% CI = 16.57~59.50, P = 0.0005)、10 mg组增加了43.68 m (95% CI = 19.31~68.05, P = 0.0004),但2.5 mg组与安慰剂组之间无统计学差异(图3)。
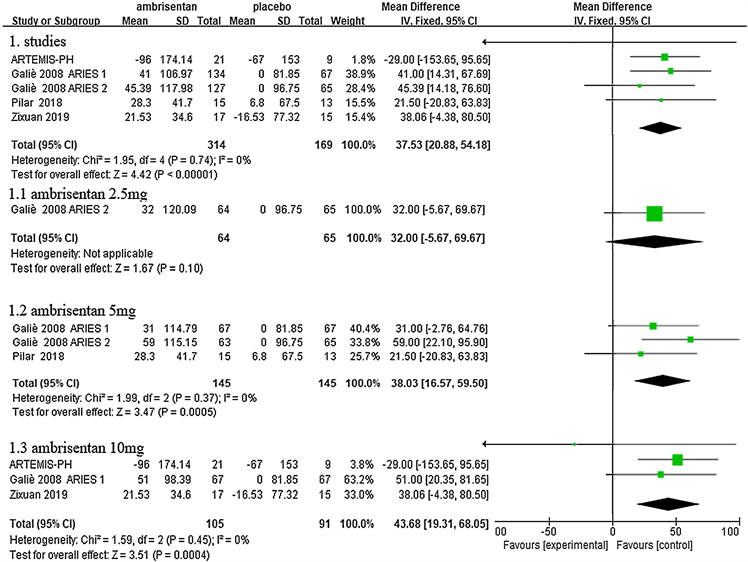
Figure 3. Change from baseline in 6MWD for ambrisentan inhibitors versus placebo
图3. 安立生坦组6分钟步行距离与对照组比较
3.3.2. 临床恶化率
临床恶化定义为患者死亡、临床症状加重、因肺动脉高压失代偿而住院、肺移植 [8]。3项研究中出现临床恶化,且各研究间无异质性(P = 0.19, I2 = 39%)。安立生坦组的临床恶化发生率低于安慰剂组(RR = 0.39, 95% CI = 0.24~0.66, P = 0.0004) (图4)。
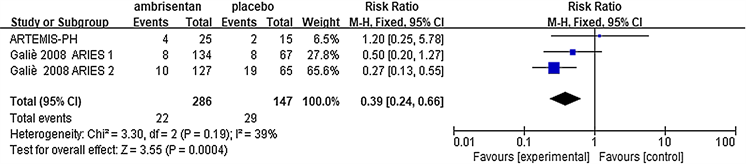
Figure 4. Incidence of clinical worsening for ambrisentan inhibitors versus placebo
图4. 安立生坦组临床恶化率与对照组相比
3.3.3. 血浆BNP浓度
在ARISE1及ARISE2研究中,血浆BNP浓度的基线水平相似。经过12周的治疗后,安慰剂组的血浆BNP浓度较基线增加9% (ARIES-1)和13% (ARIES-2)。相比之下,ARISE1的5 mg组(30%)和10 mg组(45%)以及ARISE2的2.5 mg组(29%)和5 mg组(30%)血浆BNP浓度均较基线下降(所有P < 0.003)。在Pilar的研究中,BNP浓度从基线值变化−29.4% (5 mg安立生坦组)和14.1% (安慰剂组)。而在Zixuan的研究中,安慰剂组BNP浓度从基线值变化为31.00 ± 85.83 (95% CI = −20.87~82.87),安立生坦组变化为−15.63 ± 207.48 (95% CI = −126.18~94.93),但他们之间无统计学差异。
3.4. 安全性
总体来说,安立生坦具有良好的耐受性,5项研究中的共报道AEs 491件,多为轻到中度。常见AEs包括外周水肿、鼻塞、头痛等,我们选取至少在2研究中出现的事件,并将安立生坦组及治疗组的绝对和相对频率进行分析。以下项目纳入研究:心血管疾病(心悸)、胃肠道疾病(腹部不适、腹泻、便秘)、一般性疾病(外周水肿、鼻塞、脸红、鼻衄)、感染(鼻窦炎、上呼吸道感染)、神经系统疾病(头痛)、呼吸系统疾病(呼吸困难)。表2中列出了相对应的95% CIs及P值。其中,安立生坦组与安慰剂组相比,外周水肿和鼻塞的发生频率具有统计学意义。

Table 2. Relative risk of known adverse events reported for ambrisentan in comparison with placebo
表2. 安立生坦已知不良事件的相对风险
3.4.1. 外周水肿
数据显示,与安慰剂组相比,安立生坦组发生外周水肿的风险显著更高(18.94% vs 12.63%;RR = 1.58, 95% CI = 1.01~2.45, P = 0.04)。根据安立生坦不同的治疗剂量进行亚组分析,10 mg组(RR = 2.08, 95% CI = 1.19~3.64, P = 0.01)、5 mg组(RR = 1.69, 95% CI = 0.95~3.01, P = 0.07)、2.5 mg组(RR = 0.29, 95% CI= 0.06~1.34, P = 0.11),结果显示,安立生坦10 mg组外周水肿发生率与安慰剂组有统计学差异(图5)。提示外周水肿的发生可能与安立生坦的剂量呈正相关。
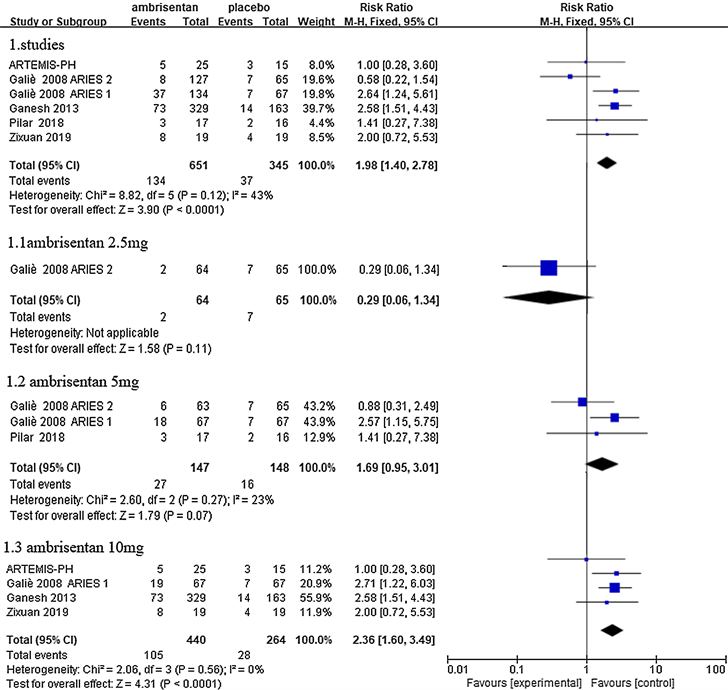
Figure 5. Incidence of peripheral edema for ambrisentan inhibitors versus placebo
图5. 安立生坦组水肿发生率与对照组比较
3.4.2. 鼻塞
安立生坦组鼻塞发生率明显高于对照组(7.34% vs 2.04%; RR 3.25, 95% CI = 1.08~9.79, P = 0.04)。在亚组分析中,安立生坦10 mg组(RR = 3.54, 95% CI = 1.04~12.02, P = 0.04),5 mg组(RR = 3.03, 95% CI = 0.74~12.38, P = 0.12),和2.5 mg组(RR = 3.05, 95% CI = 0.13~73.41, P = 0.49),其中10 mg组鼻塞发生概率与安慰剂组具有统计学意义,提示鼻塞的发生与可能安立生坦的剂量呈正相关(图6)。

Figure 6. Incidence of nasal congestion for ambrisentan inhibitors versus placebo
图6. 安立生坦组鼻塞发生率与对照组比较
3.5. 发表偏倚
视觉检查漏斗图分析显示适度对称性,几乎没有证据表明发表偏倚(图7)。
 (a) 6MWD (b) 临床恶化率
(a) 6MWD (b) 临床恶化率 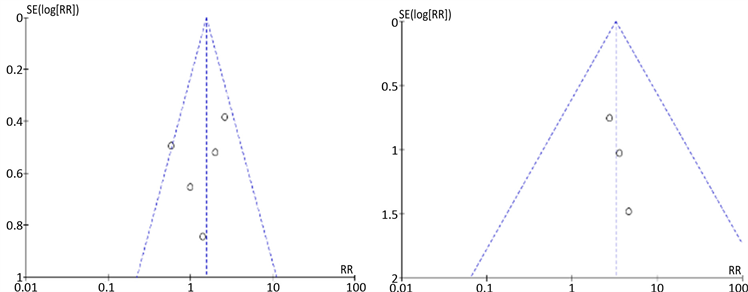 (c) 外周水肿 (d) 鼻塞
(c) 外周水肿 (d) 鼻塞
Figure 7. Funnel plot to assess publication bias
图7. 发表偏倚
4. 讨论
ET-1是血管内皮细胞产生的内源性肽,通过与G蛋白偶联受体结合发挥作用 [9]。ETA主要表达于血管平滑肌细胞和心肌细胞,而ETB主要表达于内皮细胞、平滑肌细胞和成纤维细胞 [10]。ETA亚型的激活和与平滑肌细胞上的ETB结合均可诱导血管收缩。同时内皮细胞上的ETB通过释放NO、前列环素和清除ET-1来促进血管舒张 [2] [11],此外,ETA和ETB均介导血管平滑肌细胞增殖。在健康个体中,内源性血管收缩剂/有丝分裂原和血管扩张剂/抗有丝分裂剂之间的平衡被认为介导了低基底肺血管张力和内稳态。对于PH患者,ET-1在肺部激活,导致血管收缩和肺微循环重构 [12]。因此,内皮素受体拮抗剂(ERAs)已被确定为大多数PH患者的一线治疗选择。
ETA是人肺组织中主要的内皮素受体亚型,其与ETB亚型的比值为93:7 [13]。因此,作为一种选择性ETA受体拮抗剂,安立生坦应该比非选择性ERA,如波生坦、马西替坦更有效。已有研究表明,安立生坦的绝对生物利用度为90%,远高于波生坦和马西替坦(50%~70%) [14],常容易被体循环吸收。这些都可能与安立生坦性能更加优越有关。
6分钟步行试验是一种常用的客观评估功能运动能力的测试,用于管理中重度肺部疾病患者。它提供的信息是病人进行日常活动的能力高低。该测试不需要复杂的设备或技术专长。在这个低复杂性、安全的测试中,病人被要求尽快沿着一条至少30米长的走廊,步行6分钟,主要结果指标是6 MWD [15]。它也被用于一次性评估患者的功能状态,预测的发病率和死亡率 [16]。
由于目前的指南强调运动能力恶化(定义为WHO功能分级II级或更糟)时开始治疗,能够提高运动能力的措施被大家所重视。本研究表明,安立生坦可以有效改善PH患者的6MWD和血浆BNP浓度,这两个指标是预后较好的标志。
临床恶化定义为患者死亡、临床症状加重、因肺动脉高压失代偿而住院、肺移植,在最近的随机试验中,越来越多的将其作为主要结果报道。在我们的研究中,安立生坦与减少临床恶化有关。但本研究纳入数量较少,可能不足以评估它,特别是考虑到它们的随访时间很短,导致了对治疗后期的评价不足。长期对注册患者的随访可在今后进一步分析这一重要的终点。
肝氨基转移酶升高是与ERAs相关的主要严重不良反应。虽然肝毒性的机制仍未完全阐明,但肝胆道清除胆盐障碍已成为主要推测。肝细胞对胆汁酸的摄取主要是在有机阴离子转运多肽(organic anion-transporting polypeptides, OATPs)的支持下,由基低外侧Na+-牛磺胆酸共转运多肽(Na+-taurocholate cotransporting polypeptide, NTCP)介导的。此外,胆汁盐出口泵(bile salt export pump, BSEP)和多药耐药相关蛋白2 (multidrug resistance-associated protein 2, MRP2)也参与胆汁分泌 [17] [18] [19]。ERAs可引起特定蛋白功能障碍,可能由于细胞内胆盐的积累而导致胆汁淤积性肝损伤。在肝细胞健康(细胞三磷酸腺苷/谷胱甘肽含量)、功能(尿素生产/白蛋白分泌)和牛磺胆酸运输(胆汁清除/排泄指数)的影响方面,安立生坦的作用最弱,而波生坦、马西替坦对肝胆运输的影响更强 [19]。因此,安立生坦的发生肝功能损害的可能性较低。在本研究中,除一般副作用如头痛、周围水肿、鼻塞、潮红和恶心外,没有氨基转移酶升高的报道。由此可见,安立生坦的安全性优于其他ERAs。
5. 结论
综上所述,安立生坦能够有效改善PH患者的6MWD、延缓临床恶化、改善血浆BNP浓度,而不良反应较少,能够安全有效地治疗PH。