1. 前言
稽留流产(Missed abortion, MA)是指胚胎或胎儿死亡但滞留在宫腔未及时自然排出。近年来MA发生率呈上升趋势,有报道称妊娠10~14周稽留流产的发生率约为20% [1]。目前大家关注的焦点主要是稽留流产的诊断和治疗,但是对于发生稽留流产可能的原因及机制研究较少。
弗林蛋白酶(Furin)属于前蛋白转化酶(Proprotein convertases, PC)家族中第一个被确定的成员,TGF-β2、TNF-a是Furin相关蛋白,三者在胚胎尤其是胎盘形成的过程中发挥重要作用。研究表明在胚胎发育第7.5天中胚层和外胚层均可以检测到Furin表达 [2]。Kim W. [3] 等人发现,Furin基因全身敲除小鼠存在多种发育缺陷,具有胚胎致死性,孕10.5~11.5天会发生胚胎死亡。早期妊娠过程中胚泡植入是重要步骤,而滋养细胞对子宫肌层的适度浸润是早期妊娠是否成功的决定性因素。研究发现转化生长因子(Transforming growth factor-β, TGF-β)亚型(TGF-β1, TGF-β2, TGF-β3)定位于胎母界面,在滋养细胞侵袭过程中发挥关键性作用。TGF-β1可以通过调控Th1/Th2型细胞因子的平衡产生抑制滋养细胞过度侵袭以及免疫抑制作用来维持母胎界面的免疫耐受状态,阻止胚胎被母体排斥而引发的流产 [4];TGF-β3具有抗侵袭性以及正常妊娠绒毛滋养层细胞表达的时间调节,并伴有妊娠合并子痫前期的失调 [5],而有关TGF-β2在妊娠组织中的研究文献有限。Jovanovi [6] 等人研究发现TGF-β2可能通过下调滋养层细胞中诱导型一氧化氮合酶,增强纤溶酶原激活物抑制剂(PAI)来发挥作用的。肿瘤坏死因子-a (Tumor Necrosis Factor, TNF-a)是由单核巨噬细胞分泌的一类多肽类细胞因子,研究证实TNF-a可通过免疫学机制调控妊娠过程中的多种生物学功能。动物模型实验表明,发生流产的孕鼠胎盘中TNF-a表达明显增高,但下调孕鼠母胎面TNF-a因子表达,其流产率明显下降 [7]。但目前有关Furin及其相关蛋白TGF-β2、TNF-a在人类早期妊娠组织中的表达及其机制的研究少有报道。本研究旨在分析Furin、TGF-β2及TNF-a在人类早期妊娠中的组织表达及变化趋势,探讨稽留流产可能的发病机制,以期指导临床。
2. 资料与方法
2.1. 资料
2.1.1. 研究对象
选取2018.01~2019.01期间青岛市妇女儿童医院行人工流产患者60例入组,其中实验组为稽留流产30例,对照组为正常妊娠30例。
2.1.2. 实验组(稽留流产组)入选标准
1) 初次就诊时血清β-hCG、孕酮等检验结果支持宫内妊娠诊断;妇科超声提示:宫内可见典型孕囊,或已见胎芽及心管搏动。
2) 在随后至孕10周内的任一次孕检中B超明确提示稽留流产。
早期妊娠稽留流产的超声诊断标准依据中华医学会计划生育学分会编写的《早期妊娠稽留流产治疗专家共识(2020年)》评判标准:1) 超声检查提示胎芽 ≥ 7 mm,但无心管搏动;2) 宫腔内孕囊平均直径≥ 25 mm,但无胎芽形成。3) 宫腔内未查见卵黄囊,14天后仍然未见胎芽及心管搏动。4) 宫腔内查见卵黄囊,11天后仍未见心管搏动。
2.1.3. 对照组(正常妊娠组)入选标准
1)初次就诊时孕6~10周;血清β-hCG、孕酮等检验结果支持宫内妊娠诊断;妇科超声提示:宫内可见典型孕囊,或已见胎芽及心管搏动。
2)要求行人工流产术。
2.1.4. 排除标准
1) 合并有严重的心肝肾、血液系统疾病或不能耐受人工流产的其他疾病。
2) 急性盆腔炎、阴道炎等生殖道炎症。
3) 感染致畸性细菌及病毒(如TORCH病毒)等患者。
4) 诊断为异位妊娠及妊娠滋养细胞疾病等患者。
5) 借助辅助生殖技术妊娠及多胎妊娠的患者。
2.2. 方法
1) 免疫组化法检测不同组织中Furin、TGF-β2、TNF-a的表达 按照免疫组化试剂盒说明书步骤进行实验。脱蜡水化;在pH 6.0枸橼酸钠缓冲液中加热至95℃ 15 min修复抗原,PBS缓冲液洗2次;3%过氧化氢37˚孵育30分钟,PBS液洗1次消除内源性酶;10%山羊血清室温孵育1小时抗原封闭;加一抗4˚孵育过夜,PBS液洗3次;加二抗室温孵育1小时,PBS液洗3次;DAB显色5~10分钟PBS液冲10分钟;苏木精复染1分钟,自来水冲洗15分钟;脱水透明后中性树胶封片、镜检。切片常规脱蜡水化、抗原修复、敷一抗、显色、复染。该实验重复3遍。
2) 结果判定 根据阳性细胞比率和染色深度分别进行评估,最后综合评定。采用H-score评分法,H-score = Σ(pi × i),式中pi表示阳性细胞数量占切片中所有细胞数量的百分比,范围从0%~100%;i代表着着色强度,0分(无着色),1分(淡黄色),2分(黄色),3分(棕褐色),因此H-score的范围为0~300,以中位数为截断值(cut-off values),可将按阳性表达程度各分为两组:高表达组﹥中位数,低表达组 ≤ 中位数 [16]。
2.3. 统计学处理
本次研究中所涉及到的数据均采用SPSS 20.0软件进行整理和分析。计数资料以百分率(%)表示,组间比较采用χ2检验,P < 0.05为差异有统计学意义。
2.4. 结果

Table 1. Expression of Furin, TGF-β2 and TNF-a in missed abortion tissue and normal pregnancy tissue (H-score) [16]
表1. Furin、TGF-β2、TNF-a因子在稽留流产和正常妊娠组织中表达情况(H-评分) [16]
其中,*代表P < 0.05。
Furin在蜕膜组织中的表达,稽留流产组明显高于正常妊娠组织(稽留流产组201.25 ± 5.72,正常妊娠组119.75 ± 3.71)差异有统计学意义(P < 0.05);而在绒毛的细胞滋养层中,Furin在稽留流产组织和正常妊娠组织中的表达基本一致(稽留流产组14.46 ± 2.12,正常妊娠组12.51 ± 0.56);在绒毛的合体细胞滋养层中,Furin在稽留流产组织中的表达明显高于正常组织(稽留流产组310.67 ± 4.22,正常妊娠组79.50 ± 4.52),差异有统计学意义(P < 0.05) (表1)。
TGF-β2在蜕膜组织中的表达,正常妊娠组织明显高于稽留流产组(正常妊娠组291.43 ± 5.47,稽留流产组176.34 ± 6.47)差异有统计学意义(P < 0.05);而在绒毛的细胞滋养层和合体滋养层,TGF-β2在稽留流产组织中的表达明显高于正常妊娠组织,差异均有统计学意义(细胞滋养层稽留流产组21.38 ± 3.46,正常妊娠组12.35 ± 2.46;合体滋养层稽留流产组195 ± 8.96,正常妊娠组56.24 ± 4.02)。
TNF-α在蜕膜组织中的表达,正常妊娠组织明显高于稽留流产组(正常妊娠组291.43 ± 5.47,稽留流产组176.34 ± 6.47)差异有统计学意义(P < 0.05);而在绒毛的细胞滋养层和合体滋养层,TNF-α在稽留流产组织中的表达明显高于正常妊娠组织,差异均有统计学意义(细胞滋养层稽留流产组52.41 ± 5.62,正常妊娠组14.25 ± 3.24;合体滋养层稽留流产组304.00 ± 8.64,正常妊娠组150.33 ± 3.26)。
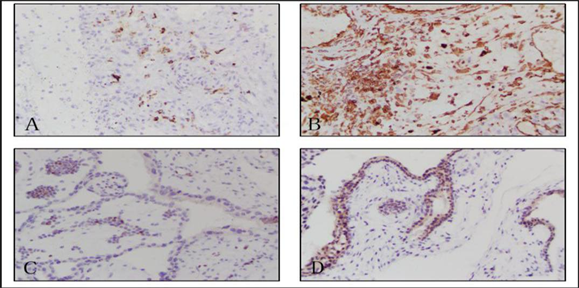 A:正常妊娠蜕膜组织;B:稽留流产蜕膜组织;C:正常妊娠绒毛组织;D:稽留流产绒毛组织
A:正常妊娠蜕膜组织;B:稽留流产蜕膜组织;C:正常妊娠绒毛组织;D:稽留流产绒毛组织
Figure 1. Expression of Furin protein in missed abortion tissue and normal pregnancy tissue (×200)
图1. Furin蛋白在稽留流产及正常妊娠组织中的表达(×200)
在蜕膜组织中,Furin蛋白在稽留流产组织(B,D)中的表达高于正常妊娠组织(A,C)。在绒毛的细胞滋养层中,稽留流产和正常妊娠组织中Furin蛋白表达基本一致(C,D)。在绒毛的合体细胞滋养层中,稽留流产组织中Furin蛋白表达明显高于正常妊娠组织(C,D),见图1。
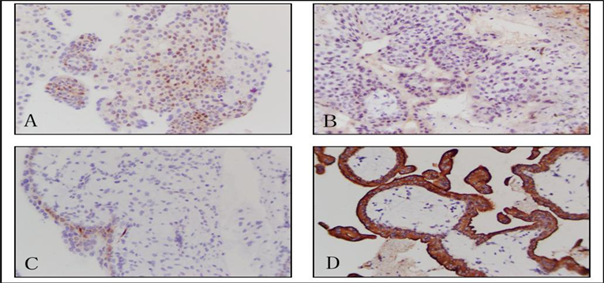 A:正常妊娠蜕膜组织;B:稽留流产蜕膜组织;C:正常妊娠绒毛组织;D:稽留流产绒毛组织
A:正常妊娠蜕膜组织;B:稽留流产蜕膜组织;C:正常妊娠绒毛组织;D:稽留流产绒毛组织
Figure 2. Expression of TGF-β2 in missed abortion tissue and normal pregnancy tissue (×200)
图2. TGF-β2在稽留流产及正常妊娠组织中的表达(×200)
在蜕膜组织中,TGF-β2在正常妊娠组织中的表达高于稽留流产组织(A,B)。相反,在绒毛的细胞滋养层和合体滋养层细胞中,TGF-β2在稽留流产组织中的表达均高于正常妊娠组织(C,D),见图2。
在蜕膜组织中,TNF-a在正常妊娠组织中的表达高于稽留流产组织(A,B)。相反,在绒毛组织的细胞滋养层和合体滋养层细胞中,TNF-a在稽留流产组织中的表达均高于正常妊娠组织(C,D),见图3。
 A:正常妊娠蜕膜组织;B:稽留流产蜕膜组织;C:正常妊娠绒毛组织;D:稽留流产绒毛组织
A:正常妊娠蜕膜组织;B:稽留流产蜕膜组织;C:正常妊娠绒毛组织;D:稽留流产绒毛组织
Figure 3. Expression of TNF-a in missed abortion tissue and normal pregnancy tissue (×200)
图3. TNF-a在稽留流产及正常妊娠组织中的表达(×200)
3. 讨论
妊娠是极为复杂而又受到精细调控的生命现象,机体存在多重机制来维持妊娠过程。
其中最重要的机制就是免疫系统和内分泌的调节。细胞因子是由免疫细胞和某些非免疫细胞合成、分泌的一类小分子蛋白,可介导和调控免疫、炎症反应及单核/巨噬细胞产生单核因子等过程。细胞因子作为一类具有广泛生物学活性的激素样多肽调控生殖过程,通过调节卵巢内分泌或旁分泌,影响卵泡成熟、胚胎发育及胚泡着床等环节来调控复杂的生殖过程 [7]。肿瘤坏死因子(Tumor necrosis factor, TNF)属于细胞因子之一,主要有两种类型:一种由单核/巨噬细胞产生TNF-α;另一种是由致敏淋巴细胞产生的淋巴毒素TNF-β,两者具有相同的受体和生物学活性 [8]。近年来,有关妊娠过程中母体对胚胎半同种抗原的免疫耐受的研究成为热点。有学者认为流产是这种免疫耐受遭受破坏的结局。蜕膜、绒毛作为母胎之间交换的重要部位,在妊娠的不同阶段发挥着不同的作用。随着胚胎的植入和发育,蜕膜细胞分泌多种细胞因子如TGF-β、TNF-a、LIF、CSF等等,这些细胞因子及相关蛋白形成复杂的内分泌网络,发挥营养胚泡、调控细胞生长分化、滋养细胞植入、调整母胎面免疫反应、阻止母体排斥胚胎等多种生理过程 [9]。本研究通过免疫组化法检测30例稽留流产组织及30例正常妊娠组织绒毛及蜕膜中TGF-β2、TNF-a及其相关蛋白Furin的表达及变化,探究三种因子在稽留流产发病机制中可能发挥的作用及临床意义。
Furin是前蛋白转化酶(Proprotein convertases,PC)家族的成员之一,广泛存在于哺乳动物体内。Furin底物广泛,可识别病毒胞膜糖蛋白、细菌外毒素、生长因子及其受体、基质金属蛋白酶及黏附因子等等,发挥多种生物学效应 [2]。有研究发现在胚胎发育的10.5~11天,Furin可识别TGF-β1、BMP5和BMP7等前体蛋白调控心血管发育 [10]。Furin高表达可激活其下游底物TGF-β1,促进卵母细胞的成熟和分化。Furin全身敲除小鼠,可出现绒毛膜尿囊融合失败、卵黄囊血管缺失、心脏腹侧闭合缺陷、卵泡发育不良和女性不育等多种缺陷,甚至死亡 [11]。此外,条件性敲低小鼠胎盘中的Furin基因,将导致合胞体化和胚胎发育的严重缺陷,并且胎盘侵袭性完全消失 [12],提示Furin在早期胚胎发育尤其是胎盘和合体滋养层形成过程中的发挥了关键性作用。也有文献报道,Furin可调节T细胞产生TGF-β来维持免疫稳态和外周免疫耐受,并且还参与调节T细胞受体诱导的转录和T辅助细胞的平衡,通过调控巨噬细胞中发挥抗炎功能 [13]。我们研究发现,Furin在稽留流产组织中的表达明显高于正常妊娠组织,这种趋势在稽留流产组织的蜕膜组织和合体细胞滋养层中表现的更加明显,差异有统计学意义;而细胞滋养层中Furin在稽留流产和正常组织中的表达基本一致,差异无明显意义。究其原因,我们推测:Furin高表达可能引起母胎面免疫稳态和免疫耐受发生紊乱,进而影响了早期胚胎胚泡植入、侵袭的过程。
为进一步研究稽留流产发生可能机制,我们检测了不同组织中TGF-β2的表达。众所周知,TGF-β主要由子宫内膜上皮细胞,在妊娠期主要是由蜕膜细胞分泌表达,在胚泡植入过程中发挥重要作用的一种细胞因子 [14]。近年来,有关TNF-α与生殖免疫调节的研究报道较多,而有关TGF-β,尤其是TGF-β2在生殖过程中的作用研究报道较少。有研究报道TGF-β在胚胎分化和发育过程中发挥重要调控作用,主要作用于子宫内膜,为胚胎的植入做准备 [14]。TGF-β在胚胎植入的过程中处于动态平衡的状态,其表达过低或过高都会影响植入过程。Simpon [15] 等人报道在蜕膜细胞间和细胞外肌层螺旋动脉周围中检测到TNF-β2的表达,并伴有转化的蜕膜细胞。当给予SB431542一种TGF表达抑制剂后,检测到蜕膜化减少约77%,提示TNF-β2在妊娠的蜕膜化和延续性方面发挥着重要作用 [15]。我们的研究发现TGF-β2在正常妊娠组织蜕膜中的表达高于稽留流产组织,我们推测这种情况可能取决于蜕膜细胞、非胎盘绒毛细胞中的蜕膜淋巴细胞或妊娠的继发性反应的作用,此外也不排除正常妊娠组织中部分区域轻微的退行性变引起局部氧化应激反应引起TGF-β2免疫定位增加。有研究报道,TGF-β家族在胎盘绒毛组织中的分布是不一致。血浆中TGF-β1高水平与流产的发生密切相关;胎盘中TGF-β3,易发生子痫前期 [16]。Ball [14] 等研究发现在早期和非整倍体流产组织的合体滋养细胞中TGF-β2表达增加,这也我们的研究结果相一致。我们的研究发现在绒毛的细胞滋养层和合体滋养层细胞中,TGF-β2在稽留流产组织中的表达均高于正常妊娠组织。在合体合体滋养层细胞中TGF-β2免疫原性更加明显一些(195 ± 8.96),提示我们TGF-β2可能不参与调控稽留流产组织的蜕膜化过程,稽留流产组织TGF-β2高表达可能参与抑制流产和阻止胚胎排出的过程。
研究发现TNF-α具有调节滋养层细胞正常增殖、分化和凋亡的作用,非孕妇、正常早孕妇女血清中TNF常呈低值水平,随着孕周增加其表达水平略有增加,其主要机制为滋养细胞侵入子宫蜕膜的过程中起调节作用 [17]。在胚胎植入时,TNF-α产生抑制细胞分裂、增殖的作用,增强T淋巴细胞的细胞毒性作用,导致蜕膜产生Th1型免疫反应,表现为免疫杀伤、滋养细胞凋亡,TNF-α过度表达不利于妊娠维持 [17]。动物实验发现直接输入TNF-α可引起免、鼠的胎盘出血和流产 [18]。有研究曾报道20%~73%的宫内感染羊水中均可测到相当量的TNF-a [19]。有文献报道滋养细胞中TNF-α的表达是以一种自分泌的方式在滋养层细胞的生长和分化过程中发挥作用的 [20]。TNF基因在恶性滋养细胞肿瘤的细胞中高表达,并在胎盘形成过程中过度增殖和侵袭转移 [21]。我们研究也发现了相似的事实,在蜕膜组织中,TNF-a在正常妊娠组织中的表达高于稽留流产组织。相反,在绒毛组织的细胞滋养层和合体滋养层细胞中,TNF-a在稽留流产组织中的表达均高于正常妊娠组织。我们研究结果提示,在正常妊娠组织和稽留流产组织的细胞滋养层TNF-a均有较强的表达,我们认为高水平的TNF-a表达是滋养层功能的一个标志。在稽留流产组织合体滋养层细胞中表达出更强的免疫原性,我们推测稽留流产组织可能在感染、缺氧等不良因素刺激下引发TNF-α异常表达,尤其是母胎交界面中TNF-α表达增加,刺激蜕膜细胞分泌释放异常细胞因子,如TGF-β、PGE2、Fg12等等,多种细胞因子的共同作用引起胎盘滋养层血管血栓形成,出现绒毛滋养细胞尤其合体滋养细胞的凋亡增加,最终影响胎盘绒毛的正常发育。
4. 结论
总之,在妊娠组织中的蜕膜、滋养细胞层均检测到Furin、TGF-β2、TNF-a不同程度的表达,三种因子在妊娠不同阶段发挥不同的生物学作用,是维持妊娠不可或缺的角色。其中任何一种因子异常表达均可能导致流产的发生。
基金项目
山东省自然科学基金资助项目(项目编号:ZR2015HM035)。