1. 引言
特异性蛋白表达检测是生物和医学研究中常用的方法。传统的蛋白免疫印迹(Western Blotting, WB)一直被科研工作者使用,但其步骤多,周期长,结果不稳定。近年全自动蛋白定量分析(Automatic Quantitative Protein Analysis)以其独特的优势发展迅速。本文将传统的蛋白免疫印迹和全自动蛋白质定量分析检测进行比较,并进行方法学优化,为蛋白质定量分析提供技术参考。
Western Blotting (WB)是分析某一蛋白质相对含量的一种常用技术,它将高分辨率凝胶电泳和免疫化学杂交显影技术相结合 [1] [2]。传统的WB分析步骤包括:1) SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE);2) 电转移;3) 抗体杂交和酶联免疫显影。首先,提取组织或细胞中的总蛋白质,进行BCA定量分析;然后通过SDS-PAGE电泳使得蛋白质分子按分子量大小分离;通过电转移将胶上的蛋白质转移到PVDF膜上,封闭处理后,依次与特异性抗体(一抗)和酶(或荧光染料)交联的二抗杂交。最后,经过显影处理,可以观察到目标分子的表达变化。WB检测的灵敏性受多个因素的影响,如:目标分子的含量和分子量大小、转膜的效率、抗体的亲和性等,并且由于人工操作步骤较多,实验的重复性和稳定性有限 [3] [4] [5]。
全自动蛋白质表达定量分析是近年新发展起来的一种蛋白检测技术,它将免疫印迹的制胶、蛋白电泳分离、杂交和显影集成到一个系统中,并实现全自动化。目前该系统有两种型号的检测仪器:WES和JESS,前者适用于化学发光显影,后者还兼容荧光成像。本研究中使用的是WES系统。首先,试剂盒中预制的分离胶和浓缩胶吸附到毛细管中,紫外照射后交联激活,形成蛋白质分离柱。将蛋白样品、一抗、二抗、发光液以及洗涤液分别加到孔板中,上机后它们按设定的程序依次被吸到分离柱上进行反应。这是一种对蛋白质进行原位杂交的分析方法,不需要电泳转膜,避免了转膜不充分或过度对结果的影响;并且,该方法一次最多可以检测24个样本,运行时间大约为3小时,显著提高了检测效率。本研究对这两种技术进行了系统研究,以比较两种方法的灵敏度、重复性和适用范围,为科研工作者进行蛋白质相对定量分析提供技术参考。
2. 材料与方法
2.1. 材料
1) 样本:人乳腺癌MDA-MB-231细胞,购买自ATCC细胞库。
2) 抗体:见表1。

Table 1. The information of antibody
表1. 抗体信息一览表
3) 其他试剂
RIPA蛋白裂解液(碧云天,P0013B)、BCA蛋白定量检测试剂盒(碧云天,P0010)、蛋白酶抑制剂(MCE, HY-K0010);化学放光试液(Millopore, BKLS0100)。
4) WES kit (Protein Simple):2-40KD低分子量蛋白分析kit (货号:SM-W012-1),12-230KD中分子量蛋白分析kit (货号:SM-W004-1),66-440KD高分子量蛋白分析kit (货号:SM-W006-1)。
5) 仪器
全自动蛋白质定量分析系统(Protein Simple, USA);化学发光凝胶成像仪(Bio-Rad, USA)。
2.2. 方法
1) 蛋白质样品获得:用含有10%的胎牛血清的DMEM培养基培养MDA-MB-231细胞。取生长至对数期的MDA-MB-231细胞,加入适量RIPA裂解液(含蛋白酶抑制剂),置于冰上裂解30分钟,然后12,000 rpm离心30分钟(4℃)收集上清,置于−80℃保存备用。
2) 蛋白定量:取细胞裂解液适量,5倍稀释,按照BCA试剂盒说明书进行蛋白定量。
3) WB实验条件
a) 对于分子量小于40KD的Caspase3、p-H2AX,电泳时用15%的分离胶分离;250 mA恒流转膜1 h;
b) 对于中分子蛋白的Actin、GAPDH、Ku70,选择10%的分离胶进行电泳;250 mA恒流转膜1.5 h;
c) 对于大分子量蛋白的mTOR、ATR,电泳时用6%的分离胶分离;250 mA恒流转膜6 h;
d) 蛋白转膜后,在含5%的脱脂奶粉封闭液中封闭1 h,然后加入一抗4℃过夜孵育。次日,洗涤膜3次后根据一抗的种属来源加入对应的HRP标记的二抗,室温孵育1小时。洗膜后,加入化学发光液,在凝胶成像仪上曝光,采集图像,并进行灰度分析。
4) WES主要操作步骤
首先,将蛋白样品稀释成0.5、2、8 mg/ml,按说明书操作要求取相应体积WES上样buffer和双蒸水,混合,制成样品检测液,加入到检测板的样品孔道中。然后将稀释的一抗、二抗、洗涤液分别按说明书要求加入到检测板的相应孔道中,室温2500 rpm离心检测板5 min。将检测板和预制毛细管板放入WES机箱,运行WES软件程序,进行全自动蛋白定量分析。
2.3. 结果分析
采用Graphpad prsim 8.0进行Pearson相关性分析。
3. 结果
3.1. 两种检测方法的灵敏度分析
在传统的WB分析中,分子量不同的蛋白需要的转膜条件和时间不同。因此在本研究中按分子量大小分别比较了WB和WES分析的灵敏性。
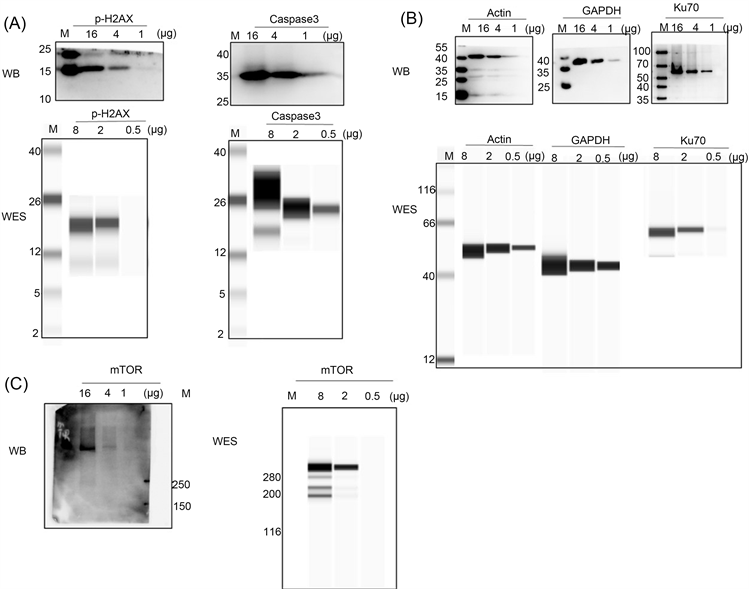
Figure 1. The proteins with different molecular weight were detected by WB and WES. (A) Low molecular weight; (B) Medium molecular weight; (C) High molecular weight
图1. 采用WB与WES两种方法检测不同分子量蛋白。(A) 低分子量蛋白;(B) 中分子量蛋白;(C) 高分子量蛋白
1) 对于分子量小于40 KD的蛋白,我们检测了Caspase3、p-H2AX两个蛋白的丰度(抗体信息见表1)。如图1(A)所示,在总蛋白量为16、4、1 µg时,WB的结果显示条带灰度与蛋白含量的相关相关系数分别是0.74和0.99。使用WES分析,在总蛋白量为8、2、0.5 µg时,WES的结果显示条带灰度与蛋白含量的相关相关系数分别是0.97和0.99。
2) 对于分子量在30~100 KD的蛋白,我们检测了Actin、GAPDH和Ku70三个蛋白的丰度(抗体信息见表1)。如图1(B)所示,在总蛋白量为16、4、1 µg时,WB的结果显示条带灰度与蛋白含量的相关相关系数分别是0.97、0.98、和0.94。使用WES分析,在总蛋白量为8、2、0.5 µg时,WES的结果显示条带灰度与蛋白含量的相关相关系数分别是0.98、0.98和0.94。
3) 对于分子量大于200 KD的蛋白质,我们检测了mTOR蛋白的丰度(抗体信息见表1)。如图1(C)所示,在总蛋白量为16、4、1 µg时,WB的结果显示条带灰度与蛋白含量的相关相关系数分别是0.99。使用WES分析,在总蛋白量为8、2、0.5 µg时,WES的结果显示条带灰度与蛋白含量的相关相关系数为0.98。
综上可以看出,用两种方法检测不同分子量的蛋白质,在一定的浓度范围内,两种方法都具有很好的相关性;与传统的WB方法相比,WES方法可以检出更低含量的蛋白质,灵敏度更高。
3.2. 采用WES的方法同时检测两种蛋白
如果检测的目标蛋白分子量差异较大,理论上可以用WES同时检测目标分子和内参。为了探究同一通道多分子的检测可能性,我们选取GAPDH、Ku70、Actin三个分子进行验证(抗体信息见表1)。将兔抗人Ku70的抗体分别和鼠抗人GAPDH抗体、鼠抗人Actin抗体等体积混合,加入同一通道。结果如图2所示:WES能够同时检测样本中Ku70和GAPDH (或Actin)的含量,与这三个分子单独杂交相比,结果无差异。因此,如果待检的蛋白质分子量差异显著,并且抗体杂交的条带特异性强,可通过WES进行多重检测,同时在一个泳道比较内参及目标分子的变化,这增加了实验结果的可信度,并节省了样本。
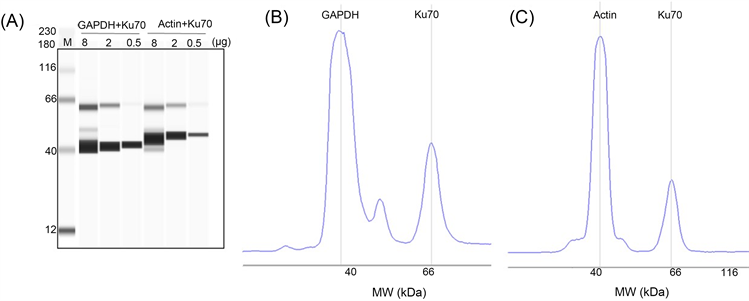
Figure 2. The two proteins were detected simultaneously by WES. (A) The lane diagrams of internal reference (GAPDH or Actin) and KU70 detected simultaneously; (B) The peak patterns of GAPDH and Ku70 detected simultaneously; (C) The peak patterns of Actin and Ku70 detected simultaneously
图2. 采用WES的方法同时检测两种蛋白。(A) 同时检测内参(GAPDH或Actin)和Ku70的泳道图;(B) 同时检测GAPDH和Ku70的峰形图;(C) 同时检测Actin和Ku70的峰形图
3.3. 重复性及准确性
WB分析的过程人工操作环节较多,研究者Angela Koller曾指出,传统WB标准差系数(Coefficient of Variance, CV)大于35%,重复性较差 [6]。为了探究WES的重复性,本研究以GAPDH分子为例,重复五次分析,结果如图3所示,其CV值约3.2%,提示WES的重复性优于传统WB。
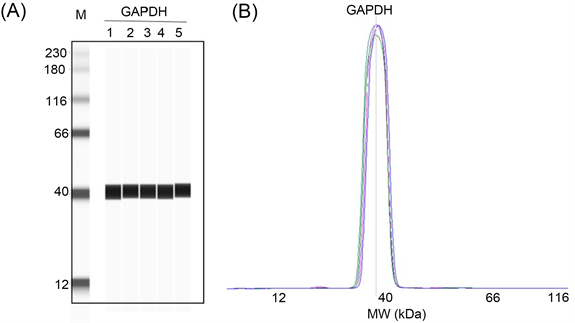
Figure 3. The accuracy and reproducibility of GAPDH expression were detected by WES. (A) The lane map with five repeats; (B) The peak pattern of five times
图3. WES检测GAPDH表达的准确性及重复性。(A) 重复五次上样的泳道图;(B) 重复五次上样的峰形图
3.4. WES能检测微量的蛋白剪切体
细胞在生理或应激状态时常发生蛋白的剪切,如在凋亡过程中多聚ADP-核糖体聚合酶(poly ADP-ribose polymerase, PARP)被Caspase-3剪切,其催化结构域和DNA结合结构域分离。我们用依托泊苷(Etoposide, 5 μM)处理人乳腺癌MDA-MB-231细胞,提取总蛋白,通过WES检测PARP分子的剪切,结果如图4所示:依托泊苷作用0.5小时后PARP就被剪切,由成像图可以直观看到剪切体的条带(图4(A)),峰形图显示了2个条带的位置(图4(B))。由此可见,WES能检测微量的蛋白剪切体。
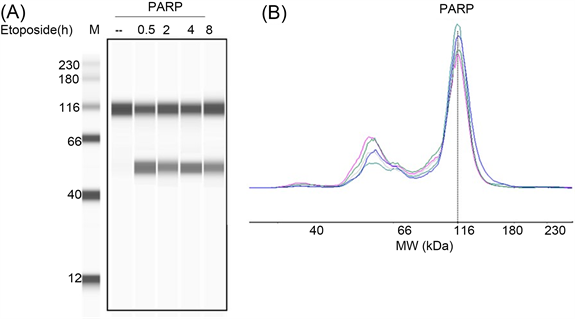
Figure 4. The splicing of PARP in human breast cancer cells MDA-MB-231 treated with Etoposide was detected by WES. (A) Lane map; (B) Peak charts
图4. WES检测依托泊苷处理人乳腺癌MDA-MB-231细胞后PARP的剪切。(A)泳道图;(B) 峰形图
4. 讨论
传统的蛋白免疫印迹(WB)是经典的蛋白检测方法,一直被科研人员所使用。检测过程包括蛋白裂解液的制备、蛋白的电泳分离及转印、封闭、一抗和二抗的杂交、化学发光显影。实验步骤多,过程繁琐,操作需要注意的细节较多。此外,传统WB在检测低分子量和高分子量蛋白质时,分离胶浓度及转膜时间对结果影响较大。对于一些分子量比较大或者比较小的蛋白质,转膜是否充分对结果影响较大:如果转膜时间过短,高分子量蛋白转膜不彻底;对小分子量蛋白质,转膜时间长则容易穿膜,而适宜的转膜条件需要反复摸索。对于一些珍贵样本(如:分选细胞、胚胎细胞、穿刺样本、激光显微切割样本等),如果蛋白含量较低,检测尤其困难。
与WB相比,WES检测中,蛋白质在凝胶柱中被电泳分离后,抗体分子与检测的抗原分子直接杂交,省去了转膜的过程,避免了转膜效率对实验结果的影响。当两种分子的分子量差异较大时,将靶蛋白和内参对照进行同时检测,结果准确性更高。WES分析中,对蛋白质的浓度和抗体的稀释度要求更高,而且WES分析的相对成本较高,为了获得理想的检测结果和节约实验成本,需要使用传统WB对抗体的使用浓度进行初步摸索,然后根据WB中的抗体的最适浓度确定WES中一抗的稀释倍数。
WES相比传统WB,无需制胶、无需转膜,安全环保;3小时左右获得结果,缩短实验优化时间;全自动化,无需值守,效率更高,可进行多重检测;可以检测低至0.5 μg的蛋白量,对于来源不易的样本,更节省样品;分子量可跨度2~440 KD;实验流程标准化,具有可重复性。由此可见,在有条件的实验室,WES检测特异性蛋白质的方法值得推广。
基金项目
国家自然科学基金项目(No. 81971330);陕西省重点研发计划(No. 2017KW-059)。
NOTES
*通讯作者。