摘要:
目的:建立测定利巴韦林片溶出曲线测定方法,并比较不同厂家利巴韦林片溶出行为的一致性。方法:溶出试验采用《中国药典》四部通则0931第二法(桨法),以盐酸溶液(pH 1.2)为溶出介质,搅拌转速为50 rpm;检测方法采用高效液相色谱法,用磺化交联的苯乙烯–二乙烯基共聚物的氢型阳离子交换树脂为填充剂的色谱柱,以水(用稀硫酸调节pH值至2.5 ± 0.1)为流动相;流速为1.0 mL/min,检测波长为207 nm。结果:同厂家不同批次之间的溶出曲线一致性较好,说明制剂工艺相对稳定。但是,不同厂家利巴韦林片溶出行为有明显差异,溶出曲线一致性不好,说明国内不同厂家生产的利巴韦林片处方、工艺不同,质量差异较大,有待提高。结论:试验结果显示本研究建立的试验方法可为利巴韦林片的溶出度测定提供实验基础和理论参考,可用于利巴韦林片的质量评价。
Abstract:
Objective: To establish a method for determining the dissolution curve of ribavirin tablets and compare the consistency of dissolution behavior of ribavirin tablets from different manufacturers. Methods: The second method (paddle method) of general rule 0931, Part IV of Chinese Pharmacopoeia was used for dissolution test, Hydrochloric acid solution (pH 1.2) was used as the dissolution medium, and the stirring speed was 50 rpm; the detection method was high performance liquid chromatography (HPLC). The column was filled with sulfonated cross linked styrene divinyl copolymer hydrogen cation exchange resin, and the mobile phase was water (adjust pH to 2.5 ± 0.1 with dilute sulfuric acid). The flow rate was 1.0 ml/min, and the detection wavelength was 207 nm. Result: The dissolution curves of different batches from the same manufacturer were consistent, indicating that the preparation process was relatively stable. However, the dissolution behavior of ribavirin tablets from different manufacturers is obviously different, and the consistency of dissolution curve is not good, which indicates that the formulation and process of ribavirin tablets from different manufacturers in China are different, and the quality of ribavirin tablets is quite different, which needs to be improved. Conclusion: The results showed that the method established in this study can provide experimental basis and theoretical reference for the dissolution determination of ribavirin tablets, and can be used for the quality evaluation of ribavirin tablets.
1. 前言
利巴韦林片为国家基本药物目录收载品种,国家医保药品。利巴韦林(Ribavirin)又名病毒唑(Virazole)、三氮唑核苷等,化学名称:1-β-D-呋喃核糖基-1H-1,2,4-三氮唑-3-羧酰胺。是人工合成的广谱强效核苷类抗病毒药物,临床主要用于呼吸道合包病毒引起的病毒性肺炎与支气管炎,皮肤疱疹病毒感染等 [1]。常见的不良反应有贫血、乏力等,停药后即消失。较少见的不良反应有疲倦、头痛、失眠、食欲减退、恶心、呕吐、轻度腹泻、便秘等,并可致红细胞、白细胞及血红蛋白下降。不过利巴韦林片大剂量应用可致心脏损害,对有呼吸道疾患者可致呼吸困难、胸痛等 [2] [3]。利巴韦林片质量标准始载于《卫生部药品标准》二部第六册,《中国药典》2000年版开始收载该品种,至《中国药典》2020年版其质量标准在不断优化和完善。现行标准《中国药典》2020年版二部利巴韦林片剂检查项目中没有溶出度检查的要求。而溶出度是固体制剂的重点评价项目,该指标是仿制药与原研产品比较的重要评价项目。本研究收集到的利巴韦林片样品均为素片,根据标准检验得知,崩解时限均在8分钟以内,基本在胃内完全崩解,同时参考大量有关资料 [4] - [10],经过多次试验,模拟利巴韦林片在胃内的溶出情况,建立了利巴韦林片在pH 1.2盐酸溶液中的溶出度分析方法。实验结果表明该方法准确、简单、快捷、重现性好。
2. 材料与仪器
2.1. 实验材料
利巴韦林对照品(批号140629-201703,中国食品药品检定研究院)、色谱乙腈(天津大茂化学试剂),其他试剂均为分析纯,样品为“山东省药品质量风险监测——利巴韦林片专项”抽检品种,规格均为0.1 g。
2.2. 实验仪器
天大天发ADFC12AD溶出仪;METTLER AB135-S电子天平;岛津LC-20AT高效液相色谱仪。
3. 方法与结果
3.1. 溶出试验条件
试验方法:照溶出度测定法(四部通则0931 第二法 桨法)。
溶出仪型号:天大天发ADFC12AD。
溶出介质及用量:pH 1.2盐酸溶液900 ml为溶出介质。
温度:37 ± 0.5℃;转速:50转/分。
取样时间:2、5、10、20、30分钟。
3.2. 溶出量分析方法
3.2.1. 色谱条件与系统适用性试验 [11]
高效液相色谱仪型号及编号:岛津LC-20AT高效液相色谱仪。
电子天平型号及编号:METTLER AB135-S电子天平。
色谱柱:Xtimate Sugar-H柱 7.8 × 300 mm 5 μm 柱温:30℃。
流动相:水(用稀硫酸调节pH值至2.5 ± 0.1)。
检测波长:207 nm;流速:1.0 ml/min;进样量:10 μl。
3.2.2. 系统适用性试验
理论板数按利巴韦林峰计算应不低于2000。
3.2.3. 溶液制备方法
1) 对照品溶液的制备:精密称取利巴韦林对照品约10 mg,置100 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
2) 供试品溶液的制备:取溶出液续滤液即得。
3.2.4. 线性范围考察
取3.2.3的1)项下利巴韦林对照品溶液,分别进样1 μl、2 μl、4 μl、8 μl、10 μl,分别注入液相色谱仪,记录色谱图,用峰面积(A)对浓度(C)进行回归分析,结果表明,在10.86~108.6 μg/mL浓度范围内线形关系良好,结果见表1。

Table 1. Standard curve of dissolution of ribavirin
表1. 溶出度利巴韦林标准曲线
3.2.5. 精密度试验
取供试品溶液,在测定条件下进样10 µL,连续测定5次,利巴韦林峰面积的RSD均为1.0%,结果表明精密度良好,符合分析要求。
3.2.6. 稳定性试验
取“3.2.3”的2)项下一批次样品30分钟溶出液一份供试品溶液,按“3.2.1”项下色谱条件下,分别在0 h、1 h、2 h、4 h、8 h、12 h、24 h测定1次。测定供试品中利巴韦林的含量,以观察供试品溶液在检测过程中待测成分的稳定性。试验结果表明供试品溶液在24小时内稳定性良好,能够满足测定需要。
3.2.7. 加样回收试验
取“3.2.3”的2)项下一批次样品(山东,批号:1D2002008) 30分钟溶出液一份供试品溶液,加入适量对照品溶液(0.1086 mg/ml),制成低、中、高三个不同浓度的供试品溶液各2份,分别测定其含量,计算平均回收率为98.6%,RSD为0.7% (n = 6),结果见表2。试验结果表明,该方法准确度符合规定。

Table 2. Results of sample recovery test (n = 6)
表2. 加样回收试验结果(n = 6)
3.3. 溶出曲线测定
对不同厂家样品进行测定,分别按“3.1”项下方法进行溶出试验,按“3.2.3”项下方法制备对照品和供试品溶液,按“3.2.1”项下色谱条件测定,按外标法以峰面积计算含量。不同厂家利巴韦林片样品溶出曲线,取同厂家3个不同批次的测定结果平均值做溶出曲线图,结果见图1。通过试验测得的溶出曲线测定结果可以看出,不同厂家利巴韦林片溶出时限比较短,大多数批次样品5分钟即溶出了80%,同厂家不同批次之间的溶出曲线一致性较好,说明制剂工艺相对稳定。但是,不同厂家利巴韦林片溶出行为有明显差异,溶出曲线一致性不好,说明国内不同厂家生产的利巴韦林片处方、工艺不同,质量差异较大,有待提高。其中一批样品30分钟平均溶出量不足60%,处方和制剂工艺有可能存在不足。
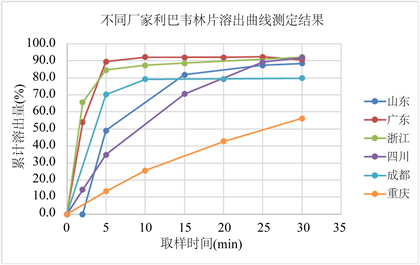
Figure 1. Dissolution curve of ribavirin tablets from different manufacturers
图1. 不同厂家利巴韦林片样品溶出曲线
4. 讨论
1) 溶出度是固体制剂的重点评价项目,该指标是仿制药与原研产品比较的重要评价项目。现行标准《中闻药典》2020年版二部中利巴韦林片剂检查项目中没有溶出度检查的要求,本研究收集到的利巴韦林片均为素片,崩解时限均在8分钟以内,基本在胃内完全崩解,参照相关文献报到建立了利巴韦林片在pH 1.2盐酸溶液中的溶出度分析方法。
2) 因为没有购买到利巴韦林片的原研制剂,无法判断是否与利巴韦林片的原研制剂生物等效。国内制剂溶出时限比较短,大多数批次样品5分钟即溶出了80%。通过试验测得的溶出曲线测定结果可以看出,同厂家不同批次之间的溶出曲线一致性较好,说明制剂工艺相对稳定。但是,不同厂家利巴韦林片溶出行为有明显差异,溶出曲线一致性不好,说明国内不同厂家生产的利巴韦林片处方、工艺不同,质量差异较大,有待提高。其中一批样品30分钟平均溶出量不足60%,处方和制剂工艺有可能存在不足。
3) 本文参考国内外有关溶出度测定方法的文献资料和多次试验,建立了本实验方法,实验结果显示本研究可为利巴韦林片的溶出度测定提供实验基础和理论参考,可用于利巴韦林片的质量评价。