1. 引言
随着稀土在不同地区的广泛应用,其消耗量逐年增加,而中国的稀土消耗量更是居于世界第一。在稀土的应用过程中,含有稀土元素的固体废料会随着稀土在各领域应用的增加而不断增多。未经处理的稀土废料中仍含有许多稀土元素形成的稀土化合物,稀土在地球上属于不可再生资源,其总量是不变的,随着不断地开采,储量会越来越少。因此,对稀土固体废弃物的综合回收进行二次利用具有重要的意义,这也是一种对资源进行保护的手段 [1]。废弃物品资源回收是循环经济的重要组成部分,将废弃物品转化为资源可以减少垃圾的产生同时也实现了资源的合理利用,这也是一个社会发展必然的选择 [2]。稀土资源是一种不可再生资源,随着各个国家对于稀土矿的大规模开采应用,稀土终会被耗尽,而工业产生的含稀土元素的废料未得到妥善的处理,不仅对环境有很大的危害同时也是一种资源的巨大浪费。现今对于含稀土的废料的处理主要采用湿法冶金,利用其对稀土元素进行回收,但存在回收不彻底、回收过程产生大量酸度较高的废水等环境问题 [3]。
氢氧化镁是一种常见纳米材料,常被应用于吸附、阻燃、烟气脱硫等领域,总体来说我国镁资源比较丰富,除水镁石、菱镁矿等含镁矿藏以外,海水以及卤水中亦含有丰富的镁资源,特别是我国青海湖和柴达木胡含有丰富的镁资源,为氢氧化镁的制备提供了丰富的原材料 [4]。吸附法是一种操作简单、对目标离子具有很好的提取效果的一种方法。本文探究了初始浓度、pH、温度、固液比等条件对吸附效果的影响,通过动力学、热力学理论模型计算,确定吸附机理,为氢氧化镁吸附铕离子工业化提供理论基础。
2. 材料与仪器
2.1. 实验试剂
氢氧化镁(实验室自制);氯化铕(阿拉丁试剂有限公司);氢氧化钠(成都科龙化学品有限公司)盐酸(四川西陇科学有限公司)。药品和试剂均为分析纯级。
2.2. 实验仪器
SP-752PC紫外分光光度计(上海光谱仪器有限公司);DF-101S集热式恒温水浴锅(巩义予华仪器有限责任公司);85-1A型磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);PHB-5笔式pH计(杭州奥立龙仪器有限公司)。
3. 实验方法
3.1. 吸附实验
取60 mL Eu3+溶液置于100 mL烧杯中,加入B2型磁力搅拌子置于磁力搅拌器上,准确称量纳米氢氧化镁样品20 mg加入烧杯中,开始搅拌并计时,搅拌时间分别为10、20、30、60、90、120、150、200、250、300分钟时取上层液体4 mL离心,得到上清液另存。分别测定溶液中铕离子浓度,计算氢氧化镁对铕离子的吸附量及去除率,计算公式如下所示。
(1)
(2)
(3)
式中:
为t时刻吸附剂对溶液中Eu3+的吸附量,mg/g;
为吸附达到平衡时吸附剂对溶液中Eu3+的吸附量,mg/g;
为溶液中Eu3+的初始浓度,mg/L;
为t时刻溶液中Eu3+的浓度,mg/L;
为吸附达到平衡时溶液中Eu3+的浓度,mg/L;V为吸附时Eu3+溶液的体积,mL;m为吸附剂氢氧化镁的用量,mg;A为溶液中Eu3+的去除率,%。
3.2. 动力学热力学模拟
1) 热力学模拟
在其他条件不变的情况下,以吸附温度为唯一改变条件,进行系列吸附实验,判断温度对氢氧化镁的吸附能力的影响,并进行热力学常数计算。根据范特霍夫方程便可算出热力学平衡常数Kd,再结合其与反应吉布斯自由能之间的关系就能得出其他热力学常数,通过这些热力学常数来判定吸附反应的方向,具体公式如下所示 [5]。
(4)
(5)
(6)
(7)
式中:Kd为分配系数;C0为铕离子的初始浓度,mg/L;Ce为吸附平衡时,溶液中铕离子的浓度,mg/L;R为理想气体常数,其值为8.3141 × 10−3,KJ/mol∙K;T——吸附时的开尔文温度,K;
为反应的吉布斯自由能变,KJ/mol;
为反应的焓变,KJ/mol;
为反应的熵变,KJ/mol·K。
2) 动力学模拟
氢氧化镁对铕离子的吸附速率会随着时间的增加而降低,因氢氧化镁的表面的吸附位点会逐渐被占据,直至所有吸附位点完全被占据,最终达到吸附平衡,设置系列时间点后计算其吸附量,进行准一级动力学方程、准二级动力学方程以及颗粒扩散模型进行拟合分析,为进一步探究其吸附机理提供有效理论 [6]。具体公式如下所示。
准一级方程:
线性:
(8)
非线性:
(9)
准二级方程:
线性:
(10)
非线性:
(11)
式中:t为吸附时间,min;qe为吸附平衡时氢氧化镁对铕离子的吸附量,mg/g;qt为t时刻氢氧化镁对铕离子的吸附量,mg/g;k1为拉格朗日准一级动力学方程常数,min−1;k2为拉格朗日准二级动力学方程常数,g∙(mg/min)。
4. 结果分析与讨论
4.1. pH对吸附效果的影响
pH对铕离子的吸附效果如图1所示,当pH < 4.5时,吸附效果很差,此时溶液中铕元素全是以Eu3+离子形式存在,不利于与氢氧化镁形成化学键,且当溶液处于强酸性条件下时,溶液中存在大量的H+,易于氢氧化镁反应从而阻碍铕离子的吸附。而当pH > 6时,铕元素在溶液中以EuOH2+、Eu(OH2)+、Eu(OH)3 (aq)和
的结构存在 [7],更易与氢氧化镁形成氢键利于吸附,故本实验的pH控制在6为最佳。

Figure 1. Influence of pH on adsorption effect
图1. pH对铕离子吸附效果的影响
4.2. 温度对吸附效果的影响及热力学计算
从图2我们可以看出,在初始浓度小于500 mg/L时,改变吸附温度,纳米氢氧化镁对铕离子的吸附量无较大变化,这可能是由于在初始浓度较低的情况下,氢氧化镁表面的吸附位点足够多,温度对其吸附的影响更小一点。铕离子浓度大于500 mg/L时,纳米氢氧化镁对铕离子的吸附量随着温度的增加,吸附量有降低的趋势,说明温度升高不利于氢氧化镁对铕离子吸附的进行,氢氧化镁对铕离子的吸附过程属于放热过程,低温更加有利于氢氧化镁对铕离子的吸附。
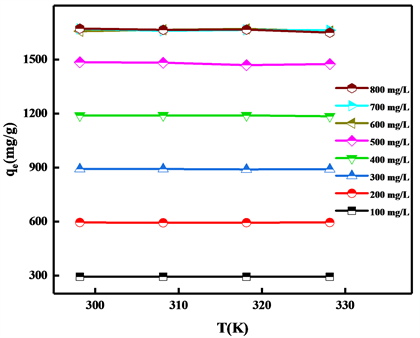
Figure 2. Influence of temperature on adsorption effect
图2. 温度对吸附效果的影响
通过公式(4)可以算得Kd,然后lnKd对1/T进行线性拟合作图,如图3所示,可以根据截距及斜率算得熵变
以及焓变
,根据公式(5)、(6)计算吉布斯自由能
,计算结果如表1所示,根据表中数据可以看出,无论吸附温度的高低,算得的
的值均为负值,说明纳米氢氧化镁对铕离子的吸附过程是自发进行的,由lnKd对1/T进行线性拟合方程的截距算得
值为负,说明纳米氢氧化镁对铕离子的吸附属于一个放热过程,与实验结果亦相符,由lnKd对1/T进行线性拟合方程的斜率算得
的值为负,说明整个吸附过程系统的混乱度随着吸附的进行而减小。
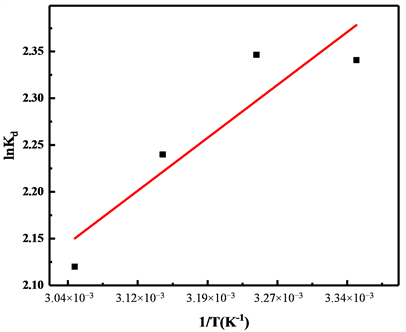
Figure 3. The relationship between lnKd and1/T
图3. lnKd对1/T作图

Table 1. Thermodynamic constant for the adsorption of Eu3+ by magnesium hydroxide
表1. 氢氧化镁对铕离子吸附的热力学计算
4.3. 吸附时间对吸附效果的影响及动力学模拟
随着时间的变化氢氧化镁对铕离子的吸附过程如图4所示。可以看出其吸附量呈现出先快速增加,后缓慢增加,在300 min后不再吸附,达到吸附平衡,此时的吸附量为1678.22 mg/g。这是由于在吸附的初始阶段,纳米氢氧化镁表面吸附位点较多,且溶液中铕离子浓度较高,其吸附速率较快。60 min后其外表面的吸附位点被铕离子占满,随着不断的震荡搅拌,层状结构被逐渐破坏,暴露出更多的吸附位点,但是此时溶液中铕离子浓度有所降低,故氢氧化镁对铕离子的吸附呈现出一个缓慢的过程,直至达到吸附平衡,铕离子占满氢氧化镁表面所有吸附位点。从图上来看,其吸附速率较快,满足动力学模拟条件。在后续实验中吸附时间选择300 min。
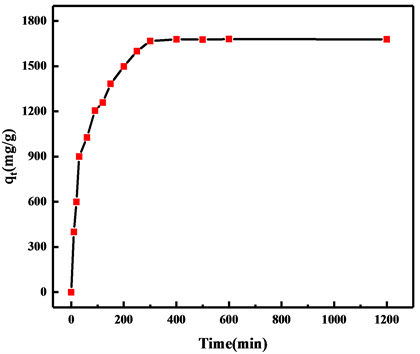
Figure 4. Effect of time on adsorption capacity
图4. 吸附时间对吸附量的影响
对吸附数据按照公式(8)至(11)进行准一级和准二级动力学模拟,其曲线拟合结果如图5所示,拟合参数如表2所示。对比两次模拟结果,可以看出准一级动力学模型的相关参数较准二级动力模型的相关系数(R2)更高一些,说明氢氧化镁对铕离子的吸附过程更加符合准一级动力学模型,而从两种模型模拟结果来看,都具有较高的相关系数,则氢氧化镁对铕离子的吸附过程可能物理吸附化学吸附两种吸附方式都存在,但从相关系数(R2)来看,物理吸附是主要的吸附方式。
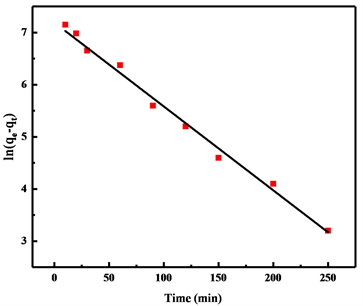 (a)
(a) 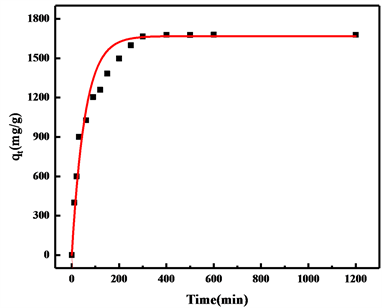 (b)
(b) 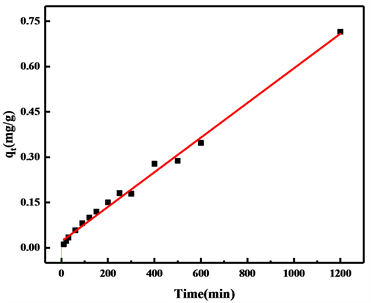 (c)
(c) 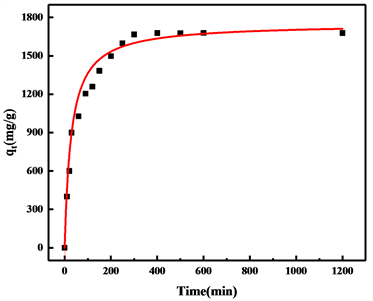 (d)
(d)
Figure 5. (a) (b) Linear and nonlinear of the pseudo-first-order kinetic models; (c) (d) Linear and nonlinear of the pseudo-second-order kinetic models
图5. (a) (b) 准一级动力学模型线性和非线性拟合曲线;(c) (d) 准二级动力学模型线性和非线性拟合曲线

Table 2. The pseudo-first-order and pseudo-second-order kinetic model constants for adsorption of Eu3+
表2. Eu3+吸附的准一级与准二级动力学模型拟合参数
4.4. 吸附前后表征分析
样品的电子扫描显微镜图如图6所示。
从图6(a)、图6(b)可以看出,氢氧化镁呈明显的层状结构,层状表面光滑,层层之间重叠一起,图6(c)、图6(d)中可以明显看到氢氧化镁表面出现很多絮状物,絮状物为铕离子吸附在氢氧化镁表面。说明氢氧化镁对铕离子的吸附可能为物理吸附,与动力学模拟结果一致。

Figure 6. The SEM images (a) (b) before the adsorption; (c) (d) after the adsorption
图6. 氢氧化镁SEM图(a) (b)吸附前;(c) (d)吸附后
5. 结论
当溶液pH控制在6.0左右时,是氢氧化镁对铕离子吸附的最佳pH,温度对吸附量的影响较小,但低温更有利于吸附的进行,通过热力学计算得到
= −6.185 KJ/mol,
= −0.9727 J/mol∙K,各个温度下
均为负值,说明氢氧化镁对铕离子的吸附过程是一个自发的放热过程,随着吸附的进行,整个系统的混乱度降低。通过动力学模拟发现,氢氧化镁对铕离子的吸附过程更加符合准一级动力学模型,说明氢氧化镁对铕离子的吸附过程更倾向于物理吸附,且达到吸附平衡的时间为300 min。
NOTES
*通讯作者。