1. 引言
愈疡胶囊中药复方制剂是四川省凉山彝族自治州第二人民医院院内制剂。由山药与蜂胶等药物组成。愈疡胶囊剂型工艺成熟,用于临床近三十年,从临床应用到实验研究都证实该胶囊是安全有效的。愈疡胶囊制剂具有泄壅滞、逐痰积、消肿毒、排脓腐和生肌健脾功能。主治乳癖(乳腺增生)、腹部包块(卵巢囊肿)、附骨疽(急、慢性骨髓炎)、痈疽(蜂窝组织炎)、痨瘵(结核)、窦道、瘘管、跌打肿痛和术后感染 [1]。前期研究已经证实愈疡胶囊能够治疗乳腺增生和抗菌消炎等作用。但其最佳抑菌浓度以及对细菌损伤机制尚不清楚,此外,愈疡胶囊在体内的抗菌修复过程也有待进一步考证。本研究选择杯碟法实验确定药物最佳浓度,通过建立烫伤感染大鼠模型、细菌铺板、皮肤组织炎症因子含量、H&E染色和伤口愈合速率等综合评价愈疡胶囊对铜绿假单胞菌(P. aeruginosa)的抑菌行为以及抗菌促修复效果,以期为组方的优化及为其临床应用安全提供一定的理论支撑。
2. 材料与方法
2.1. 实验药物
愈疡胶囊(1 g药粉等同于原生药1.5 g),规格:0.45 g/粒;批号:130528,批准文号:川药制字Z 20080094。由四川凉山彝族自治州第二人民医院提供。阿莫西林胶囊,中诺药业有限公司,国药准字:H 13021770。
2.2. 动物与细菌
检疫合格的SPF级雄性SD大鼠50只,180~220 g,由四川省医学科学院实验动物研究所提供,合格证号:SCXK(川)2019-24。动物实验通过西南交通大学伦理委员会批准,伦理批准号:SWJTU[K]字2019-031。P. aeruginosa (ATCC 27853)购买于中国微生物菌种保藏管理中心。
2.3. 试剂
胰蛋白胨、酵母提取物、琼脂糖购自Sigma-Aldrich化学试剂有限公司(批号:T139519、Y110517、A118882);氯化钠、氢氧化钠购自成都市科龙化工试剂厂(批号:20100927、20101108);苏木精–伊红(H&E)购自北京百灵威科技有限公司(批号:LM10N13);TNF-α、IL-6、IL-10以及TGF-β测定(ELISA)试剂盒购自上海茁彩生物科技有限公司。
2.4. 仪器
扫描电子显微镜(SEM,Quanta 200,美国赛默飞公司);光学显微镜(Olympus IX51-FL,日本奥林巴斯仪器公司);压力蒸汽灭菌锅(YX-280,合肥华泰医疗器械有限公司);电热恒温培养箱(SPX-250,上海善志仪器设备有限公司);水浴恒温振荡器(HTZ-82A,常州菲普实验仪器厂);去离子水纯化系统(Milli-Q biocle,上海优普科学仪器有限公司);酶标仪(Elx-800,美国Bio-Tek公司)。
3. 方法
3.1. 体外抑菌实验
通过杯碟法(抗生素效价评价的标准方法之一)考察不同浓度梯度愈疡胶囊对P. aeruginosa的抑菌效果,每组设3个平行样。通过单克隆菌落挑取P. aeruginosa并接种于新鲜无菌肉汤培养基中,在恒温孵箱(37℃, 190 rpm/min)中培养至对数生长期,通过测量600 nm波长下的吸光度值(OD600)来监测细菌浓度,将菌悬液加入培养基中。以0.05 g/mL为梯度,设立0.05 g/mL、0.10 g/mL、0.15 g/mL、0.20 g/mL和0.25 g/mL共5个药物浓度组考察抑菌实验,分别加入放置于培养基上的牛津杯至满,37℃恒温孵育36 h后测定抑菌圈直径大小,10%乙醇作为空白对照组,比较实验组与空白对照组抑菌圈直径,并根据其比值与药物浓度关系绘制曲线,从而得到最佳抑菌浓度。
3.2. 愈疡胶囊对铜绿假单胞菌损伤机制研究
取50 µL细菌悬液(5 × 107 CFU/mL)加入96孔板内,再加入150 µL愈疡胶囊溶液(终浓度0.25 g/mL),将孔板置于恒温摇床孵育12 h。每个浓度梯度设定五个平行样。收集菌液,离心(3500 rpm/min, 5 min),用PBS洗涤细菌沉淀三次,随后加入戊二醛(2.5% w/w)固定4 h。离心去掉上清液,洗涤,用20%~100% (v/v)乙醇水溶液梯度脱水(每次15 min),取10 µL菌液滴于洁净硅片上,自然干燥后喷金。以PBS组作为阴性对照组,采用SEM观察细菌表面形貌。
3.3. 大鼠烫伤感染模型
大鼠被随机分为5组:生理盐水模型对照组、阿莫西林阳性对照组以及愈疡胶囊高、中、低剂量治疗组(10只/组)。腹腔注射10%水合氯醛600 µL,待大鼠麻醉后,脱除毛发,用100℃的砝码烫伤大鼠背部15 s,随后滴加20 µL的P. aeruginosa菌液(1 × 107 CFU/mL)并涂抹均匀。感染一天后,大鼠背部出现糜烂,脓肿即为建模成功。
3.4. 给药方式
采取灌胃方式给予高、中、低剂量愈疡胶囊(630 mg/kg、315 mg/kg和157.5 mg/kg),阿莫西林(125 mg/kg)和生理盐水生(10 mL/kg)。每天给药一次,持续8天。
3.5. 愈疡胶囊体内清除细菌效果
在给药3天后,每组随机选择3只大鼠处死,取感染皮肤组织,称重后匀浆,取匀浆上清液,用无菌PBS稀释100倍,取20 µL涂布于LB琼脂培养板上,16 h后统计培养板上细菌菌落数。依据下列公式计算大鼠烫伤组织中的细菌数:
3.6. 愈疡胶囊体内清除细菌效果
取大鼠烫伤皮肤组织匀浆离心,使用ELISA试剂盒测量炎症因子含量,通过酶标仪在450 nm处测大鼠烫伤皮肤组织中TNF-α、IL-6、IL-10以及TGF-β含量。
3.7. 愈疡胶囊体内清除细菌效果
从给药第2天开始,观察记录动物一般体征、积脓、红肿和溃疡等表现,并分级评分。停止给药后处死动物,取皮肤组织,标本按病理检验SOP程序进行脱水、修剪、包埋、切片、H&E染色和封片等处理后镜检。于显微镜下观察溃疡、炎症细胞浸润和成纤维细胞增生等病理学表现。皮肤组织病变分级标准见表1。同时隔天测量伤口面积,计算大小并统计。

Table 1. Judgment criteria for skin tissue prediction
表1. 皮肤组织病变判断标准
3.8. 统计学分析方法
采用SPSS 17.0对数据进行标准化统计分析,结果以均数±标准差表示,两组间数据采用独立样本T检验,P < 0.05表明差异有统计学意义。
4. 结果
4.1. 体外抑菌实验结果
10%乙醇溶剂具有一定的抑菌效果,但仅限于乙醇接触区域,且透明圈(抑菌圈)一致为牛津杯内径0.6 cm,对各组抑菌圈直径大小进行计数统计。空白组与各药物浓度组抑菌圈直径大小统计结果见表2,愈疡胶囊浓度增加至0.15 g/mL时,抑菌圈平均直径达到1.3108 cm,表现出优秀的抑菌效果,当药物浓度增加至0.2 g/mL和0.25 g/mL,抑菌圈直径变化不显著,抗菌效果不再发生明显变化。

Table 2. Statistics of antibacterial effects of Yuyang Capsules at various concentrations (n = 3)
表2. 各浓度下愈疡胶囊抑菌效果统计(n = 3)
4.2. 愈疡胶囊最佳抑菌浓度
根据各组抑菌圈直径同空白对照组抑菌圈直径的比值与药物浓度的关系,绘制药物浓度与抑菌效果曲线图,结果如图1,愈疡胶囊在0.05~0.15 g/mL之间对P. aeruginosa的抑菌效果呈剂量依赖性,在超过0.15 g/mL时抑菌效果逐渐趋于平稳,且实验效果在三组平行实验中均呈现上述趋势。三组平行实验RSD在0.37%~0.56%之间,远低于3%,表明该实验结果具有较好的稳定性和较高的可信度。通过药物浓度与抑菌圈比值所作的曲线图,得到愈疡胶囊最佳抑菌药效浓度为0.175 g/mL。
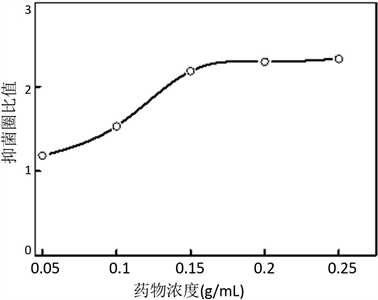
Figure 1. The relationship between drug concentration and the ratio of inhibition zone
图1. 药物浓度与抑菌圈比值变化关系
4.3. 愈疡胶囊对P. aeruginosa膜的损伤
为进一步探讨愈疡胶囊的抗菌机制,利用SEM观察P. aeruginosa形态变化。如图2所示,未经治疗的细菌展现出光滑的表面,完整无缺的菌膜结构。而愈疡胶囊治疗会导致P. aeruginosa表面粗糙,出现皱褶、凹陷、扭曲以及一定程度上的膜损伤。该实验结果表明愈疡胶囊对膜的破坏可能是抑制P. aeruginosa的机理之一。

Figure 2. Morphology of Pseudomonas aeruginosa treated with PBS and Yuyang capsule
图2. PBS和愈疡胶囊处理后的铜绿假单胞菌的形貌图
4.4. 感染组织菌落计数结果
通过涂布平板法观察给药3天后愈疡胶囊对大鼠皮肤组织中细菌清除效果。不同治疗组处理后皮肤组织中的细菌铺板结果如图3所示。阳性对照组和高剂量愈疡胶囊组的琼脂板上菌落数明显减少。
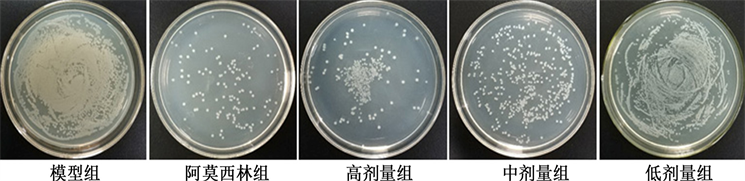
Figure 3. Photograph of bacterial plate colonies in infected tissues
图3. 感染组织细菌平板菌落数图
组织中细菌残余数量计算结果如表3所示。经PBS治疗后小鼠皮肤内细菌数约为3.505 × 106 CFU,而高、中、低剂量愈疡胶囊治疗后皮肤内细菌数会减少,分别约为3.389 × 105、1.392 × 106和3.137 × 106 CFU。与PBS组相比,愈疡胶囊治疗后皮肤组织中活菌数量呈现出数量级降低。与阿莫西林组相比,高剂量愈疡胶囊表现出更优秀的抗菌效果,这些结果表明愈疡胶囊能够有效抑制P. aeruginosa,菌落数随给药浓度增大逐渐减少,可以作为抗生素的潜在替代者。

Table 3. Count of bacterial of infected tissue
表3. 感染组织细菌计数
4.5. 大鼠皮肤组织中炎症因子含量测定
通过ELISA试剂盒测量大鼠烫伤皮肤组织中炎症因子含量如表4所示。模型组中,细菌感染导致伤口组织中表达大量促炎因子TNF-α和IL-6,表明模型组中感染组织发生明显炎症症状。经愈疡胶囊和阿莫西林治疗后,促炎因子TNF-α和IL-6表达下降,炎症细胞因子分泌减少会在一定程度上减轻炎症。而同阿莫西林组一样,典型的抗炎因子IL-10和TGF-β因为愈疡胶囊的治疗显示出高表达,高于模型组,且随着药物剂量增加而升高,抗炎因子的较高表达表明了愈疡胶囊在体内具有潜在的抗炎作用。这些炎症相关因子的表达证实了愈疡胶囊可能是通过NF-kB通路调控组织修复的。因此,愈疡胶囊能够缓解烫伤感染伤口的炎症反应加速创伤愈合。

Table 4. Inflammatory factor content of infected tissue(x ± s, n = 3, pg/mL)
表4. 感染组织炎症因子含量(x ± s, n = 3, pg/mL)
4.6. 大鼠皮肤组织中炎症因子含量测定
H&E染色结果如图4所示,PBS模型组:表皮缺失,皮下组织坏死、红肿,组织结构不清,皮下血管显著充血、水肿并伴有炎症相关细胞(巨噬,中性粒)浸润,皮下组织疏松、水肿、增宽,结缔组织溶解,残留组织形成网状结构,多量嗜中性、嗜酸性粒细胞浸润,坏死区域较大;阿莫西林组:较PBS模型组症状略轻,肉芽组织形成区域较大,大部分动物皮肤组织感染较轻,皮下在清除一些坏死脱离的物质及炎性残物;愈疡胶囊高剂量组:新生肉芽组织向表面生长,吞噬、溶解、消化、替代、清除坏死组织,向表面推进,大量创伤被结缔组织填充,切割伤口坏死边缘填平,残存有未完全修复创面,感染得到控制;愈疡胶囊中剂量组:病变程度基本同阿莫西林组;愈疡胶囊低剂量组:病变较重,基本同PBS模型组;病理学检验结果:动物病理组织观察,愈疡胶囊高剂量组治疗效果较好,对P. aeruginosa有抑制作用。评分统计结果如表5所示。结合评分根据统计学分析,愈疡胶囊组结果和其他组药效结果有显著性差异。

Figure 4. The results of microscopic examination of H&E staining
图4. H&E染色镜检结果

Table 5. Light microscope score statistics table
表5. 光镜评分统计表
计算大鼠烫伤感染伤口面积大小评价大鼠伤口愈合情况,如表6所示。治疗2天后,高剂量愈疡胶囊和阿莫西林治疗组的大鼠伤口面积明显减小,随治疗时间延长,高剂量愈疡胶囊治疗组伤口愈合面积愈合加快,在治疗的最后一天减小到15 mm2左右,效果优于阳性对照组。这与皮肤组织中炎症因子测量结果一致,表面愈疡胶囊能够有效清除细菌,调节组织炎症反应,促进伤口愈合。

Table 6. The result of skin healing of bacterial infection and scald model (x ± s, n = 3, mm2)
表6. 细菌感染烫伤模型皮肤愈合情况(x ± s, n = 3, mm2)
5. 讨论
P. aeruginosa是革兰氏阴性杆菌中的一种,其自身携带多种毒性因子 [2],分布范围广、感染率高 [3],是临床感染重要机会性致病菌之一,可引发肺炎、皮肤软组织感染、败血症和烫伤感染等多种严重感染性疾病 [4]。抗生素是临床上治疗细菌感染的有效方式,极大降低了细菌感染发病率和死亡率 [5]。但是抗生素的过度使用容易诱导细菌产生耐药性甚至引起超级菌出现 [6]。经统计,医院内感染患者中,耐药菌引起的占40%~60%,且治疗耐药菌病人的花费高达350亿美元 [7]。此外,抗生素还存在生物利用度低和一定毒副作用等问题。
植物中蕴含许多生物活性化合物,它们有超过40万种次生代谢产物 [8],这类抗菌剂通常具有低毒、无污染、高效且不易产生耐药性等优点 [9]。愈疡胶囊在治疗骨髓炎、蜂窝组织炎、化脓性中耳炎、鼻窦炎、术后感染、窦道、瘘管和肛周脓肿等具有良好效果。之前研究表明,愈疡胶囊具有调控大鼠体内激素分泌水平 [10],增强正常大鼠细胞免疫功能 [11] 等作用,与作用单一的西药抗感染剂不同,其对感染的疗效是强化生理效应、抑制细菌等综合作用的结果,显示出了良好的临床疗效 [12]。本论文探究了愈疡胶囊对P. aeruginosa的最佳抑菌药物浓度、膜损伤机制、烫伤感染动物模型皮肤组织菌落数、皮肤组织病理形态等体内外药效学。结果表明,愈疡胶囊对P. aeruginosa有显著抑制作用且通过破坏细菌膜的方式杀菌。愈疡胶囊在大鼠烫伤感染模型中能够清除体内细菌、诱导感染组织的炎症相关因子下调、减缓组织炎症、促进粒状组织形成来促进大鼠伤口愈合。为临床合理应用、组方优化和后续分子水平的杀菌机理研究提供了科学数据。
基金项目
感谢四川省科技厅项目:凉山彝族特色医药资源收集整理研究及医疗机构制研发创新平台建设(2017 SZYZF0012)提供资助。