摘要: 目的:检测NEK6在HepG2细胞中的定位,肝细胞肝癌组织与正常肝脏组织中的表达水平,分析其与临床病理学资料间的关系。方法:在HepG2细胞中转染pMCV-Nek6-Myc和pMCV-Nek6-Flag,应用间接免疫荧光法测定NEK6在HepG2细胞中的定位;应用RT-qPCR法检测47例肝细胞肝癌(HCC)组织与相应远癌旁组织(>1 cm)中NEK6 mRNA的表达水平;应用Western blot法检测该47例肝细胞肝癌组织与相应正常肝组织中NEK6蛋白的表达水平。收集并统计该组患者的临床病理学资料,包括性别、年龄、肿瘤大小、肿瘤数量(单个/多个)、血清AFP水平(≥400 ng/ml或<400 ng/ml)、Edmondson分级、纤维包膜、微血管侵犯(microvascular invasion, MVI)等,分析NEK6 mRNA表达水平与各临床病理特点的关系。配对样本应用配对t检验,单因素分析用卡方检验,多因素分析用二元Logistic回归分析,以P < 0.05认为结果有统计学意义。结果:免疫荧光实验显示,NEK6主要定位于HepG2细胞的细胞核中,在细胞质中也有少量存在;RT-qPCR结果显示,NEK6 mRNA在HCC中的表达量为(1.405 ± 0.472),显著高于正常肝组织中的表达量(1.133 ± 0.474),差异有统计学意义(t = 3.143, P = 0.0029);Western blot结果显示,NEK6蛋白在HCC中的表达量为(1.031 ± 0.193),显著高于正常肝组织中的表达量(0.906 ± 0.182),差异有统计学意义(t = 3.464, P = 0.0012)。结论:NEK6主要存在于HepG2细胞的细胞核中,在肝细胞肝癌中表达上调,微血管侵犯是Nek6表达水平的独立相关因素,可能作为肝癌预后不良的判断指标之一。
Abstract:
Objective: To detect the localization of NEK6 in HepG2 cells, the expression level of hepatocellular carcinoma tissues and normal liver tissues, and to analyze the relationship between NEK6 and clinicopathological data. Methods: HepG2 cells were transfected with pMCV-Nek6-Myc and pMCV-Nek6-Flag, and the localization of NEK6 in HepG2 cells was determined by indirect immunofluorescence method. RT-qPCR was used to detect the expression level of NEK6 mRNA in 47 cases of hepatocellular carcinoma (HCC) tissues and corresponding distant adjacent tissues (>1 cm). Western blot was used to detect the NEK6 protein expression levels in the 47 cases of hepatocellular carcinoma tissues and corresponding normal liver tissues. The clinical pathological data of this group of patients were collected and counted, including gender, age, tumor size, tumor number (single/multiple), serum AFP level (≥400 ng/ml or <400 ng/ml), Edmondson grade, fiber envelope , Microvascular invasion (microvascular invasion MVI), etc., to analyze the relationship between NEK6 mRNA expression level and various clinicopathological characteristics. Paired samples were tested by paired t test, chi-square test was used for univariate analysis, and binary logistic regression analysis was used for multivariate analysis. The results were considered statistically significant at P < 0.05. Results: Immunofluorescence experiments showed that NEK6 was mainly located in the nucleus of HepG2 cells, and a small amount in the cytoplasm; RT-qPCR results showed that the expression of NEK6 mRNA in HCC was (1.405 ± 0.472), which was significantly higher than that of normal liver tissue: the expression level in HCC (1.133 ± 0.474); the difference was statistically significant (t = 3.143, P = 0.0029); Western blot results showed that the expression level of NEK6 protein in HCC was (1.031 ± 0.193), which was significantly higher than that of normal liver. The expression in tissues (0.906 ± 0.182) has a statistically significant difference (t = 3.464, P = 0.0012). Conclusion: NEK6 mainly exists in the nucleus of HepG2 cells, and its expression is up-regulated in hepatocellular carcinoma. Microvascular invasion is an independent factor related to the expression of Nek6 and may be used as one of the indicators of poor prognosis of liver cancer.
1. 引言
肝癌是世界第七大常见恶性肿瘤,也是癌症死亡第二大常见原因 [1]。世界范围内每年有50万到100万新发病例,以亚洲、非洲为高发地区,而中国是目前肝癌罹患数最多的国家 [2]。肝细胞癌(Hepatocellular Carcinoma, HCC)是肝癌中最主要的病理类型,约占肝癌总体的75% [2]。早期肝癌多无典型症状,一经发现往往已是中、晚期,对化疗反应较差,预后不佳。早期识别肝癌预后不良的指标缺乏有效的生物标志物。NIMA最早是由Osmani等 [3] 在尼杜拉曲霉中发现的一种与细胞有丝分裂相关的基因。此后在高等哺乳类动物细胞中也发现了相似的基因,这类基因在结构和功能上与NIMA高度一致,被命名为Nek (NIMA-related kinase)。目前认为,Nek家族共有11个成员,其中Nek6是由李梅章等首先鉴定并测序的,该基因的逆转录DNA全长1590 bp,定位于人类9号染色体,是参与细胞有丝分裂的重要蛋白质 [4]。Rozita Adib等人 [5] 发现NEK6在“Ser-144”处磷酸化EML4,促进其在有丝分裂期间与微管分离,是有效的染色体融合所必需的。NEK6在肿瘤中的研究在近年来逐步深入。Nek6过表达拮抗p53诱导的人癌细胞衰老,Jee H.J.等 [6] 研究发现Nek6过表达可显著减少细胞周期阻滞于G1期和G2/M期,降低细胞周期蛋白B和cdc2蛋白水平对p53表达的影响。此外,在过度表达Nek6的细胞中,p53诱导的细胞内ROS水平的增加也受到抑制。这些结果表明,Nek6的表达下调是p53诱导的细胞衰老所必需的,并暗示了Nek6在肿瘤发生中的可能作用。Nek6在肝癌中的表达情况尚不完全清楚,本研究通过免疫荧光定位法检测Nek6在HepG2细胞中的位置,通过RT-qPCR及Western blot法测定Nek6在肝癌组织与相应的正常肝组织中mRNA及蛋白质的相对表达量,通过与临床病理学特征相结合,分析与Nek6表达相关的临床病理学特点。
2. 材料与方法
2.1. 一般资料
选取青岛大学附属烟台毓璜顶医院在2020年4月至2020年12月经手术切除、病理学诊断明确的肝细胞肝癌及相应的远癌旁组织(>1 cm)手术标本总计47例。所有标本均经2名资深病理科医师确认病理类型。收集该47例患者的临床病理学资料,包括性别(M 36例,F 11例)、年龄(<60 y 32例,≥ 60 y 15例)、肿瘤大小(<5 cm 37例,≥5 cm 10例)、肿瘤数量(单个42例,多个5例)、血清AFP水平(<400 ng/ml 12例,≥400 ng/ml 35例)、HBsAg (阴性9例,阳性38例)、Edmondson分级(I + II级19例,III级28例)、纤维包膜(有32例,无15例)、微血管侵犯(microvascular invasion MVI) (有34例,无13例)等。本研究取得患者知情同意,所有患者均为首次治疗,既往无其他恶性肿瘤病史,术前未接受过任何化疗、放疗、介入治疗及免疫治疗。本研究经烟台毓璜顶医院伦理委员会审批通过。
2.2. 实验材料、手术标本留取及主要仪器
HepG2细胞株取自烟台毓璜顶医院中心实验室;载体:pMCV-Myc、pMCV-Flag (美国Clontech公司);Nek6 cDNA序列(GenBank Access: NM_014397);小鼠抗c-Myc单克隆抗体、兔抗Flag多克隆抗体(美国Santa Cruz公司);荧光二抗:Triton X-100 (北京索莱宝公司);山羊抗鼠IgG (H & L)-Rhoda-mine、山羊抗兔IgG (H & L)-Rhodamine (上海翊圣生物科技有限公司);Nek6前向引物5’-AGAA GATCGAGCAGTGTGACTAC-3’,后向引物5’-TAGC ATAAGCCTTGACAGGTCAC-3’、内参(β-MG)前向引物5’-ATGAGTATGCCTGCCGTGTGAAC-3’,后向引物5’-AATGCCTGCACTTGAGGCTGAG-3’ (美国Invitrogen公司);pMCV-Nek6-Myc、pMCV-Nek6-Flag (实验室内构建);转染试剂:Lipofectamine2000、DAPI (美国Thermo公司);ECL显色试剂盒(美国Santa Cruz公司);共聚焦荧光显微镜(德国Leica公司);逆转录试剂盒(思科捷生物公司);Trizol (日本TaKaRa公司);TaqDNA聚合酶(美国Thermo公司);荧光定量PCR试剂盒(江苏abm公司);RIPA (上海碧云天);凝胶电泳设备(美国伯乐公司);兔抗人类Nek6单克隆抗体、小鼠抗β-tublin单克隆抗体(美国abcam公司);手术标本离体后立即留取肿瘤组织及距肿瘤边缘 > 1 cm的远癌旁组织,每例组织留取2份,迅速置于液氮中冷却至少10 min后取出,−80℃冻存备用。
2.3. 实验方法
2.3.1. 免疫荧光定位
HepG2细胞复苏、传代,构建pMCV-Nek6-Myc、pMCV-Nek6-Flag。将细胞株以2 × 105/well接种在经预先处理好的载玻片上,适当转染质粒,转染48 h后取出载玻片上的细胞,用PBS漂洗一次,用预冰的甲醇−20℃固定分钟,用1% Triton X-100室温处理15 min,然后用10%马血清(含1% BSA)封闭1 h,加一抗反应1 h,用PBS漂洗3次,加入带有荧光标记的二抗染色1 h,进行用共聚焦荧光显微镜观察、拍照。
2.3.2. RT-qPCR
用Trizol试剂一步法提取组织中总mRNA,按逆转录试剂盒说明书进行RNA逆转录。然后将所得产物cDNA进行PCR扩增。PCR的反应条件:预变性95℃,4 min,变性95℃,30 S,退火59℃,45 S,延伸72℃,30 S,共循环30次,最后72℃延伸5 min。以阈值循环(threshold cycle, Ct)值反映基因含量,通过2−ΔΔCt方法分别计算肝癌组织及相应远癌旁组织中目的基因的相对表达量。
2.3.3. Western blot
取标本约200 mg,加入液氮研磨均匀,再加入强效RIPA裂解液 + PMSF (1 mmol/L) 400 μL,冰上振荡裂解30 min后,12,000 r/min,4℃离心15 min,吸取上清,BCA法测定总蛋白浓度。按4:1比例加入5 × 上样缓冲液后,95℃加热5 min,自然冷却,SDS聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭1 h,并作为抗原稀释液,按1:1500稀释目的蛋白一抗(兔抗人类Nek6单克隆抗体,分子量约36-kDa)、1:2000稀释内参一抗(小鼠抗β-tublin单克隆抗体,分子量约55-kDa);封入杂交袋,4℃摇床过夜。次日TBST洗膜 × 3次后分别加入二抗,37℃孵育1 h,再经TBST洗膜 × 3后加入ECL显色剂,应用化学发光凝胶成像系统观察并分析目的蛋白的表达。所有检测重复2次,应用ImageJ软件对条带灰度值进行测量并计算目的蛋白条带的相对灰度值(目的蛋白灰度值/内参蛋白灰度值)。计算癌组织中Nek6的相对灰度值与相应癌旁组织中Nek6的相对灰度值之比(DR值)作为判断依据,认为DR值 ≥ 1.25为表达上调、<0.75为表达下调、1.25 > DR ≥ 0.75认为表达无显著差别。将该结果与临床病理学资料相结合进行单因素及多因素分析。
2.4. 统计学分析
计量资料采用均数 ± 标准差(
)表示。应用SPSS 23.0统计软件分析,计量资料组间比较采用配对t检验,计数资料组间比较采用
检验或Fisher精确概率法检验;多因素分析采用二元Logistic回归分析。所有统计结果均以P < 0.05认为差异具有统计学意义。
3. 结果
3.1. 免疫荧光实验
分别将Nek6构建到pCMV-Flag和pCMV-Myc载体上,记为pCMV-Nek6-Flag和pCMV-Nek6-Myc,并转染至HepG2细胞内,通过免疫荧光法检测转染稳定的细胞株表达显示Nek6在肝癌细胞中主要定位于细胞核中,细胞质中也有少量存在(图1(a)~(f))。


Figure 1. (a)~(h) Detection of Nek6 in HepG2 cells by immunofluorescence method (fluorescence microscope, 400×). (a) and (e) are HepG2 cells that do not show fluorescence; (b) shows the fluorescence images of green fluorescence with rabbit anti-Flag polyclonal antibody as primary antibody and goat anti-rabbit-green Rhodamine as secondary antibody. (c) and (g) show that the blue fluorescence is the DNA displayed by DAPI, and (d) is the superposition of (b) and (c). (f) shows the fluorescence images of red fluorescence with mouse anti-cMyc monoclonal antibody as the primary antibody and goat anti-mouse-red Rhodamine as the secondary antibody. (h) is the superposition of (f) and (g)
图1. (a)~(h)免疫荧光法检测HepG2细胞中Nek6在细胞中的定位(荧光显微镜,400×)。(a)、(e)为未显示荧光的HepG2细胞;(b)显示绿色荧光为兔抗Flag多克隆抗体为一抗、山羊抗兔-绿色Rhodamine为二抗的荧光图像,(c)、(g)显示蓝色荧光为DAPI显示的DNA,(d)为(b)与(c)的叠加;(f)显示红色荧光为小鼠抗cMyc单克隆抗体为一抗、山羊抗鼠-红色Rhodamine为二抗的荧光图像,(h)为(f)与(g)的叠加
3.2. RT-qPCR检测结果
应用RT-qPCR法检测47例HCC组织及相应远癌旁组织中Nek6 mRNA的相对表达量,计算并分析两组2−ΔΔCt可知,Nek6 mRNA在HCC中的表达水平为(1.405 ± 0.472),高于远癌旁组织中表达水平(1.133 ± 0.474),二者差异有统计学意义(t = 3.143, P = 0.0029) (图2)。
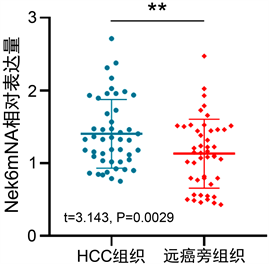
Figure 2. RT-qPCR to detect the relative expression of Nek6 mRNA in 47 HCC tissues and corresponding distant adjacent tissues (**, P < 0.01)
图2. RT-qPCR法检测47例HCC组织及相应远癌旁组织中Nek6 mRNA的相对表达量(**, P < 0.01)
3.3. Western blot检测结果
应用蛋白质免疫印迹法对60对HCC组织及相应远癌旁组织中的Nek6蛋白进行检测,并对其结果进行配对t检验分析,结果显示Nek6蛋白表达水平在HCC组织表达水平为(1.031 ± 0.193)高于正常组织中的(0.906 ± 0.182),差异有统计学意义(t = 3.464, P = 0.0012) (图3(a)、图3(b))。
对上述结果与临床病理学资料相结合进行分析后显示,Nek6蛋白的表达水平与Edmondson分级、纤维包膜及微血管侵犯(MVI)相关(均P < 0.05),而与性别、年龄、肿瘤大小、肿瘤数量、血清AFP水平、HBsAg等无显著相关(表1)。
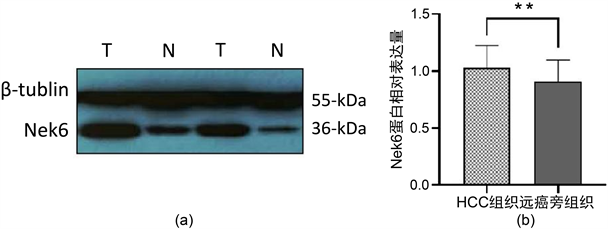
Figure 3. (a), (b) Western blot to determine the expression level of Nek6 in hepatocellular carcinoma (HCC) tissues and corresponding adjacent tissues. T is hepatocellular carcinoma tissue and N is distant adjacent tissue. (**, P < 0.01)
图3. (a), (b) Western blot测定Nek6在肝细胞肝癌(HCC)组织及相应癌旁组织中的表达水平,T为肝细胞肝癌组织,N为远癌旁组织(**, P < 0.01)


Table 1. Relationship between the expression of Nek6 protein and clinicopathological characteristics
表1. Nek6蛋白的表达水平与临床病理学特征间的关系
将单因素分析中差异显著的因素纳入二元Logistic回归模型中进一步分析与Nek6表达情况的相关性,结果显示:微血管侵犯(MVI)是Nek6表达水平的独立相关因素(P = 0.004) (表2)。

Table 2. Binary Logistic regression analysis of Nek6 and clinicopathological features
表2. Nek6与临床病理学特征的二元Logistic回归分析
4. 讨论
肝癌是全球最常见的恶性肿瘤之一,在许多国家,尤其是亚洲国家,是导致死亡的主要原因 [7] [8]。尽管近年来除手术切除以外,针对肝癌的局部治疗、靶向药物治疗及免疫治疗等诸多治疗手段日趋成熟,但肝癌的预后仍然不尽人意,术后5年生存率限制在25%~49%,深入了解肝癌发生发展的相关分子机制是十分必要的 [9] [10]。
NIMA激酶是哺乳动物细胞细胞周期进程中不可或缺的参与者 [11] [12]。哺乳动物NEKs是与脊椎动物NIMA相关激酶同源的哺乳动物激酶 [13] [14]。Nek6是Nek家族中的重要成员之一,是一种与真核细胞有丝分裂密切相关的蛋白,在多种实体肿瘤中均有表达上调。Nek6及其邻链NEK7在有丝分裂过程中被上游Nek9磷酸化并激活,从而启动中心体的分离 [15]。有研究发现,NEK6或NEK7的缺失破坏了有丝分裂中纺锤体的形成,驱动蛋白EG5和伴侣蛋白HSP72是NEK6的有丝分裂底物 [16] [17]。在本研究中,通过免疫荧光定位实验我们发现Nek6在HepG2细胞中存在广泛,主要集中于细胞核中,这种分布可能与其参与细胞有丝分裂的机制相关。由于Nek6参与有丝分裂的过程中尚有多种因子共同参与,因此为进一步研究肝癌细胞增殖的分子机制提供了可供参考的研究方向。
Choudhury A.D.等 [18] 研究发现,NEK6在前列腺癌中过表达。在裸鼠种植瘤模型系统中,将去势耐药癌细胞中的NEK6沉默后可使细胞恢复对去势的敏感性。NEK6介导的去势抵抗性前列腺癌在组织学上主要为鳞状细胞癌。基因表达谱分析表明,NEK6过表达刺激了细胞骨架、分化和免疫信号通路,并维持了去势后基因表达模式的正常下降。磷酸化蛋白质组分析显示,转录因子FOXJ2是一种新的NEK6底物,FOXJ2的磷酸化与新发现的NEK6转录靶点的表达增加有关。这些结果表明,NEK6信号通路可能是去势抵抗性前列腺癌的中枢机制。Zhixian He等 [19] 研究了Nek6在乳腺肿瘤发生中的作用以及Nek6在乳腺癌中的表达对预后的价值。结果显示,与癌旁非肿瘤组织相比,Nek6在大多数乳腺癌标本中过表达。此外,Nek6的高表达与乳腺癌的组织学分级、肿瘤大小和TNM分期相关。Cox回归分析显示Nek6的表达是乳腺癌的独立预后预测因子。该研究结果提示Nek6在乳腺癌细胞增殖中起促进作用。
在本研究中,通过RT-qPCR及Westren blot等检测手段对HCC组织与癌旁组织中的Nek6表达水平做了不同层面上的研究。我们的结果显示,Nek6在HCC中表达上调,这与其在其他实体肿瘤中的研究结果相一致,未来我们将通过构建Nek6过表达及沉默细胞模型,进一步探究Nek6对于肝癌细胞增殖速度、增殖模式及信号转导途径等方面的深入研究。
5. 结论
综上,NEK6主要存在于HepG2细胞的细胞核中,在肝细胞肝癌中表达上调,微血管侵犯是Nek6表达水平的独立相关因素,可能作为肝癌预后不良的判断指标之一。
NOTES
*通讯作者。