1. 介绍
在中国,胃炎的发病率高达50%~80%,80%的成年人出现不同程度的胃炎。此外,随着老年人口增多、城市工业化进程加快、环境污染严重、人们生活习惯和饮食结构的改变,其发病率进一步上升;受影响的人口也趋于年轻化 [1] [2] [3]。如果不积极治疗,胃炎就会由急性转为慢性、慢性浅表性胃炎、慢性萎缩性胃炎,甚至肠上皮化生、异型增生,最终导致胃癌。目前最常见的胃炎治疗方案是根除HP的同时对症治疗,即三联疗法、胃酸抑制剂和胃黏膜保护剂 [4] [5] [6]。
胃炎是多种因素共同作用的结果,其中,HP感染是主要原因。HP目前被世界卫生组织列为一类致癌物。全球有一半的人口感染了HP,几乎所有被感染的患者都可以发展为慢性胃炎。HP与宿主相互作用,介导机体对细菌的免疫反应,导致白细胞介素8 (IL-8)、环氧合酶-2 (COX-2)、诱导型一氧化氮合酶(iNOS)、肿瘤坏死因子α (TNF-α)、干扰素γ (IFN-γ)等因子的上调。这些细胞因子通过多种渠道产生免疫反应,损害局部组织,导致胃炎。其中,IL-8在炎症的发生发展中尤为重要。IL-8又称炎性趋化因子或促炎性趋化因子,是中性粒细胞的趋化剂,主要由IL-1、TNF、受脂多糖刺激的单核细胞、内皮细胞、成纤维细胞和T淋巴细胞产生 [7]。由于IL-8能够刺激趋化因子的释放,吸引免疫细胞到炎症部位,对细菌感染做出反应,进行免疫监测,控制免疫细胞趋化,因此IL-8又称为中性粒细胞趋化因子 [8] [9] [10]。
颗粒蛋白前体(PGRN,也称为GEP [Granulin-Epithelial Protein Precursor]),是通过连接区(P1-7)连接7个保守谷蛋白(A、B、C、D、F、G)单元而形成的功能前体 [11]。PGRN是一种分泌型糖蛋白,具有非常广泛的生理功能。作为介导细胞周期过程和细胞运动的多功能生长因子,在细胞生长、转化、促进细胞周期、伤口愈合和细胞毒性耐药性等方面具有普遍的调节作用。我们前期研究发现,胃炎时,胃黏膜上皮细胞中PGRN的表达增加。此外,PGRN可诱导多种炎性细胞因子的分泌,如IL-8、IL-6、IL-10、TNF-α等 [11] [12] [13]。同时,PGRN可促进肾损伤、神经退行性变等多种相关疾病的发展,与神经炎症、人动脉粥样硬化斑块、急性肾损伤、肌萎缩性侧索硬化症、阿尔茨海默病、帕金森病等相关。总之,PGRN在损伤修复和免疫调节中发挥着重要作用,为临床诊断和治疗提供了新的方向,是未来研究的目标。然而,PGRN在HP感染引起的胃炎中的作用尚不清楚。本文就其在胃炎中的作用机制及潜在的治疗价值进行了讨论。
本研究以HP26695株和胃黏膜上皮GES-1、SGC7901细胞为模型,探讨PGRN对HP诱导IL-8表达的影响,以及二者在蛋白和mRNA水平上的相关性。探讨HP感染在胃炎发生发展中可能的机制,为其临床诊断和治疗提供新的靶点。
2. 材料和方法
2.1. 细胞培养和试剂
人胃黏膜上皮GES-1细胞和胃癌细胞SGC7901在RPMI 1640培养基中培养(Invitrogen, Carlsbad, CA),添加10%胎牛血清(Hyclone, Logan, UT),青霉素/链霉素(1:100稀释;Sigma-Aldrich, St. Louis, MO, USA),在37℃,5% CO2的气体环境中培养。
特异性抑制剂PI3k/AKT抑制剂UO126、MEK1/2抑制剂LY294002和核因子-kappa B (NF-kB)抑制剂bay11-7082从Invitrogen公司购入。在二甲亚砜(DMSO)溶液中制备储备溶液。在HP刺激后用上述抑制剂处理细胞。没有抑制剂的对照组用培养基和相同浓度的DMSO单独处理。
2.2. 动物饲养
将SPF级C57BL/6雄性6周龄小鼠40只,在相对湿度40%~60%、室温23.2℃、噪音 < 60 dB、光–暗循环12小时的标准实验室条件下观察驯养7 d。动物由潍坊医学院实验动物中心提供的水和营养完整的饲料(高压蒸汽灭菌)饲养。
2.3. 幽门螺杆菌培养
本研究使用的幽门螺杆菌菌株为实验室保存的标准菌株(NCTC26695、NCTC11637、Sydney菌株1或SS1)。所有菌株的培养基均为含5%胎牛血清的布氏肉汤培养基,在37℃,低氧环境(5%氧气、10%二氧化碳、85%氮气)下培养。收集时以6000 rpm离心3分钟。感染细胞时按照荷菌量MOI为100:1。
2.4. 免疫组织化学
取新鲜小鼠胃黏膜上皮,在低温恒温器中切成5 μm厚。石蜡固定切片。将切片置于烘箱中化蜡。然后置于玻片架上分别浸入,二甲苯I 15 min,二甲苯II 15 min,100%乙醇10 min,95%乙醇6 min,80%乙醇min,75%乙醇2 min,单蒸水1 min。然后进行抗原修复。滴加适量内源性过氧化物酶阻断试剂,后用山羊血清封闭,并洗涤。滴加一抗后置于避光湿盒内4℃孵育过夜或37℃孵育60分钟,后用PBS洗涤。滴加生物素标记山羊抗兔IgG并置于避光湿盒内室温孵育10~15分钟。最后用DAB法显色并拍照。
2.5. RNA提取与实时荧光定量PCR (qRT-PCR)
用TRIzol (Invitrogen)按照制造商的方案提取细胞总RNA。使用Revert Aid™ First Strand cDNA Synthesis Kit (Fermentas)随机引物进行逆转录。从1 μg总细胞RNA中合成第一链cDNA。然后,扩增PGRN和β-actin的cDNA。使用的特异性引物为:
PGRN正向引物5’-GGACAGTACTGAAGACTCTG-3’,反向引物 5’-GGATGGCAGCTTGTAATGTG-3’;
β-actin正向引物5’-AGTTGCGTTACACCCTTTCTTG-3’,反向引物 5’-CACCTTCACCGTTCCAGTTTT-3’;
IL-8正向引物5’-ACACTGCGCCAACACAGAAATTA-3’,反向引物 5’-TTTGCTTGAAGTTTCACTGGCATC-3’。
实时PCR反应包括ABI7000快速实时PCR系统与SYBR®预混ExTaq™根据规定的程序。
HP与GES-1和SGC7901细胞在培养基中孵育达6、12和24 h。菌/细胞比例为100:1。然后用PBS洗涤细胞两次,在无血清的RPMI-1640培养基中培养。分别于0、6、12、24 h后收集培养上清液进行蛋白检测。IL-8的表达采用酶联免疫吸附试验(中国南京森贝佳生物技术有限公司),按照生产厂家的方案进行检测。各组在450 nm处测定吸光度,用分光光度法测定IL-8浓度。每个实验至少重复三次。
2.6. Western Blot
用细胞裂解缓冲液裂解细胞,用BCA法测定蛋白含量。每孔加入40 μg蛋白,后进行SDS-PAGE电泳,再转移到PVDF膜上。室温下用5%脱脂牛奶封闭膜1.5 h,用TBST洗脱3× 10 min。一抗孵育过夜,洗涤后与二抗室温孵育2小时。β-actin作为内参。
2.7. 慢病毒载体转染的干扰
成功构建的PLKO.1-PGRN shRNA-GFP干扰慢病毒能有效抑制胃黏膜上皮细胞中PGRN mRNA和蛋白的表达。GES-1和SGC-7901细胞在6孔板上传代,2 × 105细胞/孔,培养过夜。PGRN shRNA组和对照组均以Lipofectamine 2000作为转染剂。PGRN shRNA的干扰序列为:PGRN shRNA正向序列为:5’-CCGGGGCCACTCCTGCATCTTTACTCGAGTAAAGATGCAGGAGTGGCCTTTTTG-3’,反向序列为:5’-AATTCAAAAAGAGGCCACTCCTGCATCTTTACTCGAGTAAAGATGCAGGAGTGGCC-3’。它们均由上海生物工程技术有限公司合成。Lipofectamine™2000试剂(Invitrogen)用于脂质体细胞感染。这一步采用60%感染浓度的慢病毒载体。
2.8. 裸鼠成瘤实验
选用适龄裸鼠,将裸鼠固定后,选择腋下为成瘤位置。用75%乙醇消毒裸鼠背部,侧腰部及腋下皮肤,用无菌的一次性注射器吸取细胞悬液,接种细胞时选择裸鼠侧腰部以上部位进针,在皮肤和肌肉层时间穿行一段距离后在目标注射点注射。每个部位约注射0.2 mL。然后将裸鼠放适宜的饲养环境。每日观察成瘤情况并记录。
2.9. 统计数据分析
所有实验数据均采用SPSS软件进行统计分析,采用T检验确定统计学意义,以P < 0.05为标准。
3. 结果
3.1. 幽门螺杆菌感染致胃炎小鼠胃黏膜中PGRN的表达明显升高
为了探讨HP感染对PGRN表达的影响,本研究建立了小鼠HP感染模型。用HP SS1株感染小鼠48周后,W-S银染结果显示,所有小鼠均成功定植(如图1(A))。免疫组织化学染色结果显示,小鼠模型中出现HP相关性胃炎(图1(B))。病理改变早期,淋巴细胞和嗜酸性粒细胞浸润,主要位于腺下区。随着感染时间的延长,细胞浸润的范围和程度扩大,嗜中性粒细胞浸润,可通过固有层扩散至腺腔。HP自然感染动物的胃黏膜中常可见嗜酸性粒细胞浸润,正常人和动物均无嗜酸性粒细胞浸润。免疫组织化学染色结果显示,正常小鼠胃黏膜中PGRN表达较低,而HP导致的慢性炎症后PGRN表达明显升高(图1(C))。
 A:小鼠胃黏膜上皮细胞HP W-S银染色(200×)。B:胃黏膜的组织病理学表现。HP感染引起固有层内炎症细胞的浸润,包括中性粒细胞、单核细胞和嗜酸性粒细胞(200×)。C:小鼠新鲜胃黏膜上皮标本的组织化学染色中(200×) PGRN的表达。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
A:小鼠胃黏膜上皮细胞HP W-S银染色(200×)。B:胃黏膜的组织病理学表现。HP感染引起固有层内炎症细胞的浸润,包括中性粒细胞、单核细胞和嗜酸性粒细胞(200×)。C:小鼠新鲜胃黏膜上皮标本的组织化学染色中(200×) PGRN的表达。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
Figure 1. Stain and immunohistochemical staining of gastric mucosa of HP infected mice and control mice
图1. 幽门螺杆菌感染小鼠和对照组小鼠胃黏膜的组织染色和免疫组织化学染色
3.2. 幽门螺杆菌感染诱导胃上皮细胞中IL-8的表达呈时间依赖性
采用琼脂糖凝胶电泳、实时荧光定量PCR、ELISA检测HP感染胃黏膜上皮细胞GES-1和胃癌细胞SGC7901中IL-8的表达变化。分别用HP26695株感染细胞0、6、12、24小时,MOI为100:1。如图2(A)所示,琼脂糖凝胶电泳结果显示,HP与胃黏膜上皮细胞相互作用时间延长,IL-8 mRNA表达量增加。也就是说,HP26695株的感染可以诱导胃上皮细胞GES-1和SGC7901中IL-8的表达上调,且这种诱导与HP感染的时间呈正相关。实时荧光定量PCR检测结果与ELISA检测结果一致(图2(B)、图2(C))。
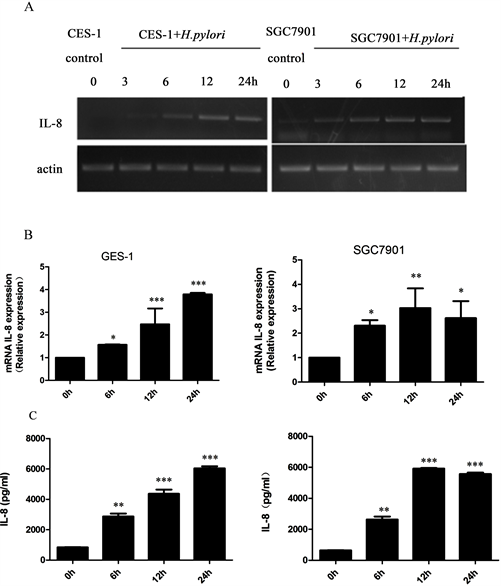 A:HP感染人胃黏膜细胞GES-1和胃癌细胞SGC7901后,PCR检测IL-8的表达。B:人胃黏膜细胞GES-1和胃癌细胞SGC7901感染HP后,通过实时荧光定量PCR检测IL-8的表达。C:人胃黏膜细胞GES-1和胃癌细胞SGC7901感染HP后,ELISA检测IL-8的表达。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
A:HP感染人胃黏膜细胞GES-1和胃癌细胞SGC7901后,PCR检测IL-8的表达。B:人胃黏膜细胞GES-1和胃癌细胞SGC7901感染HP后,通过实时荧光定量PCR检测IL-8的表达。C:人胃黏膜细胞GES-1和胃癌细胞SGC7901感染HP后,ELISA检测IL-8的表达。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
Figure 2. Relationship between HP infection duration and IL-8 expression in human gastric mucosa epithelial cells
图2. 人胃黏膜上皮细胞中HP感染时间与IL-8表达的关系
3.3. 幽门螺杆菌通过NF-κb通路调控IL-8在胃黏膜上皮细胞中的表达
为探究HP感染对胃上皮细胞GES-1和SGC7901诱导IL-8表达的调控作用,当细胞融合度达到70%时,分别加入PI3K/AKT、MEK和NF-κb信号抑制剂LY2940021、U0126和BAY11-7082作用2小时。前期结果显示,将HP按MOI为100:1感染细胞12小时后,IL-8 mRNA表达量应明显增加。qRT-PCR结果显示,将NF-κb抑制剂BAY11-7082提前2小时作用于细胞再加菌作用,可显著抑制胃黏膜上皮细胞GES-1和胃癌细胞SGC7901中HP对IL-8的诱导表达(图3(A))。ELISA检测结果与检测mRNA水平一致(图3(A))。此外,分别用HP26695株感染GES-1和SGC7901细胞0分钟,15分钟,30分钟,60分钟和120分钟。结果表明,HP感染可能大大增加细胞P65磷酸化水平,并且,在HP感染胃黏膜上皮细胞2小时的时候,P65的磷酸化最为显著,进一步证实HP感染诱导IL-8的产生可能受NF-κb通路的调控。
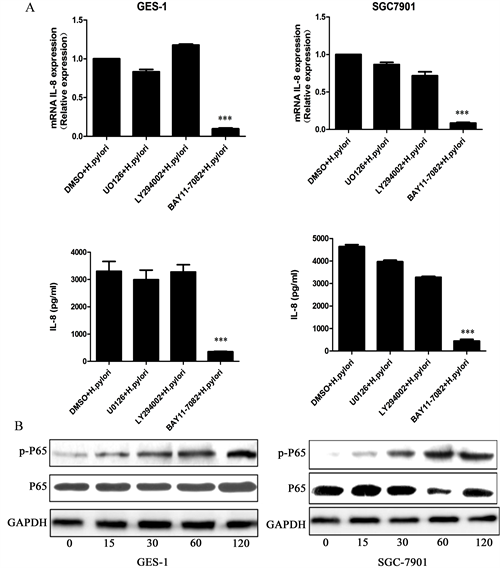 A:加入信号抑制剂后HP感染胃黏膜上皮GES-1和胃癌细胞SGC7901中IL-8表达的变化。NF-κb抑制剂BAY11-7082能显著抑制HP感染胃黏膜上皮GES-1和SGC7901细胞中IL-8的表达,在蛋白水平和mRNA水平上结果一致。B:WB结果显示,HP感染促进P65的磷酸化。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
A:加入信号抑制剂后HP感染胃黏膜上皮GES-1和胃癌细胞SGC7901中IL-8表达的变化。NF-κb抑制剂BAY11-7082能显著抑制HP感染胃黏膜上皮GES-1和SGC7901细胞中IL-8的表达,在蛋白水平和mRNA水平上结果一致。B:WB结果显示,HP感染促进P65的磷酸化。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
Figure 3. Regulation of IL-8 signaling pathway in gastric mucosal epithelial cells infected by HP strain 26695
图3. HP菌株26695感染胃黏膜上皮细胞后IL-8信号通路的变化
3.4. PGRN对慢病毒感染的干扰可增加HP诱导的胃黏膜上皮细胞IL-8的表达
为验证PGRN在HP感染诱导胃黏膜上皮细胞中IL-8变化中的作用,我们还成功构建了PLKO.1-PGRN shRNA-GFP干扰慢病毒,并成功感染细胞,该慢病毒能有效抑制PGRN mRNA和蛋白在细胞中的表达。慢病毒感染后,PGRN表达降低后,胃黏膜上皮细胞中IL-8 mRNA的表达明显增加(图4(A))。qRT-PCR和ELISA结果显示,慢病毒感染的胃黏膜上皮细胞与HP (MOI = 100:1)相互作用12小时后,可以诱导IL-8 mRNA和蛋白的表达(图4(B))。此外,用HP感染慢病毒PLKO.1-PGRN shRNA-GFP的胃黏膜上皮细胞GES-1和胃癌细胞SGC7901,与对照组相比,PGRN表达降低后,IL-8 mRNA表达明显升高,在蛋白水平上也有相同的结果。
 A:mRNA水平检测显示,PGRN干扰后,胃黏膜上皮细胞GES-1和胃癌细胞SGC7901中PGRN的表达下降,表明PGRN干扰成功。B:采用qPCR和ELISA检测PGRN干扰诱导HP感染胃黏膜上皮细胞中IL-8表达的变化。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
A:mRNA水平检测显示,PGRN干扰后,胃黏膜上皮细胞GES-1和胃癌细胞SGC7901中PGRN的表达下降,表明PGRN干扰成功。B:采用qPCR和ELISA检测PGRN干扰诱导HP感染胃黏膜上皮细胞中IL-8表达的变化。数据以三次重复实验的均数±标准误差(SEM)表示。con:对照组;H. pylori:幽门螺杆菌定植组。*P < 0.05;**P < 0.01;***P < 0.001。
Figure 4. The effect of lentivirus infection on IL-8 changes in gastric mucosal epithelial cells induced by HP infection
图4. 慢病毒感染干扰PGRN在HP感染诱导胃黏膜上皮细胞中IL-8变化中的作用
3.5. PGRN通过NF-κB通路对HP感染胃黏膜上皮细胞P65磷酸化的影响
为了进一步分析HP是否通过PGRN对NF-κB信号通路产生影响,用PLKO.1-PGRN shRNA-GFP转染细胞72小时后,与HP26695共孵育2小时。如图5(A)所示,与HP感染相比,PGRN shRNA感染可以激活P65。与病毒对照组相比,PGRN shRNA组的P65磷酸化水平升高,与HP合并感染后P65磷酸化水平上调更加明显。然而,同时感染HP的PGRN shRNA组的磷酸化水平明显高于对照组,这些结果在两种胃黏膜上皮细胞中都是一致的。提示PGRN可能通过上调P65的磷酸化来影响HP感染后IL-8的表达。
为了进一步阐明HP介导的胃上皮细胞中IL-8的产生是否通过是由PGRN通过NF-κb信号通路调控,我们采用了该通路的抑制剂BAY11-7082进行治疗。如图5(B)所示,与未感染细胞相比,HP感染可通过NF-κb信号通路促进P65磷酸化。NF-κb信号通路抑制剂BAY11-7082能显著降低HP感染后P65磷酸化的增强的水平。在PGRN干扰慢病毒的作用下,HP感染后P65的磷酸化水平明显高于对照组。然而,在BAY11-7082的作用下,慢病毒感染干扰PGRN与HP相互作用导致的P65磷酸化被明显抑制,在两种胃黏膜上皮细胞系中均得到了相同的结果。因此,PGRN慢病毒通过NF-κb信号通路干扰胃黏膜上皮细胞IL-8的产生。
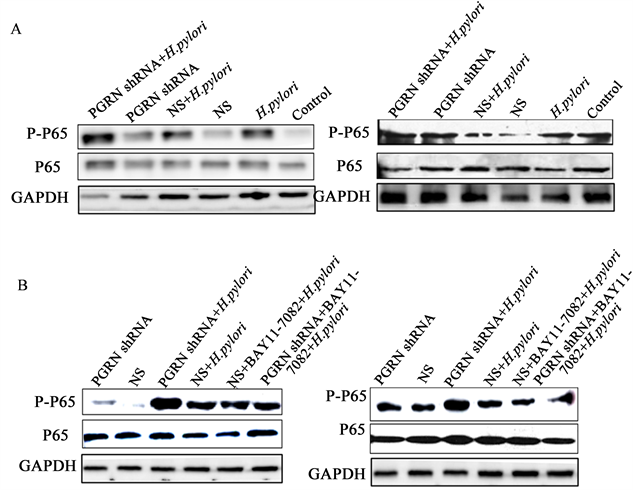 A:慢病毒感染可干扰PGRN,PGRN可显著增强HP感染胃黏膜上皮细胞P65的磷酸化。B:WB结果显示,NF-κB抑制剂BAY11-7082能显著降低HP感染和PGRN干扰引起的P65磷酸化。
A:慢病毒感染可干扰PGRN,PGRN可显著增强HP感染胃黏膜上皮细胞P65的磷酸化。B:WB结果显示,NF-κB抑制剂BAY11-7082能显著降低HP感染和PGRN干扰引起的P65磷酸化。
Figure 5. The effect of PGRN on phosphorylation of GES-1 and SGC7901 P65 in HP-infected gastric mucosa epithelial cells
图5. PGRN对HP感染胃黏膜上皮细胞GES-1和SGC7901 P65磷酸化的影响
4. 讨论
胃炎的发生和发展是由多种因素引起的,其中感染是最常见的原因。HP引起的疾病的特征包括胃黏膜炎症、胃酸生成的变化和组织损伤。此外,持续性HP感染可导致胃黏膜的慢性炎症。在易感人群中,胃黏膜上皮的HP感染与胃炎、胃溃疡、胃腺癌和胃黏膜相关B细胞淋巴瘤(MALT)的发生密切相关 [6]。HP的致病潜能是由细胞毒素相关抗原A (CagA)和空泡细胞毒素(VacA)等毒性因子提供的。HP成功地在严苛的胃内环境中定植需要特殊的机制 [11] [14]。外膜蛋白(OMPs)被认为是HP适应宿主的关键蛋白。OMP家族中一些被广泛研究的成员如BabA、SabA、HopZ在HP感染的致病过程中发挥粘附作用,而外膜炎症蛋白A (The outer membrane inflammatory protein A, OipA)对炎症因子IL-8的诱导和胃黏膜上皮细胞的粘附是必不可少的 [15]。
细胞内和细胞外PAMPS受体或免疫效应物在HP感染的发病机制中发挥不同的作用。NOD1驱动的IL-33可能阻止HP介导的炎症反应,对人体来说是有益的,因为细菌在胃内的持续存在。TH-17t辅助细胞亚型通过分泌细胞因子和激活效应细胞来预防HP菌血症;Th1和Th-17反应是在HP感染期间引起的。例如,有相关研究显示,瑞典HP感染患者体部和胃窦中Th-17细胞因子IL-17A和Th1淋巴因子IFN-γ编码基因表达水平升高 [16]。更重要的是,HP感染患者的IL-17A+和IFN-γ+细胞数量也增加。此外,伊朗和法国HP感染患者胃组织中IL-17A mRNA也显著增加 [17]。在斯里兰卡一个研究中显示,HP感染与IL-17血清浓度的增加相关。Sutton等人发现,MUC1通过抑制TLR/NF-κB通路的激活,调控NLRP3的表达,作用于免疫细胞(可能是巨噬细胞),从而防止IL-1β的过度产生和胃发育不良的发生。IL-1B-511T/P基因型或IL-1RN 2等位基因携带者感染HP后黏膜IL-1β水平高于非携带者 [18]。因此,白细胞介素-1基因多态性可能影响HP相关白细胞介素-1β在HP感染的胃中的水平,而HP相关白细胞介素-1β又与胃炎和萎缩有关 [19]。
HP感染的临床结果取决于感染株、宿主免疫应答和环境之间复杂的相互作用,其特征是产生大量炎症细胞因子,包括IL-1β、TNF-α、IL-6、IL-8和IL-17 [17]。这些炎症细胞因子水平的升高在胃炎的发生发展中起着关键作用。其中最重要的是第一个特征化因子IL-8,也称为促炎趋化因子,诱导中性粒细胞沿着血管壁积累 [7]。该细胞因子的释放是由不同细胞类型的特定炎症信号触发的,通过对中性粒细胞活性的影响,在防御机制中发挥关键作用。然而,在炎症刺激下,IL-8在循环中持续、长期存在可能导致不同程度的组织损伤。由于IL-8具有刺激丝裂原活化蛋白激酶(MAPK)和细胞蛋白酪氨酸磷酸化的作用,因此被认为不适合用于治疗目的 [8] [9]。IL-8的主要受体结合于所有趋化因子NH2端附近的结构域,其拮抗剂可通过截断或取代这一区域获得 [10] [20]。作为促进血管生成的趋化因子,CXCL8/IL8与CXCR2受体相互作用,而作为抗血管生成的趋化因子,干扰素诱导蛋白相关的IL-10 (CXCL10/IP10)与CXCR3受体相互作用 [21]。HP感染过程中产生的促炎细胞因子IL-6、IL-8和TNF依赖于AQP3的水平 [22]。在HP感染的AGS细胞中,α-硫辛酸激活NRF2/HO-1通路,抑制促炎细胞因子IL-8的产生,减少活性氧(ROS)。因此,食用富含α-硫辛酸的食物可以通过降低活性氧诱导的胃黏膜上皮细胞中IL-8的表达水平来预防HP相关胃病的发生 [23]。
HP感染可显著增加胃黏膜PGRN的表达,但PGRN在HP引起胃炎中的作用尚不清楚。PGRN是一种表达于内皮细胞、免疫细胞、神经元和脂肪细胞的富含半胱氨酸的分泌糖蛋白,具有抗炎和免疫调节活性,可间接调节细胞周期进程和细胞运动。因此,它是细胞生长、迁移和转化、伤口愈合、炎症和细胞毒性抵抗的重要调节因子。它最初被认为具有生长因子样特征,与组织重塑、发育、炎症和蛋白稳态有关 [24] [25]。PGRN水平升高与许多炎症疾病密切相关,如慢性阻塞性肺气肿(COPD) [26]、胰岛素抵抗 [27]、哮喘 [28]、关节炎 [29]、II型糖尿病 [30]、骨坏死 [31] 和其他疾病。程序素具有抗炎特性,是一种有用的预后生物标志物。在流感病毒感染过程中,PGRN的体内外表达水平显著升高。通过PGRN敲除试验和PGRN缺陷小鼠模型,证实流感病毒诱导的PGRN通过抑制NF-κB和IRF3信号的激活负调控I型干扰素的产生 [32]。此外,PGRN通过其Grn CDE结构域直接与NF-κB调控因子相互作用 [33]。
考虑到PGRN在各种炎症中具有重要的抗炎和保护作用,本研究旨在通过成功构建PLKO.1-PGRN shRNA-GFP慢病毒来阐明其在胃炎中的作用,该慢病毒能有效抑制PGRN感染胃黏膜上皮细胞后的表达。并在感染细胞中持续表达,以便日后研究PGRN影响的机制。我们的研究发现PGRN可以显著降低HP感染引起的胃炎中炎症因子IL-8的表达水平,从而抑制胃炎的发生发展。因此,HP感染促进胃黏膜上皮细胞PGRN的表达是一种保护性反应,PGRN减少了相应的炎症反应。
5. 结论
综上所述,PGRN可能通过NF-κB信号通路调控HP26695株感染的胃黏膜上皮细胞中IL-8的分泌和表达,调控胃炎的发生发展。在此过程中,PGRN诱导某些下游基因通过NF-κB调控IL-8的表达,进而发挥抗炎和保护作用,从而影响胃炎的病理生理变化。这一过程的确切机理值得进一步探讨。总体而言,PGRN在胃病损伤修复和炎症过程中起着关键作用,可作为临床诊断和治疗的新靶点,为胃炎的后续研究提供新的方向。
基金项目
国家自然科学基金项目(No. 81201262);国家自然科学基金项目(No. 32000495);山东省医疗卫生技术发展计划项目(No. 2017WS246)。
NOTES
*第一作者。
#通讯作者。