1. 引言
肺动脉高压(Pulmonary hypertension, PH)是心源性疾病的常见并发症之一,尤其多见于左心疾病。在左心疾病中,主动脉瓣狭窄(aortic stenosis, AS)可导致左心室流出道受阻,射血分数下降,左室充盈压升高,进而肺血管后阻力增加,并发肺动脉高压的发生 [1]。经导管主动脉瓣置换术( transcatheter aortic valve replacement, TAVR)自2002年问世以来,经过数年的发展,为中风险及高风险的主动脉狭窄患者提供了另一种重要的治疗方法;近几年TAVR已逐步被应用于治疗中低风险的主动脉瓣狭窄人群 [2] [3]。肺动脉高压通常与术后多种并发症及死亡率高度相关 [4] [5]。国外多项研究表明,合并有PH的主动脉瓣狭窄患者在接受TAVR手术后,出现并发症及心源性相关死亡的几率比没有合并PH的患者高 [4] [6] [7]。因病例数量限制,该类研究在国内相对较少。本研究针对接受TAVR治疗后回访的超声心动图进行分析,探讨PH对于接受TAVR治疗的AS患者早期左心室逆向重构的影响。
2. 对象与方法
2.1. 研究对象
本研究连续性选入2017年9月至2020年12月在青岛大学附属医院行TAVR手术的患者。患者均在会诊后被评估为外科主动脉瓣置换术(Surgical aortic valve replacement, SAVR)不能耐受的高风险AS患者。将入选患者按术前超声心动图估测的肺动脉收缩压分为两组:n-PH组,无肺动脉高压组,PASP < 45 mmHg,31例;PH组,合并肺动脉高压组,PASP ≥ 46 mmHg 36例。TAVR手术均根据现行指南进行,所有患者均已自愿签署知情同意术。该研究已通过青岛大学附属医院伦理委员会的审批。
2.2. 数据收集及定义
所有患者均经过本中心心脏团队讨论,为手术风险高或拒绝接受SAVR的情况下接受TAVR治疗。分别收集患者术前、术后1个月、术后3个月、术后1年的超声心动图的数据及相关临床信息,主要包括患者的病史、心电图、超声心动图、CTA、临床预后结果等。患者出院后的随访均通过两名医师通过电话的方式共同参与,且两名医师对该研究目的不知情。患者在院期间的超声心动图均由两名副高级以上的医师进行分析,如测量结果差异较大则由第三名同资质医师进行分析。所有数据被收集到一个专用的临床数据库中。将术后LVMi与RWT值下降定义为发生左心室逆向重构,反之则为不良重构;将RWT > 0.43定义为向心性肥厚。
2.3. 统计学分析
本研究中的连续变量若符合正态分布则采用平均值±标准差表示,即
,若不符合正态分布则采用中位数和四分位数间距M (QR)表示。二分类变量以频率和百分比的形式呈现,即n (%)。使用卡方检验或费舍尔精确检验评估比例差异。为了检验具有连续变量的组间均值的差异,使用独立样本t检验;或者当变量不服从正态分布时,使用Mann-Whitney非参数检验。采用Lit’s完全随机缺失检验评估缺失值是否是随机的。对LVMi等重复测量值使用单因素重复测量方差分析,若满足Mauchly’s球形度检验则使用主体内效应检验,若变量不满足则使用多变量检验。利用Propensity score matching IBM spss插件进行倾向性评分匹配。所有的计算都依赖于商业软件SPSS,版本26 (IBM Corp., Armonk, NY, USA),双尾P < 0.05被意为存在统计学显著性差异。
3. 结果
3.1. 患者总体特征
对67例重度AS患者行TAVR治疗的临床资料进行分析。患者平均年龄(PH组,74.86 ± 5.72岁VS. n-PH组,75.68 ± 6.29岁,P = 0.58)。结果为67例患者中有31例术前合并PH。有PH的患者欧洲评分更高(PH组,6.94 ± 2.83 VS. n-PH组,5.58 ± 1.45,P = 0.02,t = 2.42)根据纽约心功能分级,PH组中在三级以上的患者占比较多,但未达到统计学意义(PH组,24 (77.42%) VS. n-PH组,14 (38.89%),P = 0.07)。术前合并有糖尿病的人数在n-PH组中较多(PH组,16 (51.61%) VS. n-PH组,24 (66.67%),P = 0.006,z = 7.53)。PH组在基线时表现为较多的中度及以上的二尖瓣返流(PH组,21 (67.74%) VS. n-PH组,6 (16.67%),P = 0.001,z = 10.52)。
PH组的左室收缩及舒张直径均较n-PH组大,分别为(PH组,5.2 (0.95) cm VS. n-PH组,4.9 (0.8) cm,P = 0.01,f = −2.5);(PH组,3.94 ± 0.9 cm VS. n-PH组,3.4 ± 0.75 cm,P = 0.02,t = 2.45)。术前左心室射血分数在PH组中表现较低(PH组,50% ± 12% VS. n-PH组,56% ± 7%,P = 0.01,t = −2.55)。同时,术前射血分数 < 40%的患者在PH组中占比较多(PH组,13 (41.94%) VS. n-PH组,4 (11.11%),P = 0.03,z = 0.94)。其余基线特征显统计学差异(见表1,表2)。

Table 1. Preoperative baseline data of the two groups of patients
表1. 两组患者术前基线数据
身体质量指数(BMI),Body Mass Index;经皮冠状动脉介入治疗(PCI),percutaneous coronary intervention;冠状动脉旁路移植术(CABG),coronary artery bypass grafting。

Table 2. Baseline echocardiographic characteristics of patients in the two groups
表2. 两组患者超声心动图基线特征
LVDd (左心室舒张末期内径),Left ventricular end diastolic dimension;LVDs (左心室收缩末期内径) left ventricular end-systolic dimension;IVST (室间隔厚度),interventricular septum thickness;LVPWT (左心室后壁厚度) left ventricular posterior wall thickness;LVMi (左心室体积指数),left ventricular mass index;PASP (肺动脉收缩压),pulmonary artery systolic pressure。
3.2. 临床预后
术后1年死亡率在两组中相似(PH组,2 (6.45%) VS. n-PH组,3 (8.33%),P = 0.66)。ICU住院天数及总住院天数在PH组中均表现较高,但未达到统计学差异,分别为(PH组,11.86 ± 38.56天VS. n-PH组,4.52 ± 7.78天,P = 0.06);(PH组,35.36 ± 41.89天VS. n-PH组,29.35 ± 10.52天,P = 0.07)两组患者在术后并发症及术中应用瓣膜数量上无统计学差异。术后1年内发生不良重构的人数在PH组较多,但尚未达到统计学意义(PH组,10 (32.26%) VS. n-PH组,5 (13.89%),P = 0.25) (表3)。

Table 3. Clinical prognosis of the two groups
表3. 两组患者临床预后
3.3. 左心逆向改变
对两组患者基线及术后复查的超声心动图进行重复测量统计分析。PH组无论基线还是术后1年的随访时间内LVMi均比n-PH组高。但有趣的是,RWT全程在n-PH组中表现数值更高(表4)。两组数据均较基线时有明显的下降,但在1年的随访时间内仍未回归到正常值水平(图1、图2)。

Table 4. Analysis of variance of repeated measurements in the two groups
表4. 两组患者重复测量方差分析(
)
表5、表6中指出,随着两组患者术后时间的不断延长,LVMi与RWT随时间不断下降。术前合并有PH的患者术后LVMi的下降较无PH组的患者略差,P = 0.05。但有无PH对不同组间术后RWT的恢复无明显影响。
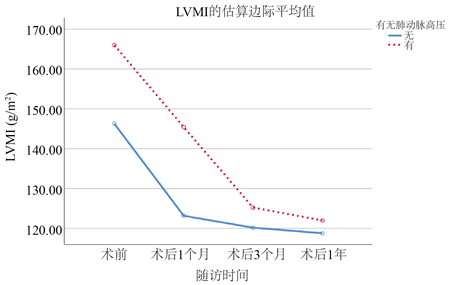
Figure 1. Changes of LVMi in two groups of patients
图1. LVMi在两组患者中的变化
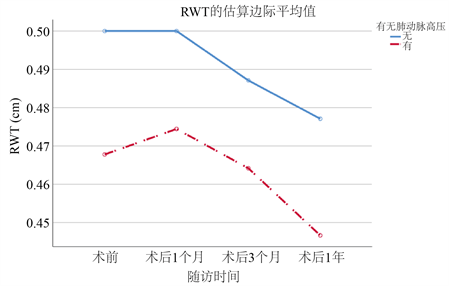
Figure 2. Changes of RWT in two groups of patients
图2. RWT在两组患者中的变化
时间效应:该变量与时间变化的交互作用;时间*组别:测量时间与分组间的交互作用。

Table 6. Effect test between the two groups
表6. 两组间效应检验
4. 讨论
据我们所知,这项回顾性研究首次分析中国人群中TAVR术后早期左心室质量和逆向改变与肺动脉高压的关系。本次研究证明:1、合并有PH的患者在基线中的欧洲评分及术前存在中量或大量二尖瓣返流表现较多。2、PH组的术前左室几何结构更大。3、术后3个月的时间,合并有PH组的患者LVMi及RWT改善更加明显。4、尽管两组患者接受TAVR治疗后左心室均发生逆向重构,但到1年的随访结束时,仍未恢复至正常水平。
本中心患者的基线特征与先前基于TAVR的研究相似,均为手术中风险或高风险患者。肺动脉高压的存在并非通过直接影响左心室功能而使得临床症状表现较重。其通过降低右心室舒张功能,进而使得室间隔肥厚。在心室收缩期,较厚的室间隔影响了左心室的收缩幅度,加之左室流出道机械性梗阻的存在。这些因素共同导致了左心室收缩及舒张功能的下降,最终降低了患者的心输出量。较重的梗阻使得左心室舒张压增加,二尖瓣返流加重。反过来促进了PH的形成及恶化。本研究中,PH组的左室几何结构较大,这与先前描述的两方面因素相关。而较大的左室结构也提示了左心室功能的衰退。这在表2中已明确指出。
4.1. 肺动脉压与左室收缩功能
尽管我们可以推断PH对于左心室功能的影响,但左心室射血分数与主动脉瓣狭窄患者中的肺动脉高压是否存在直接关系尚存争议。先前的研究指出,即使在LVEF较高的患者人群中仍可存在肺动脉高压 [8]。在此背景下,我们研究分析肺动脉高压对于术后LVEF的影响。在两组中LVEF术后均较术前有所提升,但伴有肺动脉高压的患者,术后LVEF的恢复较差。这与PH组患者术前左心室几何结构较大,术后恢复较慢可能有关。虽然LVEF在预测TAVR预后方面具有一定的意义,但单凭LVEF无法明确的预测左心室逆向重构 [9]。本中心的研究发现,肺动脉高压通过减少左室前负荷,增大左房室间压差,与主动脉瓣狭窄病变共同作用于左心室,进而加重患者左室收缩能力的障碍。而单纯的LVEF与术后左心室逆向重构无相关性。
4.2. 肺动脉高压与左心室舒张功能
先前已经有许多不同的理论解释了在没有左心室舒张功能障碍的前提下,肺动脉高压是如何干预左心室舒张功能的 [10] [11]。当肺动脉高压存在时,右心室压力增加,进而室间隔向左移位,室间隔曲率扁平甚至反转,最终左心室受压 [4]。这一影响在左室收缩末期与舒张早期最大,导致舒张早期左室充盈缺损。Yoram等人指出,由于舒张心室的相互作用,肺动脉高压本身会导致舒张功能受损 [12]。而主动脉瓣狭窄所致的左室舒张末压升高也会加重左心室舒张功能的下降。这与本研究中两组患者在基线及术后左室几何形状的改变相同。
4.3. 肺动脉高压与左心室逆向重构
在这项研究中,我们证明了左心室几何结构在TAVR术后1年内明显消退。这种改变在术前无肺动脉高压组中更为明显。左室逆向重构在术后即刻就开始发生,并在术后3个月内表现非常明显,但随后这种改变的速度逐渐下降,这种逆向重构的状态在术后1年内持续存在。与此同时,肺动脉高压所造成的室间隔位置形态改变以及左房室压差的增加均在一定程度上加重了左心室肥厚和纤维化的改变,随之而来的就是左室僵硬、心力衰竭和死亡 [13]。TAVR对于心脏血流动力学以及适应性微观改变已经得到了充分的研究。通过连续性影像分析显示TAVR术后左心室的结构和功能有明显改善,组织病理学分析显示,随着术后LVMi的降低,左心室纤维化也得到改善。TAVR手术对于左心室血流动力学的改变在术中即刻得到体现,左心功能的恢复以及左心室逆向重构的过程也随之开始。术前肺动脉高压的存在往往与TAVR的不良预后相关,但术后PASP的下降则有利于左心功能的改善 [14]。本中心研究提示与先前的研究结果相似,术后3个月左心室质量在无PH组和有PH组间对比为(PH组,125.23 ± 120.18 ± 29.1 VS. n-PH组,120.18 ± 29.1,P = 0.53),两组较基线分别下降24.2%和17.8%。在我们的研究中证明了LVMi的改变与TAVR术前有无肺动脉压有关。左室流出道梗阻解除后,扩大的左室重构明显,心功能恢复幅度也较大。同样我们也在表3中见到PH组的患者发生不良重构的人数较多,尽管组别间尚未达到统计学意义,但由此可以说明PH可能与左室术后的不良逆向重构存在相关性。心肌重构的程度和持久性对症状改善、心力衰竭、再住院治疗以及死亡率等临床结果有着重要意义。Vizzardi等人的回顾性研究表明,术后6个月,纽约心功能分级有明显改善,左心室质量指数明显降低(190 g/m2降至143 g/m2,P < 0.001)。尽管本研究中PH组的患者术后LVMi恢复幅度较大,但仍旧比n-PH组的心功能恢复慢。正如我们的研究中所看到的,术前肺动脉高压与左心室重构的相关性强调了术前对于减轻或纠正肺动脉高压相关疾病的重要性。
5. 局限性
此次研究为单中心观察性研究,这限制了分析患者的数量。同时,随访时间较短。未来仍需进一步观察PH对于两组患者左心逆向重构的影响。
6. 结论
主动脉瓣狭窄患者行经导管主动脉瓣置换术后,左心室逆向重构与术后肺动脉高压改变程度无统计学相关性,且无论基线PASP水平如何,术后心功能状态均显著改善。
NOTES
*第一作者。
#通讯作者。