1. 引言
茵陈Artemisiae Scopariae Herba为菊科植物滨蒿Artemisia scoparia Waldst. et Kit.或茵陈蒿A. capillaris Thunb.的干燥地上部分,又称白蒿、绒蒿,为多基源品种。茵陈味苦、辛、微寒,归脾、胃、肝胆经,具有清利湿热、利胆退黄之功效,主治黄疸尿少、湿温、暑湿、湿疮瘙痒等 [1]。有临床研究表明茵陈对肝炎引起的黄疸,肝胆湿热型慢性乙肝肝炎均具有较好的治疗作用 [2]。茵陈属于多来源植物,基原是影响中医临床疗效的主要因素,多基原品种间化学成分大多是量的差异,但也有少数是化学成分的差异 [3]。因此不同基原的茵陈在治疗肝炎上可能存在差异,而临床使用中未对茵陈的来源进行区分,将滨蒿和茵陈蒿均作为茵陈使用,严重影响中医临床疗效。通过查阅文献及基于BATMAN-TCM数据库发现,滨蒿和茵陈蒿存在着化学成分的差异,这可能使得滨蒿和茵陈蒿在临床使用中功效和作用机制有所区别。基于此,本文通过网络药理学对滨蒿和茵陈蒿治疗肝炎的机制进行预测,通过分析两者治疗肝炎的作用机制的差异,比较两者在治疗肝炎上的异同性。
肝炎是由于各种原因导致肝脏炎症的统称,其中细菌、病毒、寄生虫、酒精、药物、化学物质等多种因素均能引起肝炎 [4] [5]。据文献报道,全球每年约有110万人死于慢性乙型肝炎病毒感染,无论儿童还是成年人,均存在患病的可能,其中病毒感染导致的病毒性肝炎较为常见,各类型肝炎尤其是慢性乙型肝炎的发病率逐年上升 [6]。肝炎的发生具有多因素、多环节致病的机制,而中药具有多靶点、多环节的治病特点,这使得中药对肝炎的发生,发展,形成各个阶段均有治疗作用。网络药理学是通过挖掘大量数据,构建“成分–靶点–疾病”复杂网络图,为作用机制的研究提供了新的思路和方法,因此,本文采用网络药理学的方法,通过挖掘滨蒿和茵陈蒿的化学成分及相关靶点,预测滨蒿和茵陈蒿作用机制的异同性,旨在为临床的使用提供指导。
2. 方法
2.1. 化学成分的建立
通过查阅滨蒿及茵陈蒿相关文献,查找最新报道的化合物,且通过BATMAN-TCM数据库,检索出滨蒿及茵陈蒿所含的所有化学成分。
2.2. 活性成分的筛选
通过TCMSP数据库,BATMAN-TCM数据库及以TCMIP等数据库,TCMSP数据库以筛选ADME参数(OB ≥ 30%和DL ≥ 0.18)为标准 [7],或通过查阅文献以报道具有抗肝炎的化学成分。筛选出滨蒿及茵陈蒿的活性化学成分。
2.3. 靶点的筛选与建立
通过TCMSP数据库、中药靶标数据库综合分析和BATMAN-TCM数据库,筛选滨蒿及茵陈蒿活性化学成分的作用靶点,建立成分靶点数据集,并通过Genecards [8]、OMIM数据库筛选肝炎相关的基因和蛋白靶点,建立疾病–药物肝炎共用靶点数据集。最后将筛选得到的所有靶点均经UniProt数据库查询转化成基因名格式。
2.4. 关键靶点PPI网络构建
为了明确滨蒿及茵陈蒿的潜在抗肝炎靶点之间的相互作用,将筛选出的靶点导入String (https://string-db.org/)中构建靶点互作网络图(PPI),蛋白种类设置为“homo sapiens (人类)”,保存为tsv文件,导入Cytoscape3.6.1中,采用其“Network Analyzer”插件进行分析,确定滨蒿及茵陈蒿的核心抗肝炎的靶点。
2.5. GO生物过程富集分析和KEGG信号通路
将疾病–药物共有靶点导入人类基因组注释数据库DAVID 6.8 (https://david.ncifcrf.gov/)中进行GO生物过程富集分析和KEGG信号通路分析,以P < 0.05作为显著功能与通路的临界值对靶基因进行筛选。
2.6. 药物成分与靶点分子对接
AKT1的蛋白结构(ID: 6LU7)、Insulin的蛋白结构(1UZ9)及IL-6的蛋白结构(ID: 1ALU)下载于RCSB PDB数据库(http://www.rcsb.org/),化合物通过TCMSP、PubChem进行下载,并使用Chem3D进行能量最小化,启动运行SYBYL-X 2.0软件模块中的“Dock Ligand”模块对AKT1、Insulin和IL-6结构进行对接进行加氢处理、修复侧链、并选择自动寻找活性位点等。
3. 结果
3.1. 活性成分的筛选
通过Batman-TCM数据库筛选关键化学成分,以score评分越高说明化合物的活性越强,滨蒿以score > 20,茵陈蒿以score > 48为标准,或通过查阅文献以报道滨蒿及茵陈蒿具有抗肝炎的化学成分,共筛选滨蒿具有活性的化学成分14个,潜在靶点190个,茵陈蒿29个活性成分,潜在靶点578个。其中有3个化学成分是共有的关键成分,分别是6,7-dimethoxycoumarin、arcapillin和cirsimaritin。
3.2. 疾病和药物相关靶点的筛选
在Genecards、OMIM中以“hepatitis”为关键词,检索出与肝炎相关靶基因共1240个,并与滨蒿和茵陈蒿有效成分的相关靶点进行匹配并绘制维恩图,见图1,得到滨蒿与肝炎共同靶点71个,茵陈蒿与肝炎共同靶点共113个,滨蒿–茵陈蒿–肝炎共同靶点31个。

Figure 1. Venn map of hepatitis target gene matching with Artemisia scoparia waldst. et Kit. and A. capillaris Thunb. target
图1. 肝炎靶点与滨蒿、茵陈蒿靶点匹配venn图
3.3. 滨蒿和茵陈蒿抗肝炎的直接作用靶点拓扑参数分析
用String数据库构建关键靶点之间的相互作用图,将滨蒿的71个靶点和茵陈蒿113个靶点分别和一起导入String中。将结果以TSV格式导出,通过Cytoscape3.6.1获取PPI网络中拓扑参数,通过分别计算滨蒿71个靶点和茵陈蒿113个靶点的Degree、Betweenness centrality和Closeness centrality的中位数,取滨蒿和茵陈蒿、以及两者的共有靶点的排名最高的靶点,结果显示滨蒿和茵陈蒿作用的靶点分别为AKT1和INS,滨蒿和茵陈蒿的共有靶点中IL-6排名最高。如图2所示。通过计算每个靶点出现的次数,即基因连接节点的个数,连接节点的个数越多,说明该靶其抗肝炎作通路与关键靶点治疗肝炎时所发挥的作用越重要。
3.4. GO生物学功能富集分析
为了进一步探讨滨蒿和茵陈蒿对肝炎的多重作用机制,对滨蒿和茵陈蒿复合靶点和肝炎相关靶点进行GO富集分析。滨蒿前3位的富集过程包括response to drug (26.76%)、positive regulation of gene expression (21.13%)和negative regulation of apoptotic process (25.35%)。茵陈蒿前3位的富集过程包括response to drug (20.35%)、positive regulation of NF-kappa B transcription factor activity (13.27%)、inflammatory response (18.58%)。其中滨蒿与茵陈蒿前30条富集过程有10条为共用富集过程,如图3所示。为了更好地理解滨蒿和茵陈蒿–肝炎复合靶的生物学过程,对滨蒿和茵陈蒿复合靶的生物学过程进行了可视化分析。如图4所示,黄色圆圈代表滨蒿调整后的p值 < 0.000001的生物学过程,图5黄色圆
 注:绿色为滨蒿和茵陈蒿共有靶点,紫色为滨蒿特有靶点,红色为茵陈蒿特有靶点
注:绿色为滨蒿和茵陈蒿共有靶点,紫色为滨蒿特有靶点,红色为茵陈蒿特有靶点
Figure 2. Potential target protein interaction of anti hepatitis effect of Artemisia scoparia waldst. et Kit. and A. capillaris Thunb.
图2. 滨蒿和茵陈蒿抗肝炎作用的潜在靶点蛋白互作关系图
圈代表茵陈蒿调整后的p值 < 0.00000001的生物学过程,圆圈的大小表示相关靶点在通路富集的多少,圆圈的颜色越深代表P值则越小,富集效果越强,反映了滨蒿和茵陈蒿抗肝炎的作用机制涉及体内多个生物过程的异常,同时也表明了滨蒿和茵陈蒿活性成分可能是通过调节这些生物过程而发挥抗肝炎的作用。
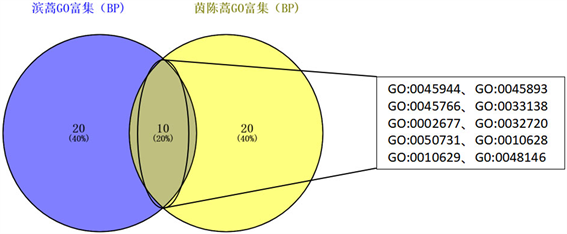
Figure 3. BP process intersection of Artemisia scoparia waldst. et Kit. and A. capillaris Thunb. target
图3. 滨蒿和茵陈蒿BP过程交集图
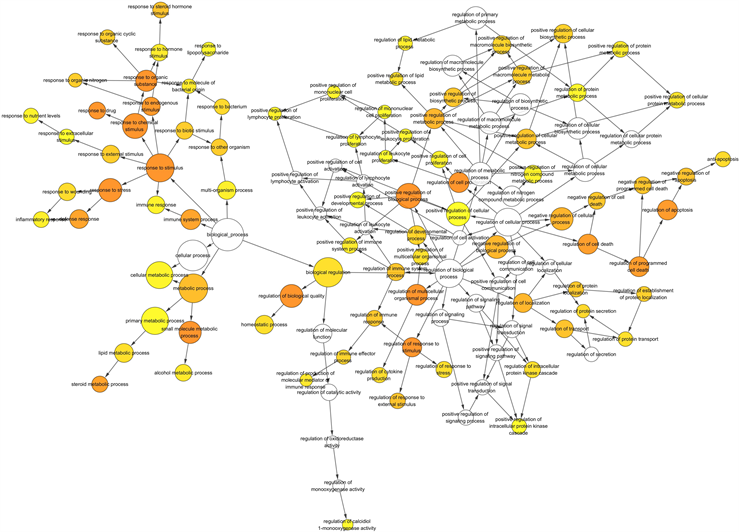
Figure 4. Biological process of Artemisia scoparia waldst. et Kit. and hepatitis
图4. 滨蒿–肝炎的生物学过程
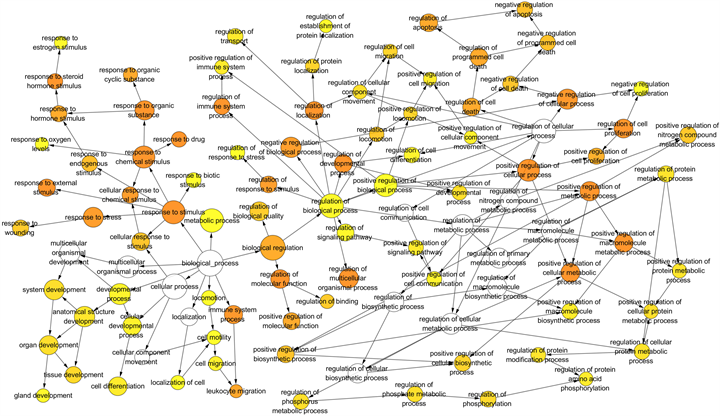
Figure 5. Biological process of A. capillaris Thunb. and hepatitis
图5. 茵陈蒿–肝炎的生物学过程
3.5. KEGG 通路分析
将滨蒿71个靶点和茵陈蒿113个靶点映射到数据库中进行KEGG通路富集分析,滨蒿共富集得到92条信号通路,茵陈蒿共富集得到87条信号通路。通过筛选滨蒿和茵陈蒿KEGG富集结果显著性较强的前20条信号通路,这些通路与滨蒿和茵陈蒿抗肝炎的作用机制密切相关,滨蒿和茵陈蒿共有的通路有5条,分别为Hepatitis B、TNF signaling pathway、Tuberculosis、Toxoplasmosis和Small cell lung cancer,滨蒿治疗肝炎主要通过Pathways in cancer、Hepatitis B、Pancreatic cancer和Prostate cancer等通路进行调控,如图6,表1所示。茵陈蒿治疗肝炎主要通过Measles、Non-alcoholic fatty liver disease (NAFLD)、Inflammatory bowel disease (IBD)、Toxoplasmosis和T cell receptor signaling pathway等通路进行调控。

Figure 6. KEGG intersection pathway of Artemisia scoparia waldst. et Kit. and A. capillaris Thunb.
图6. 滨蒿与茵陈蒿Kegg交集通路


Table 1. Enrichment analysis of KEGG pathway in anti hepatitis effect of Artemisia scoparia waldst. et Kit. and A. capillaris Thunb.
表1. 滨蒿和茵陈蒿抗肝炎作用的KEGG通路富集分析
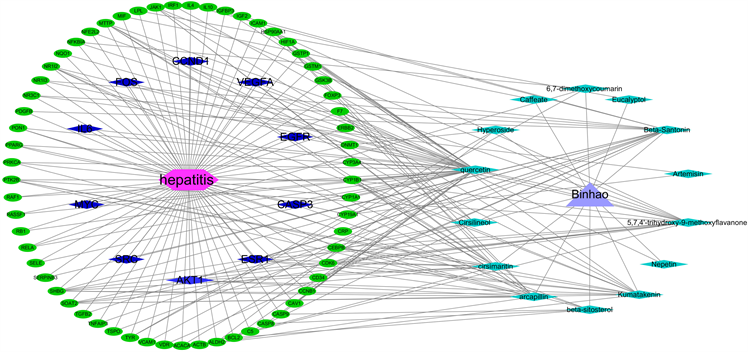
Figure 7. “Component target disease” interactive network of Artemisia scoparia waldst. et Kit. anti-hepatitis effect
图7. 滨蒿抗肝炎作用的“成分–靶点–疾病”交互网络
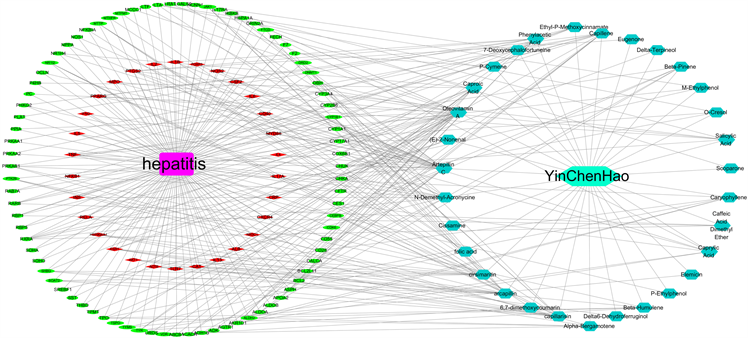
Figure 8. “Component target disease” interactive network of A. capillaris Thunb. anti-hepatitis effect
图8. 茵陈蒿抗肝炎作用的“成分–靶点–疾病”交互网络
为了更清晰的展现有效成分、核心靶点与通路之间的关系。利用Cytoscape3.6.1软件将滨蒿、茵陈蒿中的基因、疾病及成分进行网络可视化分析,通过网络药理学构建出滨蒿、茵陈蒿抗肝炎的交互网络,筛选出相应的交互蛋白,采用不同颜色和形状图形使其可视化后,可直观的看出活性化学成分与靶点之间的网络关系,如图7、图8所示。
3.6. 药物化学成分与疾病靶点分子对接
基于PPI网络和KEGG富集分析结果,选择滨蒿和茵陈蒿各自排名较高及共有靶点综合排名较高的关键靶点(AKT1、INS和IL-6),针对这些靶点的活性成分进行分子对接验证,以总打分值(Total Score) ≥ 5为条件 [9] 筛选对接结果较好的化学成分,总打分值越高说明结合能力较好。滨蒿相关活性成分包括arcapillin、Hyperoside、Kumatakenin、quercetin、Cirsilineol、5,7,4'-trihydroxy-8-methoxyflavanone和cirsimaritin。茵陈蒿的相关活性成分有folic acid、Salicylic acid等。最后将对接结果较好的化学成分和蛋白晶体进行可视化,结果如图11所示。结合成分分子的关键靶标的氨基酸残基清晰地呈现出来,氢键用虚线表示。所有化合物的对接评分如下图9,图10所示。
4. 讨论
网络药理学是利用计算机模拟和生物网络识别预测中药药效物质、作用靶点及通路,而中药药效物
 (a) (b) (c) (d)
(a) (b) (c) (d) 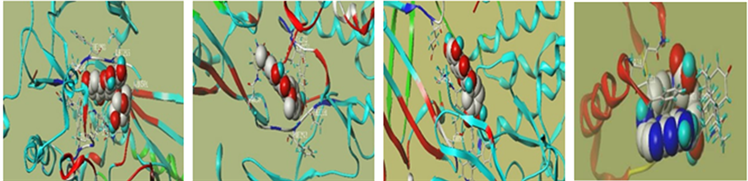 (e) (f) (g) (h)
(e) (f) (g) (h) 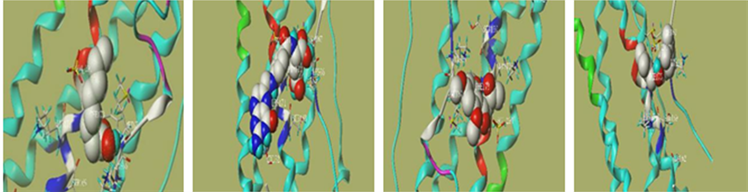 (i) (j) (k) (l)
(i) (j) (k) (l) 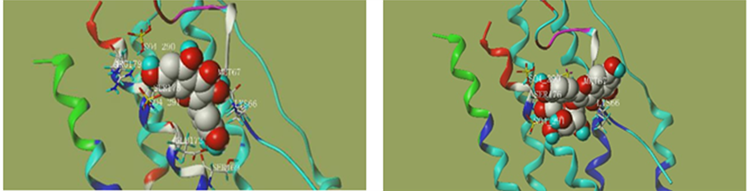 (m) (n) (a): Arcapillin-AKT1; (b): 5,7,4'-trihydroxy-8-methoxyflavanone-AKT1; (c): Cirsilineol-ATK1; (d): Cirsimaritin-AKT1; (e): Hyperoside-AKT1; (f): Kumatakenin-AKT1; (g): quercetin-AKT1; (h):Folic acid-INS; (i): Caprylic Acid-IL-6; (j): Folic acid -IL-6; (k): Eugenone-IL-6; (l): Artepillin C-IL-6; (m): quercetin - IL-6; (n): Hyperoside- IL-6)
(m) (n) (a): Arcapillin-AKT1; (b): 5,7,4'-trihydroxy-8-methoxyflavanone-AKT1; (c): Cirsilineol-ATK1; (d): Cirsimaritin-AKT1; (e): Hyperoside-AKT1; (f): Kumatakenin-AKT1; (g): quercetin-AKT1; (h):Folic acid-INS; (i): Caprylic Acid-IL-6; (j): Folic acid -IL-6; (k): Eugenone-IL-6; (l): Artepillin C-IL-6; (m): quercetin - IL-6; (n): Hyperoside- IL-6)
Figure 9. Visualization of molecular docking results
图9. 分子对接结果可视化
质基础研究是进行中药整体功效和作用本质研究的关键步骤之一 [10]。中药中有多数药材属于多个基原品种,比如威灵仙,大黄、石苇等,值得注意的是,多基原药材威灵仙来源于威灵仙、棉团铁线莲和东北铁线莲,有研究发现威灵仙药材中威灵仙分离得到和常春藤型皂苷化合物各28个,而东北铁线莲齐墩果酸型化合物15个,未见常春藤型皂苷型化合物,棉团铁线莲也未见常春藤型皂苷型化合物的报道 [11]。这些来源于不同品种的威灵仙由于成分差异在网络药理学预测中可能会导致靶点的误筛和作用机制不明确等现象,最终导致预测的结果不可靠。而本文预测滨蒿和茵陈蒿时同样发现,两者的关键化学成分存在较大差异,预测结果也表明,滨蒿和茵陈蒿抗肝炎的作用靶点及作用机制存在相同性和差异性,这也提示我们在临床应用中两者应该区别使用,符合中医理论中的辨证论治。因此不同品种的多基原药材在网络药理学预测中应考虑品种问题,不能一概而论。
迄今为止,有关茵陈及其制剂抗肝炎方面的报道较多,茵陈又分为滨蒿和茵陈蒿,研究发现滨蒿和茵陈蒿对抗肝炎、肝癌、肝硬化等方面具有较好的治疗效果,但目前未有对滨蒿和茵陈蒿抗肝炎的机制比较的报道 [12]。网络药理学通过挖掘大量数据,可对滨蒿和茵陈蒿化合物作用靶点与机制进行初步的筛选与分析。通过网络药理学及分子对接预测结果表明,滨蒿的主要化学成分Hyperoside、quercetin等,这几类成分已被证实具有抗肝炎的作用。例如槲皮素对Con A诱导的小鼠,能显著降低了血清促炎症细胞因子TNF-α、IFN-γ和IL-4的水平,表明槲皮素对急性肝损伤具有保护作用 [13]。茵陈蒿的主要化学成分folic acid等,已有研究表明叶酸可减轻DEN诱发的肝损伤,并减少肝癌的发生 [14]。茵陈蒿的主要化学成分滨蒿和茵陈蒿抗肝炎均与Hepatitis B、TNF signaling pathway等通路有关,滨蒿抗肝炎主要通路是Pathways in cancer,其作用机制与AKT1,BCL2,PRKCA,EGFR和IL6等基因有关。茵陈蒿抗肝炎主要通路是Non-alcoholic fatty liver disease (NAFLD),其作用机制与IL6,TNF,RXRA,RELA和AKT1等基因有关。
本研究中,AKT1基因是滨蒿抗肝炎的关键靶点,INS基因是茵陈蒿抗肝炎综合排名较前的的两个基因,IL6是滨蒿和茵陈蒿抗肝炎均具有关键的靶点,这3个基因在滨蒿和茵陈蒿发挥抗肝炎的作用中起着重要作用,AKT1是一种丝氨酸/苏氨酸蛋白激酶,参与多种生物学过程,包括代谢,增殖,细胞存活,生长,胰岛素信号传导和血管生成等,通过一系列下游底物的丝氨酸和/或苏氨酸磷酸化来介导的 [15]。有研究发现阻断AKT1能抑制NF-κB的表达水平和肝癌的发展,因此AKT1在肝细胞癌细胞系的增殖和迁移中起重要作用,该研究同时证明抑制AKT1表达可能通过抑制SMMC-7721和Hep G2细胞中的NF-κB通路,从而抑制肝癌细胞的增殖及迁移 [16]。AKT1基因在滨蒿中参与Pathways in cancer、Hepatitis B、Pancreatic cancer、Prostate cancer和Proteoglycans in cancer通路,这些通路主要与癌症相关,AKT1基因在茵陈蒿中参与了Non-alcoholic fatty liver disease (NAFLD)、Inflammatory bowel disease (IBD)、Toxoplasmosis和T cell receptor signaling pathway等通路的调控,这些通路主要与肝病、肠炎等疾病相关。INS又称血清胰岛素,是一种多功能的蛋白质激素,对糖、脂肪和蛋白质的代谢起着重要的调节作用。INS可增加了细胞对单糖、氨基酸和脂肪酸的渗透性,可加速肝内糖酵解、戊糖磷酸循环和糖原合成。INS由胰腺中胰岛素β细胞分泌,进入血液后被肝脏摄取,而肝炎特别是病毒性肝炎可使INS的分泌减少,从而引起其他疾病如胰腺炎症。ALB白蛋白又称清蛋白,主要由肝实质细胞合成,是血浆中主要的蛋白成分。白蛋白有维持血管内外体液的平衡,组织蛋白的补充修复,血浆中主要的蛋白载体等功能 [17]。IL-6是具有多种免疫活性的细胞因子,一般是由单核巨噬细胞、内皮细胞产生,病毒性肝炎参与免疫病理反应一般通过IL-6的调控有关,这可能与HBcAg诱导IL-6,最后促使患者产生抗HBc。也可能通过激活T、B等免疫细胞,或使肝细胞白蛋白合成减少,导致免疫系统发生紊乱最终导致病毒性肝炎 [18]。
通过比较滨蒿和茵陈蒿的作用通路的异同性不难发现,Hepatitis B在滨蒿和茵陈蒿中均有分布,且富集结果显著性较大,这说明滨蒿和茵陈蒿可能对病毒性肝炎都具有抑制作用,乙型肝炎病毒(HBV)是一种包膜病毒,RNA的转录模板中的pregenomic RNA (pgRNA)与病毒聚合酶蛋白相互作用,启动包衣进入核心颗粒。核心颗粒在内质网中完成与包膜蛋白的组装,最终被释放。HBV感染可导致慢性肝炎,然后引发肝硬化最终导致肝癌的发生,这又称为“肝癌三部曲” [19] [20] [21]。HBV蛋白靶向宿主蛋白参与多种功能,从而调节转录、细胞信号级联、增殖、分化和凋亡。通过比较滨蒿和茵陈蒿抗肝炎的差异性不难发现,滨蒿的预测结果主要以抗癌症为主,对诸多癌症均有作用通路,其中也包括了肝癌,这说明滨蒿可能对肝硬化和肝癌治疗效果更好,而茵陈蒿预测结果主要以抗炎通路为主,这说明茵陈蒿可能对肝炎治疗效果更好。比较结果发现,滨蒿和茵陈蒿在治疗肝炎时两者是存在差异性的,其分析结果在临床使用上解决了滨蒿和茵陈蒿两者均作为茵陈使用的模糊性。

Figure 11. Labeling map of potential targets of active components in Artemisia scoparia waldst. et Kit. on pathways in cancer signaling pathway
图11. 滨蒿活性成分潜在靶点在Pathways in cancer信号通路上的标注图

Figure 12. Labeling map of potential targets of A. capillaris Thunb. active components on pathways in cancer signaling pathway
图12. 茵陈蒿活性成分潜在靶点在Pathways in cancer信号通路上的标注图
滨蒿抗肝炎主要通路是Pathways in cancer,其通路包含MAPK (ERK) signaling Pathway、PI3K signaling Pathway、WNT signaling Pathway等通路。根据Keggmapper分析结果,肝癌(Hepatocellular carcinoma Liver cancer)在Pathways in cancer通路中与PI3K signaling、WNT signaling和Calcium signaling有关,其调控主要通过直接或间接PI3K-Akt,最终抑制Sustained angiogenesis、Evading apoptosis和Proliferation的发生,如图11所示。
茵陈蒿抗肝炎主要通路是Non-alcoholic fatty liver disease (NAFLD),其通路包含TNF signaling Pathway、PI3K signaling Pathway、Insulin signaling pathway等通路。根据Keggmapper分析结果,由于IL6和TNF-α通过直接或间接激活Akt,Akt磷酸化抑制GSK-3,从而间接作用Hepatocyte insulin resistance。Hepatocyte insulin resistance激活INS基因,最终导致脂肪酸合成,如图12所示。
本文运用网络药理学挖掘和筛选滨蒿、茵陈蒿的活性成分,并对其作用靶点与机制进行初步的筛选与分析,在对其对应的关键靶点及机制进行分析时,发现滨蒿、茵陈蒿的关键靶点AKT1、INS等及相应的通路与糖尿病机制相关,而据目前研究发现,茵陈的降血糖机制是通过促进外周组织对葡萄糖的利用、提高其对胰岛的敏感性,并抑制葡萄糖的吸收而降低血糖的作用 [22]。有研究发现以茵陈为主药的茵陈蒿汤可改善湿热困脾型2型糖尿病患者的血脂水平,这又与有相关报道茵陈可用来治疗糖尿病相吻合。滨蒿、茵陈蒿抗肝炎的机制与Pathways in cancer、Measles有关,但滨蒿、茵陈蒿抗肝炎的具体机制还需进一步研究和验证。
基金项目
贵州省一流课程重点建设项目(黔教高发[2017] 158)。
参考文献