1. 引言
长春花(Catharanthus roseus)是夹竹桃科(Apocynaceae)长春花属(Catharanthus)的一种植物 [1],因其具有150多种萜类吲哚类生物碱(terpenoid indole alkaloids, TIAs) [2] 而被广泛关注。TIAs是含有芳香杂环且由异戊二烯组成的一类生物碱,近年来发现TIAs对治疗癌症等具有非常重要的药用价值 [3]。因此,长春花也成为目前应用最为广泛的药源抗癌植物之一。长春花原产于非洲东部,现广泛栽培于热带和亚热带地区及我国华南、华东以及西南等地,长春花性喜高温、高湿、喜光,在温暖和阳光充足环境生长较好。但长春花栽培到北方地区,因气温寒冷造成长春花不易成活且生长发育缓慢 [4]。因此,为推广长春花在中国华北以及北方地区种植和繁育,对其低温胁迫机制的研究便显得十分重要。
海藻糖(trechalose)是一种非还原性双糖,在许多生物体中用作碳水化合物的储备物质和应激保护剂。它能帮助植物应对高温、高盐渍、干旱、严寒等极端环境,调节植物的气孔导度和水利用率,并作为信号分子调节植物的生长、发育和代谢 [5]。近年来,在烟草(Nicotiana tabacum)、水稻(Oryza sativa)、番茄(Lycopersicon esculentum )等高等植物中也发现海藻糖,但含量甚少。黄瓜(Cucumis sativus)是重要的作物之一,有研究结果表明了一定浓度的海藻糖溶液预处理黄瓜幼苗可提高其在低温、高盐和干旱胁迫下的抗逆性 [6]。与此同时,海藻糖在缓解长春花低温胁迫的研究还鲜有报道,结合海藻糖原料价格低廉,应用前景广泛等特点,探索海藻糖促进长春花对低温耐受性的研究更具有科研价值与市场价值 [7]。
随着实验技术的不断发展,组学在科研中被广泛使用。较之于基因组学和蛋白质组学,代谢组学从最直观地能反映生命活动的代谢物层面进行研究,代谢物能更多地反映细胞或个体所处环境 [8]。为了能检测到植物代谢物的变化情况,植物代谢组学应运而生。目前,植物逆境防御过程中,主要是涉及一些模式植物和作物品种。气相色谱–质谱(gas chromatography-mass spectrometry, GC-MS)联用技术,是目前代谢组学研究中广泛运用的分析技术并且具有很长的研究历史 [9]。目前已发现上调糖类化合物、有机酸类化合物、胺类物质合成是目前植物应对寒冷的生活史策略之一。因此,我们采用GC-MS分析技术结合偏最小二乘法分析(Partial least squares Discriminant Analysis, PLS-DA) [10] 筛选出低温胁迫后长春花叶片中显著变化的化合物,以及低温胁迫后外加海藻糖这些化合物的变化情况,旨在通过化合物的变化解析海藻糖拮抗低温的作用机制。
鉴于外源海藻糖在植物抗逆中的作用,本试验以长春花幼苗为实验材料,以外源海藻糖为调控手段,初步探讨海藻糖对低温胁迫下长春花幼苗生长、保护酶活性、渗透调节物质、初生代谢以及次生代谢途径关键酶基因表达的影响,揭示海藻糖提高长春花幼苗耐低温的作用机制,为海藻糖在长春花适应低温或冷害应用中提供技术支持及理论依据。
2. 材料与方法
2.1. 实验材料
长春花(Catharanthus roseus)种子购于Syngenta;海藻糖购于北京金泰宏达生物科技有限公司。
2.2. 实验方法
2.2.1. 长春花幼苗培养及处理
长春花种子用体积分数为10%的次氯酸钠溶液浸泡10分钟并在自来水下冲洗30分钟,在蒸馏水中吸胀12小时后播种于湿润的蛭石中。选择长势一致的幼苗移栽至盛有Hoagland营养液(pH5.5)中进行培养。所有培养实验均在植物培养室中进行。培养条件是温度为25℃/16℃ (白天/黑夜),白天时间为14 h,光照强度为400 μmoL·m−2·s−1,相对湿度保持在70%左右。水培4周后对长春花幼苗进行4℃低温(LT)与海藻糖(T)处理,处理时培养液中加入海藻糖溶液并使其终浓度达到0、5、10、20 mmol/L,分别标记为CK、LT、LT + T1、LT + T2和LT + T3。每个处理组进行3个重复实验,每个重复包括10株幼苗,处理时间为48小时,处理结束后进行取样进行各项指标的测定。
2.2.2. 叶绿素和丙二醛含量的测定
长春花幼苗植株顶端第二叶序的叶片0.09 g,用80%丙酮/无水乙醇体积为2:1的混合液,提取低温胁迫后的长春花幼苗叶片鲜样的光合色素,避光静置24 h。使用UV-2600紫外可见分光光度计按照张宪政的方法测定665、649和480 nm波长下的吸光值,从而计算叶绿素a、叶绿素b以及类胡萝卜素的含量。将处理后的长春花叶片鲜样0.5 g在5 mL 5%三氯乙酸(TCA)溶液中研磨呈匀浆,在4℃,2504 g离心10分钟,抽取上清液备用,采用硫代巴比妥酸(TBA)法在532、450、600 nm波长下测定其吸光度值计算丙二醛(malondialdehyde, MDA)的含量。
2.2.3. 抗氧化酶的提取和活性测定
酶液的配制:称取0.2 g新鲜长春花植物叶片的样品,加入5 mL 50 mmol/L磷酸缓冲液Na2HPO4-NaH2PO4 (pH = 7.8,含1.0 mmol/L EDTA和1% PVP),置于振荡破碎仪中研磨成匀浆状态后,离心机4℃ 12,000 g,离心20分钟,取上清液。SOD的活性是通过氯化硝基四氮唑蓝(NBT)光化学测定方法测定的。反应混合物(3 mL)包含50 mM磷酸盐缓冲液(pH 7.8),13 mM蛋氨酸,75 μM NBT,0.1 mM EDTA,2 μM核黄素和0.1 mL酶提取物)。POD活性测定,加入1mL邻二氨基二苯胺、0.5 mL H2O2、1 mL磷酸盐缓冲液和2.4 mL蒸馏水的混合物,加入0.2 mL酶提取物开始反应,5 min后加入1 mL H2SO4停止反应。CAT活性的测定,CAT活性在50 mL磷酸盐缓冲液(Ph 7.0)和0.5%PVP-10中提取CAT,并通过在240 nm处测定H2O2的还原来测定其活性;APX活性的测,APX活性反应混合物(3 mL)含有50 mM磷酸钾缓冲液(pH 7.0)、0.1 mM EDTA、0.5 mM抗坏血酸、0.1 mM H2O2和0.1 mL酶提取物。
2.2.4. 气质样品预处理与GC-MS方法
精密称取90 mg长春花叶片鲜样,放入1.5 mL的离心管中进行样品预处理。气相色谱质谱联用仪(Waters,USA)作为本实验的分析仪器。始GC温度为60℃,随后柱箱温度以8℃/min的升至125℃,以4℃/min升至210℃,以5℃/min升至270℃,以10℃/min升至305℃,保持3分钟。电子轰击(EI)离子源保持在260℃,电压:−70 V,质量范围为50~600 m/z,在MS设置下数据采集率为20光谱/秒。GC-MS方法参考刘洋等 [11] 的方法。
2.2.5. 长春花叶片总RNA的提取与次生代谢途径关键酶基因的表达
总RNA的提取采用Trizol法提取取长春花的处理组和对照组叶片各0.2 g放入研钵中,在液氮中迅速研磨成粉末后,放入2 mL离心管中,加入1 mL Trizol混匀,室温静置30分钟。通过氯仿与异丙醇得到质量较好的总RNA
Real-Time PCR仪器为LightCycler® 96,使用SYBR GREEN I为荧光染料,Real-Time PCR反应体系如表1所示。

Table 1. Real time PCR reaction system
表1. Real-Time PCR反应体系
采用常用的3步法,程序设定如下:
第1步:95℃预变性5分钟。第2步:95℃变性20秒;50℃退火15秒;72℃延伸15秒,40个循环。第3步:72℃延伸10分钟。基因的表达量利用2−ΔΔCt方法计算。
2.3. 数据处理
文中所列数据均为3次重复的平均值,SPSS统计软件(19.0, IBM)对实验数据进行统计分析,并采用GraphPad Prism8软件作图。GC-MS数据采用SIMCA-P 11.0版软件(Umetrics, Umea,瑞典)获得归一化数据进行多元统计分析。
3. 结果与分析
3.1. 不同浓度海藻糖对低温中长春花表型的影响
在图1中可以看到LT以及LT + T处理后对长春花幼苗形态的影响。与CK相比,在低温胁迫下,长春花幼苗表现出茎与根生长相对较短,叶片更致密,植株矮小、叶片发黄等现象。而低温胁迫后外加海藻糖后根与茎生长与低温处理相比有所增长,但还是低于CK组。
 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 1. The effect of different concentrations of trehalose on the phenotype of Catharanthus roseus at low temperature
图1. 不同浓度海藻糖对低温中长春花表型的影响
3.2. 不同浓度海藻糖对低温中长春花叶片叶绿素含量的影响
图2(A-D)所示,在低温处理48小时后,随着海藻糖浓度的增加,叶绿素a、叶绿素b、类胡萝卜素以及叶绿素总含量都呈现先升高后降低的趋势并且显著低于CK (P < 0.05)。在海藻糖处理浓度为5 mmol/L时,达到最高。叶绿素a、叶绿素b、类胡萝卜素以及叶绿素总含量在施加5 mmol/L海藻糖与LT相比分别增加了61.86%、54.83%、82.84%和61.86%。表明在低温条件下,外源施加一定浓度的海藻糖能够有效促进长春花幼苗叶绿素的合成,且5 mmol/L浓度的海藻糖处理效果最为明显。
3.3. 不同浓度海藻糖对低温中长春花叶片丙二醛含量的影响
图2(E)所示,4℃低温胁迫处理48小时后,与CK相比,MDA的含量显著上升(P < 0.05),随着海藻糖浓度的增加,叶片中丙二醛的含量呈现持续降低的趋势,并且明显低于LT (P < 0.05),与LT相比分别降低了37.5%、50%和55.5%,说明在低温处理下,外源施加海藻糖能有效降低叶片中MDA的含量,减少叶片膜脂过氧化的程度,缓解低温胁迫带来的伤害。
 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 2. Changes of chlorophyll content in Catharanthus roseus leaves (E). Changes of Malondialdehyde Content in Catharanthus roseus leaves. Different lowercase letters indicate significant differences (P < 0.05)
图2. 长春花叶片叶绿素含量的变化(E)。丙二醛含量的变化。不同小写字母表示差异显著(P < 0.05)
3.4. 不同浓度海藻糖对低温中长春花叶片保护性酶活性的影响
由图3可知,低温胁迫下长春花幼苗叶片SOD、POD、CAT和APX活性均低于对照组(CK)的酶活性活性,LT中SOD、POD、APX和CAT与CK相比酶活分别降低了50.9%、46.7%、40%和25%,说明低温胁迫后长春花幼苗中抗氧化酶的活性降低。随着外源海藻糖不断增加,幼苗中酶的活性先升高后降低,当海藻糖浓度为5 mmol/L时,提升达到最大值;继续增加海藻糖到10 mmol/L后,幼苗中酶的活性逐渐降低。说明高浓度的海藻糖有抑制抗氧化酶活性的作用。当海藻糖浓度为5 mmol/L时,效果最为显著(P < 0.01)。说明外源海藻糖可大幅提高低温下抗氧化酶的活性,且最适宜海藻糖浓度为5 mmol/L。
3.5. 不同浓度海藻糖对低温中长春花叶片初生代谢物积累的影响
图4所示为样品13的GC-MS原始色谱图。由图可以看出,GC-MS色谱S峰基线较平稳,且色谱峰被有效的分离,该方法稳定、可靠,研究数据可进行后续统计分析和处理。对GC-MS原始数据进行预处理后,根据色谱峰的保留时间等信息在NIST数据库和Wiley Registry代谢组数据库对检测到的色谱峰定性注释,共定性出了59种代谢产物。
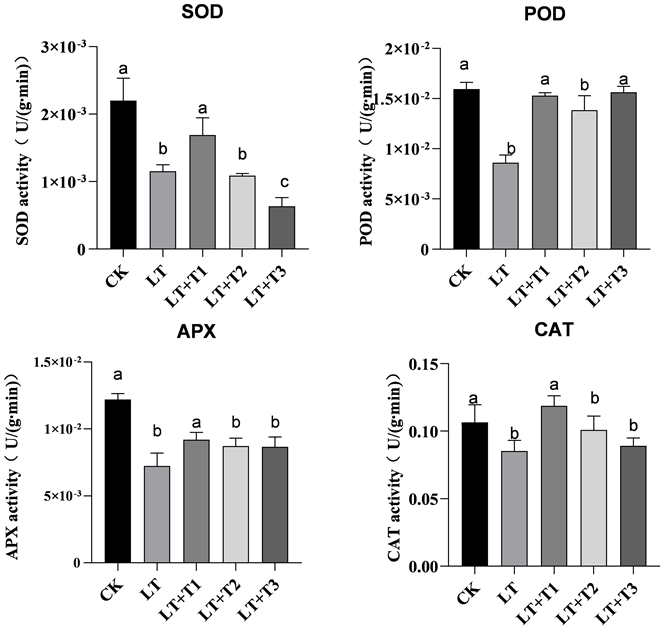 A:超氧化物歧化酶(SOD) B:过氧化氢酶(POD) C:抗坏血酸过氧化物酶(APX) D:CAT过氧化物酶(CAT)。CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
A:超氧化物歧化酶(SOD) B:过氧化氢酶(POD) C:抗坏血酸过氧化物酶(APX) D:CAT过氧化物酶(CAT)。CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 3. (A)~(D) Effects of trehalose on protective enzyme activities of Catharanthus roseus leaves under low temperature Different lowercase letters indicate significant differences (P < 0.05)
图3. (A)~(D)不同浓度海藻糖处理对低温下长春花叶片保护性酶活性的影响。不同小写字母表示差异显著(P < 0.05)

Figure 4. Original chromatogram of GC-MS sample 13
图4. GC-MS样品13的原始色谱图
研究低温胁迫下不同浓度海藻糖处理下长春花幼苗叶片的初生代谢物的变化差异,对CK组和不同实验组进行了偏最小二乘回归分析(PLS-DA分析)。通过PLS-DA方法能较好的将CK与处理组区分开(R2 = 0.0859, Q2 = 0.966) (图5),LT位于置信区间左侧,CK与低温加海藻糖的组位于置信区间右侧,CK与LT + T1、LT + T3聚在一起区别不大并且CK与LT + T1几乎完全重叠没有差别。说明LT + T1即5 mmol/L海藻糖溶液处理效果最佳,其次是10 mmol/L。低温胁迫外加海藻糖后代谢物的变化与CK相似,证明海藻糖通过影响初生代谢来缓解低温胁迫带来的伤害。
 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L 海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L 海藻糖
Figure 5. Partial least squares analysis (PLS-DA)
图5. 偏最小二乘法分析(PLS-DA)
根据模式识别模型的VIP (variable importance for the projection)值筛选差异代谢物。VIP值并结合t检验,从59种初生代谢产物中共鉴定了23种具有显著差异的化合物。糖类化合物7种、酸类化合物7种和其他化合物9种。将通过GC-MS技术得到的数据归一化处理后,进行聚类分析,得到低温胁迫不同浓度海藻糖处理下长春花叶片差异化合物的热图(图6 )。与CK相比,糖类化合物如甘露糖在低温处理后明显积累而低温处理加海藻糖后含量显著降低;有机酸类化合物像丙酸、苹果酸、没食子酸低温处理后含量显著降低低温处理后施加外源添加海藻糖含量显著上升;一些抗逆物质如尸胺、硅烷低温处理后含量显著上升处理后外源添加海藻糖其含量显著下降。
3.6. 差异合物的代谢途径富集分析
根据MetaboAnalyst3.0的通路分析模块,对这些显著变化的代谢物进行代谢途径富集分析。共有13条相关代谢途径。路径分析的结果如图7所示,最后得出半乳糖代谢、硫代谢、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢、柠檬酸循环(TCA循环)和果糖和甘露糖代谢是6种受影响最严重的代谢途径。
 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 6. Hierarchical cluster analysis heat map of metabolites with significant differenc
图6. 显著差异代谢物的层次聚类分析热图
3.7. 次生代谢关键酶基因的表达情况
3.7.1. 总RMA的提取
以长春花叶片为材料,提取总RNA。用1%琼脂糖凝胶电泳分析总RNA质量,长春花叶片的总RNA完整性好,条带清晰,共有3条条带;从上到下分别是28SrRNA、18SrRNA和5SrRNA (图8)。使用UV-2600紫外分光光度计检测RNA的吸光度(表2)计算OD260/280比值,均在1.8~2.0之间。综上,RNA的提取质量良好。
 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 7. Analysis of related metabolic pathways
图7. 相关代谢途径富集分析
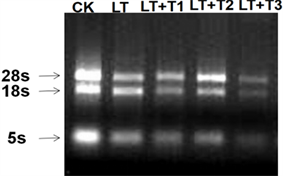 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 8. Agarose electrophoresis of total RNA from Catharanthus roseus leaves
图8. 长春花叶片总RNA琼脂糖凝胶电泳图
CK: Control Check; LT: Low Temperature; LT + T1: Low Temperature + 5 mmol/L Trehalose;
LT + T2: Low Temperature + 10 mmol/L Trehalose; LT + T3: Low Temperature + 20 mmol/L Trehalose.
3.7.2. 设计Real-Time PCR引物
根据长春花已知酚类代谢途径选取4个酶基因(CrPAL、CrC4H、CrDXR和CrOMT)和生物碱代谢途径选取4个关键酶基因(CrTDC、CrSTR、CrLAMT和CrGES)以及内参基因CrActin3,利用Primer Premier 5设计Real-Time PCR的特异性引物,引物序列如表3。

Table 3. Primers used in this chapter
表3. 本章所有的引物
3.7.3. 次生代谢关键酶基因的表达情况
CrPAL、CrC4H、CrDXR、CrOMT是酚类化合物代谢途径关键酶基因(图9(A))。这些基因在低温处理后均被显著上调。说明低温处理不仅上调生物碱途径也上调酚类代谢途径的上游途径,而外加海藻糖后均显著下调(P < 0.01)。苯丙氨酸裂解酶(PAL)是限制长春花中酚类化合物形成的第一个主要酶,CrPAL基因在低温胁迫后显著上调,与CK相比基因表达量增张了300多倍,说明酚类代谢途径在低温胁迫后显著上调,酚类化合物的合成是植物应对低温胁迫的一个生活史策略,通过合成酚类化合物调控自身代谢来实验逆境。外加海藻糖后CrPAL表达回复到CK水平,说明海藻糖通过调控酚类化合物合成与代谢来缓解低温胁迫的伤害。
CrTDC、CrLAMT、CrSTR和CrGES均是TIA生物合成途径中重要的限速酶基因(图9(B))。低温胁迫后这些关键酶基因的表达均显著上调(P < 0.01),CrTDC、CrLAMT、CrSTR和CrGES与CK相比分别上调了140%、399%、400%和143%,表明低温胁迫后会使生物碱代谢途径显著上调。而低温胁迫后施加海藻糖,这些关键酶基因显著下调(P < 0.05)恢复到CK的基因表达,说明海藻糖通过下调生物碱代谢来缓解低温胁迫的伤害。
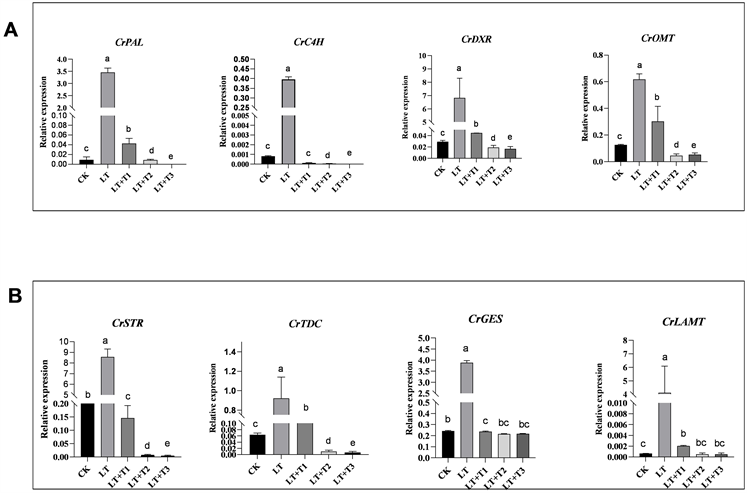 CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
CK:对照组;LT:低温处理组;LT + T1:低温 + 5 mmol/L海藻糖;LT + T2:低温 + 10 mmol/L海藻糖;LT + T3:低温 + 20 mmol/L海藻糖
Figure 9. After low temperature stress, trehalose was added to the leaves (A) the expression of key enzyme genes of phenolic pathway (B) the expression of key enzyme genes of alkaloid pathway
图9. 低温胁迫后外加海藻糖长春花叶片(A)酚类途径关键酶基因表达情况(B)生物碱途径关键酶基因的表达情况
4. 讨论与结论
4.1. 海藻糖对低温胁迫下长春花幼苗生理生化的影响
低温胁迫反应到植物体上有许多可见的变化即植株的表型变化,是环境因素干扰的最直观表现。随着低温胁迫时间的延长,植物叶片有萎蔫、生长迟缓、黄化等直观的现象 [12]。在本实验中,长春花幼苗在低温胁迫下,呈现出了叶片萎蔫植株矮小等明显的胁迫症状,外加海藻糖后有一定程度的恢复。说明在表型变化上直观反应了海藻糖可缓解低温胁迫带来的伤害。
植物叶绿体对低温胁迫高度敏感,进而会抑制光合作用及其碳代谢,从超微结构来看这是由于低温损伤细胞器的结构,而且还会改变色素和叶绿体中的代谢物浓度以及气孔调节 [13]。越来越多的证据表明,叶绿体可以感知外部刺激并迅速响应外部压力,根据外部胁迫信号并调节与胁迫相关核基因的表达以适应不利的环境条件 [14]。低温条件下,光合速率被严重负影响。低温条件下番木瓜(Carica papaya L.)叶片中总糖和可溶性蛋白质含量增加,可能是由于低温诱导的渗透胁迫所致 [15]。前人研究结果均发现温度降低会导植物叶片中叶绿素缺失甚至导致植物中叶绿体的结构被破坏,光合能力削弱。本研究中对长春花幼苗的生长表型的观察和光合色素含量测量,发现在低温胁迫下,长春花幼苗长势较差,叶片发黄萎蔫,光合色素含量都降低,严重影响其正常的生长发育,与前人研究结果一致。然而外源施加海藻糖后,长春花叶片中叶绿素含量显著上升,说明含海藻糖能够有效缓解低温胁迫对长春花幼苗叶绿素与光合作用带来的这种负面影响,促进其生理机能。
丙二醛(MDA)是膜脂过氧化的分解产物,MDA容易与植物体和细胞内的各类蛋白质结合,通过破坏蛋白质的活性,从而破坏膜的结构,因此MDA通常可以作为膜受损程度的指标参数。前人研究发现温度降低与丙二醛含量增高呈现正相关光系。低温(LT)和低辐射(LI)是对植物造成极大危害的常见因素。本研究旨在阐明LT和LI及其恢复对草莓幼苗光合机构、PSII光抑制和活性氧代谢的影响。结果表明,在LI、LT和复合胁迫下,草莓生长缓慢甚至停止,过氧化氢和丙二醛含量增加 [16]。另有研究发现低温胁迫损伤了羊草的生长和光合色素,提高了其丙二醛(MDA)、渗透压和酶抗氧化物的积累 [17]。在本研究中,低温胁迫中长春花幼苗叶片的MDA含量显著增加,但外源添加不同浓度海藻糖溶液后,MDA含量显著降低,实验结果证明海藻糖能显著降低低温胁迫对细胞膜脂过氧化程度,缓解低温胁迫对长春花幼苗叶片的伤害。
4.2. 海藻糖对低温胁迫下长春花幼苗保护性酶活性的影响
SOD、POD和CAT是一类可以有效清除植物体内活性氧的酶促系统,可反映出植物体内生理代谢状况 [18]。在低温胁迫和恢复条件下,研究了施硒对两个草莓品种Akihime和Benihoppe的影响,测定了抗氧化酶活性变化,发现随着低温胁迫时间的延长,超氧化物歧化酶、过氧化氢酶和过氧化物酶的活性显著降低 [19]。对番茄(Lycopersicon esculentum)进行低温胁迫处理,发现低温胁迫显著降低叶片中SOD、CAT、POD和APX活性,抑制番茄植株的生长 [20]。在对西瓜氧化代谢的影响研究中发现,低温胁迫导致:i) 地上部重量降低;ii) H2O2的积累;iii) SOD活性降低;iv) 与H2O2解毒相关的酶活性降低 [21]。以玉米杂交种335为材料,发现低温胁迫显著降低了SOD、POD、CAT、GR等抗氧化酶活性,增加GSH、脯氨酸等非酶抗氧化物的含量,诱导一氧化氮(NO)的积累。NO清除c-PTIO和NOS抑制剂L-NAME降低,但NO供体SNP增加CAT和POD酶活性及脯氨酸含量,表明NO介导了EBR诱导的抗氧化能力。说明LT应答基因受NO调控通过调节抗氧化能力和LT反应基因的表达,参与了EBR诱导的玉米胚LT耐受 [22]。为了解低温处理(LTC,12℃处理3d)提高猕猴桃(Actinidia chinensis)抗寒性的机制,研究结果发现低温胁迫下丙二醛、超氧自由基和过氧化氢的显著积累和膜透性的增加,超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶和过氧化物酶的活性显著降低。处理还保持了较高的内源脱落酸(ABA)、吲哚乙酸(IAA)和玉米素核苷(ZR)水平,较低的赤霉素(GA(3))水平和较高的ABA/GA(3)和ABA/IAA比值 [23]。烟草(Nicotiana tabacum)和黑麦(Secale cereale)在低温下表现出不同的抗氧化防御策略。烟草植株通过提高SOD、APX和CAT的活性,对低温硬化过程中的氧化损伤起到保护作用。由于SOD活性在细胞内的均匀分布,维持了SOD、APX和CAT的组成活性,并且可能由于非酶抗氧化剂的积累,冬黑麦植株能够避免在硬化过程中产生氧化应激 [24]。与前人研究结果一致,在本研究中,LT处理后,抗氧化酶的活性显著降低;外源添加不同浓度的海藻糖后,抗氧化酶的活性显著增强,海藻糖可以提高低温胁迫下长春花幼苗的抗氧化活性,缓解低温处理所带来的抑制作用。
4.3. 海藻糖对低温胁迫下长春花幼苗初生代谢的影响
植物代谢组学的研究包括分析各种具有不同物理性质的化学物质,从离子无机化合物到生物化学衍生的亲水性碳水化合物、有机酸和氨基酸,以及一系列疏水性脂质相关化合物。这种复杂性给当前植物代谢组学研究中所采用的分析技术带来了巨大的挑战,需要强有力的分析工具来分离和表征生物样品基质中存在的这种极高的化合物多样性。利用质谱(MS)分析平台来分析胁迫反应的代谢物,使一些植物能够适应不利的环境条件,是当前植物生物技术研究项目中理解和开发耐胁迫植物的基础 [25]。植物应对寒冷的反应是增加糖、有机酸、胺和具有冰点降低、低温保护和抗氧化特性的特殊代谢物的浓度 [26]。在对茶树(Camellia sinensis L.)的低温胁迫实验中,采用气GC-MS和多变量分析方法,发现茶树对不同程度低温胁迫响应有所不同,并能以不同的方式改变自身的代谢途径。这可能有助于从代谢水平上了解茶树抗寒机理,为今后研究冬性茶多酚(DP)和茶多酚(OA)在茶树体内的基因和蛋白表达提供依据 [27]。紫罗勒(Ocimumbasilicum)是罗勒的重要形态变种之一,通过GC/MS测定挥发油成分,并用HPLC测定三种重要酚酸含量(mg/kg)。在较低温度下芳樟醇含量较高。在两种温度条件下,控制CO2浓度(400 ppm)苯丙酸总含量最高,并呈规律性下降,迷迭香酸和咖啡酸产量的最高数据是在较低的温度下获得的,而二氧化碳浓度没有规律的趋势 [28]。在对矮牵牛(Petunia hybrida)低温栽培实验中通过GC-MS/MS测定,数据显示了三个连续的低温反应阶段。最初几天的特点是糖的大量积累,特别是在源叶中,同一组织中的基因优先上调,茎尖的几个基因下调,特别是那些参与非生物胁迫反应的基因。中期阶段的特点是碳水化合物水平和基因表达的部分正常化。冷暴露3周后,建立了一个新的稳定平衡。茎尖己糖含量降低,茎尖与叶之间的糖含量比值降低,顶端蔗糖/己糖比值升高,与细胞壁转化酶活性和表达降低有关,表明长时间低温诱导源叶糖积累,而减少糖向和的转运降低了茎中蔗糖的利用率 [29]。说明糖类化合物代谢在植物应对低温胁迫中起着重要作用。本研究发现糖类化合物半乳糖、葡萄糖、鼠李糖、蔗糖在低温处理后含量显著降低,与前人研究一致有研究采用GC-MS分析发现,低温上调了蔗糖代谢、糖酵解、糖异生、发酵和GABA分流等一级代谢相关基因,导致蔗糖和苹果酸、柠檬酸、酮戊二酸等有机酸含量下降,己糖和GABA积在不同温度条件下(以播种期为基础)生长的花生基因型中分析了各种代谢物 [30]。用GC-MS对叶片组织进行非靶向代谢组学分析,用HPLC (多胺)和UPLC-MS/MS (酚类)另有实验对pegging和pod灌浆期的代谢产物进行靶向分析。低温胁迫下腐胺的积累量较高 [31]。本研究中也证明低温胁迫后腐胺含量显著增高,而低温胁迫外加海藻糖后腐胺含量显著降低,说明海藻糖可能通过调控腐胺代谢来缓解低温胁迫带来的伤害。石莼(Ulva lactuca)是一种具有药用和食用潜力的海洋大型藻类,采用GC-MS分析了多产链霉菌在温度胁迫下的代谢变化,共鉴定出67种化合物。PCA和正交偏最小二乘判别分析(OPLS-DA)结果表明,而低温胁迫下有9种和6种代谢物水平分别显著升高和降低。三羧酸循环和淀粉/蔗糖、酪氨酸和精氨酸/脯氨酸代谢参与低温胁迫反应 [32]。与前人研究有相似,亦有不同。本研究通过对差异化合物进行代谢途径富集分析发现半乳糖代谢、硫代谢、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢、柠檬酸循环和果糖和甘露糖代谢是6条受影响最严重的代谢途径。证明了不同植物在应对低温胁迫时所形成的代谢调控是有差异的,根本原因是基因水平的差异导致物种差异进而导致应对低温胁迫所形成的生活史策略不用,这恰恰也验证了物种间的统一性与差异性。
4.4. 海藻糖对低温胁迫下长春花幼苗关键酶基因表达的影响
酚类化合物由于其氧化还原特性而在植物驱动的抗氧化剂活性中起着重要作用,酚类物质是植物中广泛分布的次生植物代谢物的一大类 [33]。低温诱导黄瓜(Cucumis sativus)叶片CaPAL基因的表达和酶活性。AOPP处理的幼苗CaPAL活性较低,酚类和黄酮类物质积累较少。低温对黄瓜幼苗造成伤害,AOPP预处理加重了这种伤害 [34]。在对拟南芥冷敏1-1 (chs1-1)的研究中发现AtCHS1或AtCHL1的过度表达减轻了低温伤害,促进了植物在中等(24℃)和低温(13℃)温度下的生长,表明这两种蛋白质在生长稳态中都起作用。在红叶芥菜(Brassica juncea)的幼苗暴露于低温(8℃) 52 h胁迫处理中,发现低温胁迫后,BjPAL的表达迅速增加 [35]。低温诱导了欧芹(Petroselinum crispum)花青素的积累,RNA凝胶杂交分析表明,二氢黄酮醇4-还原酶基因(DFR)的表达尤其受低温的影响并且苯丙氨酸解氨酶基因(PAL)和查尔酮合酶基因(CHS)在12℃和25℃时均呈协同表达 [36],表明酚类化合物的代谢调控受到低温的显著影响,PcPAL、PcCHS等酚类化合物合成途径的关键酶基因的表达受到低温的显著调控。另有研究发现短期的低温胁迫显著影响上调果沙棘(Hippophaeneurocarpa)试管苗叶片HnPAL、HnC4H和Hn4CL的活性,苯丙烷类代谢被激活,调控黄酮类等次生代谢物质的合成 [37]。在非生物胁迫的刺激下,苯丙氨酸经过一系列酶催化合成花色素苷,最终通过谷胱甘肽S-转移酶运输到液泡中,参与机体防御。Dong等(2020)通过15℃/5℃昼夜低温处理秋海棠(Begonia grandis)植株发现低温诱导花色素苷含量显著升高,并且对响应低温的差异表达基因进行了验证,结果显示在花色素生物合成途径中关键基因苯丙氨酸解氨酶(BsPAL)、查耳酮合酶(BsCHS)、黄烷酮3-羟化酶(BsF3H)和花青素合酶基因(BsANS)在低温培养条件下显著上调 [38]。前人的研究结果说明低温胁迫可显著上调酚类化合物合成途径的关键酶基因的表达,这与我们的研究结果一致。我们发现低温胁迫下CrPAL、CrC4H、CrICS、CrCM、CrDXR和CrOMT基因表达均显著上调,外加海藻糖后这些基因的表达显著下调恢复到CK组的表达量。说明海藻糖在基因层面缓解低温对长春花带来的伤害。
长春花中生物碱代谢受到多条代谢途径与多种转录因子的调控。大量研究表明,在低温胁迫中,CBFs显著上调可以有效调控表达的功能基因有COR、DHN (脱水蛋白)、RD (响应脱水)和LTI (低温诱导)等,通过调控这些基因的表达可提高植物抵御低温的能力 [14]。虽然目前对长春花生物碱途径关键酶基因在低温胁迫下的具体变化研究甚少,但是先前的研究足以表明生物碱途径受到低温生理因素的影响。本研究通过测定生物碱代谢途径关键酶基因的表达情况发现,该途径的上游途径在低温胁迫后显著上调,外加海藻糖后显著下调。与前人研究结果一致,生物碱与低温胁迫正相关,低温胁迫会促进生物碱的积累。
低温胁迫显著抑制长春花幼苗的生长发育,降低了长春花幼苗叶片叶绿素的含量与保护性酶的活性,提高了MDA的含量;低温胁迫后施加不同浓度的海藻糖,SOD、POD、APX和CAT活性呈现先升高后降低趋势,MDA含量显著降低;并且5 mmol/L海藻糖浓度效果最佳。GC-MS及PLA-SD分析从59种初生代谢产物中发现23种化合物具有显著差异。糖类化合物(如甘露糖)以及一些抗逆物质(如尸胺、硅烷)在低温处理后明显积累,而外源添加海藻糖后其含量显著下降。有机酸类化合物像丙酸、苹果酸、没食子酸等却表现出相反的趋势。说明海藻糖通过调控一些糖类、有机酸和抗逆性等初生代谢物来减少低温带来的伤害。根据长春花已知酚类代谢途径选取4个酶基因(CrPAL、CrC4H、CrDXR和CrOMT)和生物碱代谢途径选取4个关键酶基因(CrTDC、CrSTR、CrLAMT和CrGES)这些关键酶基因在低温胁迫后均显著上调,外加海藻糖后显著下调。UPLC-MS测定长春花叶片中6种生物碱发现,文多灵、长春质检、色胺、马钱苷、长春碱和它波宁在低温处理后显著上升,外加海藻糖后含量均显著下降。说明海藻糖的调控作用也会通过长春花的次生代谢途径缓解低温带来的胁迫。
致谢
由衷感谢导师唐中华教授在三年研究生学习过程中对我的细心教导以及课题组其他的老师王洪政老师、张衷华老师、郭晓瑞老师以及李德文老师在我生活与实验中的帮助,感谢刘洋师姐、刘佳师姐、常纯皓师兄、杨楠师姐、闫雪、宋莹等同学以及魏鑫等师弟师妹的帮助。
基金项目
本研究由国家自然科学基金(31400337)资助完成。