1. 引言
中国化学奥林匹克竞赛(以下简称化学奥赛)是由中国化学会举办、具有选拔功能的竞赛活动。化学奥赛可拓展学生的视野,培养学生思维能力;检验中学化学教学效果,促进中学化学教育的改革;展示学生化学水平,具有人才选拔的作用。
对2011~2020年化学奥赛试题的整理发现,缩合反应是化学奥赛的热点考查内容,常与其他有机反应联合考查,考查难度较大。缩合反应是构建碳骨架、引进官能团的重要反应,在天然产物、香料、药物等的合成中应用广泛,是化学奥赛的高频考点。笔者通过查阅CNKI、维普、万方等数据库,发现对化学奥赛和缩合反应的独立研究较多,但尚未发现对化学奥赛中缩合反应的研究报道。因此,笔者以奥赛试题中的缩合反应为研究对象,对中国化学奥赛试题进行研究,帮助参赛学生和教练更深入地了解缩合反应,了解化学奥赛中缩合反应的考查形式,并针对此内容制定相应的教学和学习计划,促进化学奥赛的良性发展。
2. 2011~2020年中国化学奥林匹克竞赛中缩合反应的试题研究
2.1. 试题中缩合反应考查情况统计
对2011~2020年化学奥赛初赛试题中缩合反应的考查情况进行统计,其统计结果见表1。其中权重1为试题中涉及缩合反应的分值占有机试题分值的比重(下同)。表中的“\”是资料收集不完整,笔者无法确定的信息(下同)。

Table 1. Statistical results of condensation reactions in the Preliminary examination questions of the 25th~34th Chinese Chemistry Olympiad
表1. 第25~34届奥赛初赛试题中缩合反应的统计结果
从表1可以看出,有机化学部分在化学奥赛初赛中占有很大比重,约为30分;缩合反应在化学奥赛初赛中考查较为频繁,且在有机试题部分占比较大;不同缩合反应考查的频率不同,考查较多的是Michael加成反应和Aldol缩合反应;同年试题中,一般涉及2个缩合反应,也有3个缩合反应联合考查的,只考一个缩合反应也在试题中出现。需要提及的是,近三年初赛试题中没有缩合反应出现,这不是缩合反应不重要,而是缩合反应相对较难,将其设置在了决赛试题中(见表2)。
缩合反应在化学奥赛决赛中的考查情况与初赛有差异,其统计结果见表2。

Table 2. Statistical results of condensation reactions in the final examination questions of the 25th~34th Chinese Chemistry Olympiad
表2. 第25~34届奥赛决赛试题中缩合反应的统计结果
从表2可以看出,在决赛中缩合反应在有机试题部分占比较大。与初赛相比,缩合反应的考查几乎每年都有,相较初赛更为频繁;虽有只考查一个缩合反应的年份,但常常是二个缩合反应融合在一道试题中,试题考查的知识面更广,综合型更强;考查重点仍然是Aldol缩合和Michael加成反应。
2.2. 有关缩合反应的典型试题分析
缩合反应在化学奥赛中考查频繁,形式多样。为了更深入地理解此类试题,笔者以决赛中涉及到缩合反应的某些试题为例,进行详细分析,归纳其试题特点。
例1、第25届决赛第7题 (18分/6分)
2002年,Scott等人首次完成了的C60化学全合成,该成果为今后合成更多和更丰富的C60衍生物带来了可能。下面是其全合成的路线。
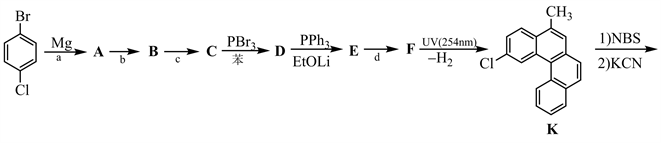
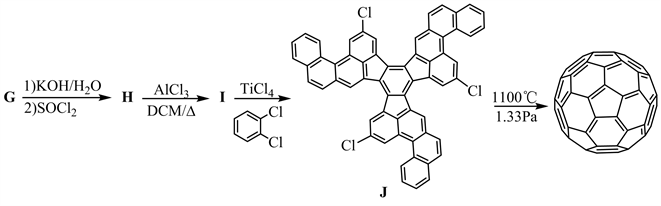
7-1 写出上述合成路线中a、b、c和d所对应的试剂或反应条件;
7-2 画出上述合成路线中间体A~I的结构简式;
7-3 写出中间体J的对称元素;
7-4 给出从中间体I到J的反应机理。
【思路】该题给出了部分反应条件和反应产物,其余的需要我们根据已知条件,采用顺推和逆推相结合的方法进行分析。首先,由起始原料到A的过程有金属镁的参与,很容易想到是格氏试剂的制备过程。PBr3是一种常见的溴化剂,常用来将醇转变为溴化物,因此C中应该含有一个醇羟基,与PBr3反应生成溴代物D。然后由化合物K逆推,从F→K的过程中,失去了一分子的H2,该过程可能是脱氢芳构化,那么可以推出F的结构如下:
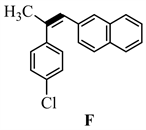
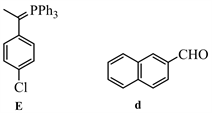
从D→E过程的反应条件是PPh3和EtOLi,很容易看出是溴代物D与PPh3反应制备Wittig试剂的过程,则E是Wittig试剂。E→F的过程是Wittig反应,那么F中加粗的碳碳双键是通过Wittig反应形成的,可以推出化合物E和试剂d的结构如下:
采用逆推法,知道了E的结构,很容易推出D的结构(见下)。D是C与PBr3反应生成的溴代物,那也就知道了C的结构(见下)。结合起始原料,金属镁应与对氯溴苯的溴端反应,生成格氏试剂A,则反应条件a是无水乙醚。从A→B→C是格氏试剂与羰基化合物反应生成相应的镁盐B (见下),再经酸转变为相应醇C。结合A、C的结构,则试剂b是乙醛,反应条件c是H2O/H+。化合物A、B、C、D的结构如下:

接着,从化合物K开始,根据反应条件依次顺推化合物G、H、I的结构。NBS (N-溴代丁二酰亚胺)是一种良好的溴化剂,能取代化合物K中芳甲基上-H转变为-Br,再与KCN反应生成G (见下)。在碱性条件下,G中的氰基水解变成羧基,然后与SOCl2反应生成H (见下)。H发生分子内Friedel-Crafts酰基化反应生成I,则化合物G、H、I的结构如下:

知道了I和J的结构,且从I→J的反应条件是TiCl4和邻二氯苯,那么猜测I经过TiCl4催化的Aldol缩合、随后环化生成J,其机理如下:

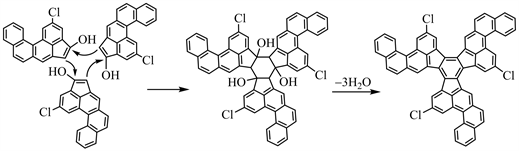
【评价】该题是以2002年Scott等人报道的C60的全合成路线为背景 [1],考查学生对有机化学中的典型反应及反应条件的掌握,是一道很经典的有机合成推断题。在该题中涉及了格氏试剂、Wittig反应、亲核取代反应、Friedel-Crafts酰基化反应和Aldol缩合等相关知识,在一定程度上增加了题目的难度。解决该题的关键是根据起始原料、给出的反应条件和有机产物结构,采用顺推 + 逆推的方法综合分析,加之其它专业知识,便能推出C60的全合成路线。
例2、第26届决赛第5题 (14分/10分)
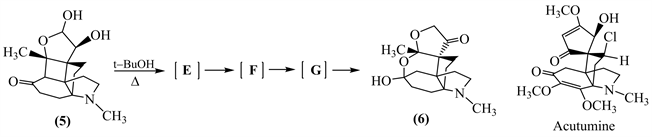
5-2 化合物(5)在叔丁醇中加热处理,依次经3个中间体E、F、G,生成产物(6),E和G各含3个羰基,F含2个羰基。
5-2-1 请写出E、F、G的结构。
5-2-2 用电子箭头标明G到(6)的机理。
5-3 用格氏试剂(7)和化合物(1)反应,然后依次用CH3I、CH3COOH处理,得到化合物(8),如下式所示:

请写出从J到(8)的反应历程,用弯箭头标明电子转移的方向,并说明(1)与(2)和(1)与(7)反应,为何采用相同的反应条件,却得到不同类型的反应产物(3)和(8)。
【思路】5-2 先分析反应物和生成物的结构,根据其结构的变化推测可能发生的反应,并依据题目给出的信息确定中间体的结构。化合物(5)的五元含氧杂环有一个半缩醛结构,六元环上有一个羰基,该羰基的β-位连接半缩醛氧;在叔丁醇中加热,依次经历中间体E、F、G转变成化合物(6)。对比化合物(5)和(6)的结构,我们可以发现上方的半缩醛结构没有了,四元环左边的碳碳键断裂,四元环上的碳形成了缩酮结构,六元环上的羰基变成了半缩酮结构,且中间体E中含有3个羰基。由此可以推断,化合物(5)首先发生的是半缩醛破裂:
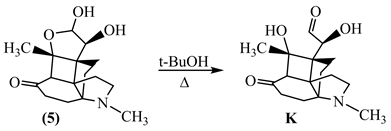
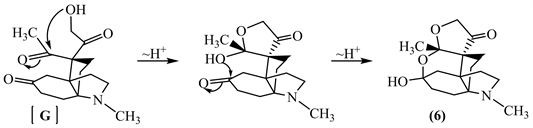
破裂后的产物K中含有2个羰基,题目中说E中含有3个羰基,因此K还需进一步反应才能得到E。观察K的结构,发现该化合物中含有一个β-羟基酮结构,该结构可以通过羟醛缩合反应得到。由此推断,K发生羟醛缩合的逆反应得到含3个羰基的E (见下)。F中含有2个羰基,G中含有3个羰基,观察化合物(6)的结构,发现上方五元环右边的羟基变成了羰基,那么该羰基应该是E中的α-羟基酮经历烯醇式的互变形成的(此性质在葡萄糖果糖互变中体现得淋漓尽致),由此很容易推出F和G的结构(见下)。

知道化合物G和(6)的结构,那么从G到(6)的机理就能推测出。G中上方的羟基进攻乙酰基中的羰基,形成一个五元环。然后该步生成的羟基再进攻下方六元环上的羰基,进一步生成化合物(6)。
5-3 先根据(1)和(8)的结构,推出(7)和碘甲烷反应的位置,然后根据反应条件推出H和J的结构,最后依据条件再来推测J→(8)的反应机理。按此,很容易看出格氏试剂(7)是和化合物(1)中的亚胺发生亲核加成反应,生成镁盐H (见下),产生的氮负离子与碘甲烷反应生成J (见下) [2]。
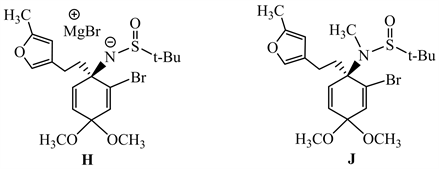
在酸性条件下,化合物J中的甲氧基质子化,失去一分子甲醇后,形成一个带正电荷的羰基;呋喃环与六元环中的双键发生分子内的Michael加成,随后,醋酸根作为碱夺去呋喃环α-H,重新形成芳香性的呋喃环。

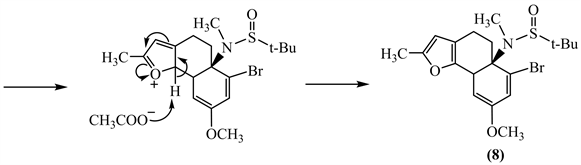
【评价】该题是以Sarah小组发表的尖防己碱(Acutumine)全合成的工作为背景设计的 [3]。5-2小题主要考查了半缩醛的破裂开环、羟醛缩合的逆反应、羰基和烯醇式的互变,解决该小题的关键是对比化合物(5)和(6)结构的差异,根据题目信息,推测中间体结构。该题整体创新度好。5-3小题涉及了亲核加成、亲核取代、亲电取代以及Michael加成反应,在分析机理时,我们要知道呋喃环可作为亲核试剂进攻六元环的双键,形成六元环与呋喃环相连的结构 [2]。由此,我们就可以推出化合物J到(8)的反应历程。
例3、第30届决赛第9题 (12分/4分)
2-吡喃酮(N)的衍生物广泛存在于自然界,有强心、抑菌等作用。化合物L真空热裂解,经中间体M转化为N。M是具有一定稳定性和反应活性的非环状分子。

利用该反应原理,起始原料O通过系列反应,成功合成2-吡喃酮衍生物T。Q→R的反应具有很好的立体选择性。


9-1 请写出M及Q、R、S、T的结构简式(如为立体选择性反应产物,需标明立体化学结构)。
【思路】观察化合物L的结构,发现L中有一个三元环,在真空热裂解条件下,三元环不稳定极易开环。中间体M是非环状分子,N中含有共轭二烯结构,那么从L到N发生的可能是有三元环参与的周环反应 [4]。

在Lewis酸ZnCl2催化下,化合物P和环戊二烯发生Diels-Alder反应,生成中间体Q。

Diels-Alder反应具有endo/exo的立体选择性,因此,P和环戊二烯反应还可以生成exo产物Q1,但主要是endo产物Q。
从Q→R,Q中含有一个羰基,能和苯甲醛反应,生成的产物的化学式与产物R相差C2H4O2,说明还需脱去一分子乙酸。Q先和苯甲醛发生羟醛缩合再脱去乙酸,还是Q先脱去乙酸再和苯甲醛反应,取决于反应条件。因为n-Bu3P是常用的Baylis-Hillman反应 [5] 的催化剂,所以Q先脱去乙酸,接着在n-Bu3P作用下发生Baylis-Hillman反应,得到产物R。在该过程中发生了Michael加成反应。

从R→S过程,在碱性条件下,化合物R中的双键被H2O2氧化成环氧。观察R的结构,发现六元环下方的空间位阻比上方的大,因此过氧根会从位阻小的上方进攻R。

从S→T过程的反应条件是真空热裂解,类比从L→N的反应。在真空热裂解条件下,S先发生Diels-Alder反应的逆反应,生成含α,β-不饱和羰基结构的物质1,再经过中间体2,生成产物T。
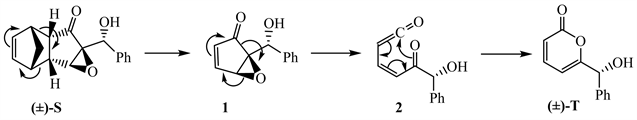
【评论】该题以吡喃酮衍生物的合成路线为背景,考查了真空热裂过程中的周环反应、Diels-Alder反应及其逆反应、Baylis-Hillman反应、Michael加成、Aldol缩合、选择性环氧化等反应及其机理,很多步骤涉及反应的立体选择性。此题很有难度,表现在高温热裂反应选手不熟悉、Diels-Alder反应之后的脱醋酸过程、环氧化双键位置的选择等。
例4、第32届决赛第8题 (11分/8分)
天然产物全合成是有机化学中最为活跃的研究方向之一。下面是一个天然产物全合成的部分路线。
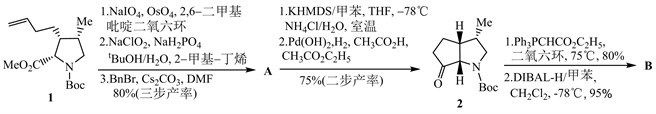

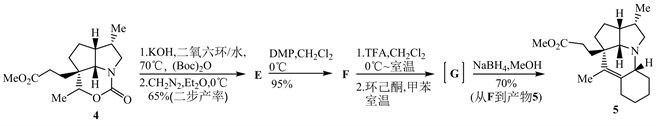
注释:合成路线中的反应条件是指主要条件。
tBuOH:叔丁醇;BnBr:溴化苄;DMF:N,N-二甲基甲酰胺;THF:四氢呋喃;DIBAL-H:二异丁基氢化铝;MsCl:甲基磺酰氯;Et3N:三乙胺;TFA:三氟乙酸;KHMDS:[(CH3)3Si]2NK;AcO−:乙酸根离子;

8-1 写出A、B、C、D、E、F、G的结构简式。
8-2 由A到化合物2的第一步反应属于哪种反应类型?写出中间产物的结构简式。
【思路】8-1 根据每一步的反应条件和物质结构,推测物质发生的反应。从1→A过程,化合物1中的碳碳双键被OsO4氧化为邻二醇1-1;邻二醇被NaIO4氧化为醛1-2;醛1-2在NaClO2/NaH2PO4条件下发生Pinnick氧化反应 [5],生成羧酸1-3;羧酸1-3与BnBr发生取代反应,得到化合物A。
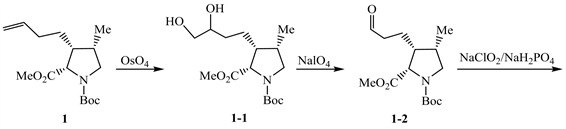
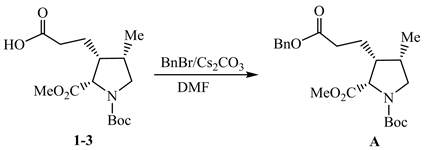
从A→2过程,对比化合物A和2的结构,发现2为含有一个酮羰基的桥环体系,A含有两个酯基,可以推测A在强碱KHMDS条件下发生了Dieckmann缩合,生成了含桥环体系的中间体A-1;A-1发生催化氢解脱去苄基,随后β-酮酸的α位发生脱羧反应,得到化合物2。
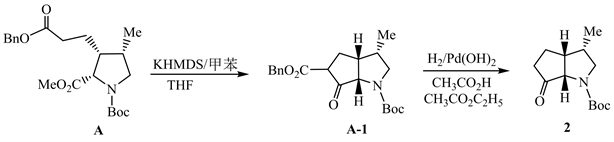
从2→B过程,化合物2中的羰基首先与Ph3PCHCO2C2H5发生Wittig反应生成物质2-1,接着2-1中的酯基被DIBAL-H还原为羟基,生成化合物B。

从B→C过程,在弱酸催化下,化合物B与原乙酸三甲酯反应,形成中间体B-1;接着B-1发生Claisen重排 [6],生成物质B-2;B-2中的酯基在碱性条件下水解,然后酸化,得到化合物C。
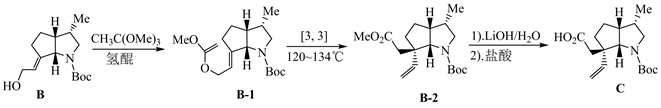
从C→3过程,化合物C发生了增加一个碳的Arndt-Eistert反应 [5]。在Et3N催化下,化合物C与MsCl反应,生成酸酐C-1;C-1与CH2N2反应,得到重氮酮C-2;C-2在苯甲酸银和三乙胺作用下脱去氮气,经Wolff重排生成烯酮C-4,然后在甲醇作用下得到化合物3。


从3→D过程,结合反应条件和化合物4的结构,可以推测化合物3先与Br2反应生成溴鎓离子中间体3-1,然后羰基进攻溴鎓环正离子,形成一个带正电荷的六元杂环,进一步脱去叔丁基正离子,生成化合物D。

从D→4过程,化合物D在雷尼镍催化下发生氢化脱卤反应。
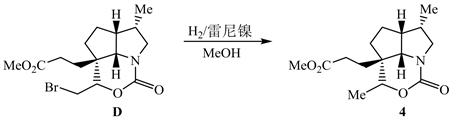
从4→E过程,结合反应条件和化合物5的结构,推测4中的内酰胺酯和支链上的酯基在碱性条件下都水解了,然后(Boc)2O保护氨基,生成中间产物4-1;CH2N2与4-1中的羧基反应生成酯基,得到化合物E。

从E→F过程,化合物E中的羟基被氧化剂DMP氧化为酮基,生成化合物F,该反应属于Dess-Martin氧化反应 [7]。

从F→G过程,化合物F被Boc脱除试剂TFA脱去Boc,生成胺F-1。结合化合物5的结构,环己酮与F-1反应生成烯胺F-2。然后烯胺和羰基发生分子内反应,生成化合物G。

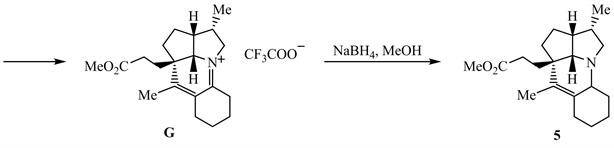
然后,化合物G被NaBH4还原 [4],得到最终产物5 (见上)。
【评论】该题是以Stephen Hanessian课题组发表在有机化学主流杂志The Journal of Organic Chemistry上的文章为基础素材,以天然产物的合成路线为背景,进而编制的一道难度较大的竞赛题 [8]。该题考查了较多的人名反应,如Pinnick氧化反应、Dieckmann缩合、Wittig反应、Claisen重排、Arndt-Eistert反应、Dess-Martin氧化反应、重氮甲烷涉及的多个反应以及其它的重要单元反应,如羧基、氨基的保护脱保护反应、混合酸酐的生成与应用、溴鎓离子的形成等,况且许多反应条件不是常见的,许多步骤涉及立体化学,更增加了解题的难度。这要求学生要熟练掌握许多常见的有机反应,能根据给出的条件合理推断反应过程。
例5、第33决赛第3题 (13分/10分)
高血压是常见的心血管病,治疗高血压多选用钙离子拮抗剂。
3-1 由苯甲醛、乙酰乙酸甲酯、醋酸铵反应生成的化合物A (C17H19NO4)是一种钙离子拮抗剂,反应式如下。画出A的结构简式。

3-2 上面的反应中,如果将醋酸铵换成盐酸羟胺(NH2OH·HCI),三种物质反应先生成中间体B(C17H19NO5),进一步反应生成C (C17H17NO4)。画出B和C的结构简式。

3-3 乙酰乙酸甲酯在甲醇钠的存在下与环氧乙烷反应生成D,经溴化氢处理,加热生成E,E在氢化钠的作用下生成甲基环丙基甲酮。画出此转化过程中中间产物D和E的结构简式。

【思路】3-1 起始原料为一分子醛,两分子β-二羰基化合物,一分子醋酸铵。化合物A中含有氮原子,说明反应原料中的铵根离子参与了反应。可以推测该过程发生的是Hantzsch吡啶合成反应 [9]。首先,苯甲醛与乙酰乙酸甲酯发生Knoevenagel反应,生成α,β-不饱和羰基化合物1。
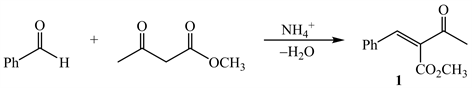
接着铵根离子和乙酰乙酸甲酯反应生成β-烯胺酯2。

物质1和2发生Michael加成,然后失水关环生成1,4-二氢吡啶衍生物A。

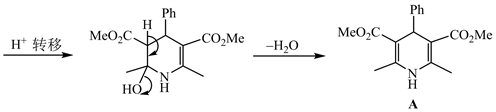
3-2 与3-1相比,不同之处是将醋酸铵换成了盐酸羟胺,会发生与上面类似的反应,只是将氮原子上的氢原子用羟基代替,即为中间体B的结构。对比化合物C和B的化学式,相差一分子H2O,可以推测B发生脱氢芳构化生成吡啶衍生物C。

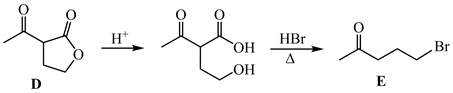
3-3 首先,乙酰乙酸甲酯在碱性条件下与环氧乙烷发生缩合反应,得到五元环内酯。

化合物D在酸性条件下发生水解,生成物质3。3中的羟基与HBr发生取代反应,在加热条件下3能发生脱羧反应。
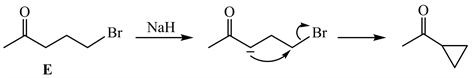
结合最终产物的结构,化合物E在NaH条件下发生分子内的亲核取代反应。
【评价】该题的背景是钙离子拮抗剂,钙离子拮抗剂是一类非常重要的降血压药物。该题以此为背景考查了合成杂环的重要方法:Hantzsch吡啶合成法,该题难度不大,若能理解Hantzsch吡啶合成反应的反应机理,就能很快解决题目中的问题。通过该题,我们能够知道人名反应在有机合成中占有十分重要的地位,是化学奥赛考查的热点。因此,学生要熟练掌握常见的人名反应,理解反应机理,并学会举一反三,大胆推测。
2.3. 试题特点
2011~2020年缩合反应初赛试题的背景知识和考查类型 [10],见表3。表中“/”代表该题无试题背景(下同)。

Table 3. Background and form in the Preliminary examination questions of the 25th~34th Chinese Chemistry Olympiad
表3. 第25~34届奥赛初赛试题的背景和考查类型
从表3中可以看出,化学奥赛初赛试题一般无试题背景,干扰信息少,题目要求清晰明了;其考查形式主要是中间体或产物的结构推导、反应机理,对反应类型的判断、逆合成分析的考查比较少。与决赛试题相比,初赛试题的出题方式较为单一,涉及到的多为有机化学的基础知识,对学生的能力要求相对较低。
2011~2020年缩合反应决赛试题的背景和考查类型 [10] 的统计结果见表4。


Table 4. Background and form in the final examination questions of the 25th~34th Chinese Chemistry Olympiad
表4. 第25~34届奥赛决赛试题的背景和考查类型
从表4可以看出,化学奥赛决赛试题多以药物、香料或天然产物等的合成路线为背景,加强了与科学发展、化工合成的联系;考查形式与初赛试题相似,以产物或中间体结构推断、反应机理为主,但决赛更加重视学生对反应机理的理解;试题的综合性更强,考查的内容也更难,对学生的能力要求更高。
初赛试题更注重对有机化学基础知识的考查,学生若能熟练的掌握基础知识,有一定的解题能力,就能轻松应对;决赛试题更重视学生的逻辑思维和知识迁移能力,考查学生是否能从题目中获得关键信息,是否能举一反三,和熟悉的知识建立联系,试题的综合性更强,考查的内容也更难,对学生的能力要求更高。
3. 命题趋势
1) 考查重点不变,命题方式多样化。化学奥赛试题从单一题型逐渐向综合题型转变,不仅考查物质结构推断,还会考查反应机理、反应条件、反应类型、逆合成分析等。无论试题的出题方式如何变化,Aldol缩合和Michael加成反应仍是化学奥赛试题考查的重点。在近十年化学奥赛中,有4届初赛试题和7届决赛试题涉及了Aldol缩合或Michael加成反应的内容。
2) 更加注重对有机反应机理的考查。化学奥赛试题不再只是考查学生对物质结构的推断,更加重视学生对反应机理的理解,考查学生知识的运用和迁移能力、综合分析问题的能力 [10]。反应机理是有机反应的核心,理解了反应机理,就能明白反应是如何进行的,即使改变了反应条件、底物、试剂等,也能够根据已知信息解决问题。如31届决赛第7题从Prins反应的基本原理展开,考查了改变底物或试剂对反应历程的影响。
3) 更加注重对反应的立体化学的考查。立体化学揭示了分子的结构和性能,在天然产物、药物、生物大分子等的合成中占有重要地位。化学奥赛试题越来越重视对不对称合成和反应立体选择性的考查,增加了试题难度,对学生知识的运用和迁移能力以及综合分析问题的能力有了更高的要求。如29届决赛第8题考查了不对称四氢吡咯衍生物催化下的不对称合成反应。
4) 考查缩合反应时,人名反应的考查力度加大。化学奥赛试题多以药物、香料、材料和天然产物等的合成路线为背景,并将缩合反应和人名反应融合在整个合成路线中,考查学生对反应细节的掌握和反应机理的理解,有时还会改变其原料、试剂或条件 [10]。如33届决赛第3题以钙离子拮抗剂为背景,考查了合成杂环化合物的重要反应Hantzsch吡啶合成法。
4. 教学建议
1) 重视基础知识,勤加练习 [11]。化学奥赛试题形式多样,但“万变不离其宗”,十分重视对有机化学基础知识的考查。有扎实的知识基础,才可能盖出高楼大厦。奥赛教练在知识讲解过程中要帮助学生构建知识框架,让学生从本质上学习有机反应,理解其反应机理,明白反应条件、底物、试剂等对反应历程的影响以及反应的立体选择性。在教学过程中,老师要让学生明白基础知识的重要性,要注意不同概念间的差别和不同反应间的联系。教练可以讲解初赛试题,让学生练习决赛试题,加深学生对概念和反应机理的理解,培养学生灵活运用知识的能力。
2) 培养学生自学能力,养成良好的学习习惯。化学奥赛越来越重视对反应机理、逆合成分析和立体化学的考查,对学生知识运用和迁移能力、思维方式要求更高了,奥赛教练也需要改变“填鸭式”的教学模式。授人以鱼,不如授人以渔。在教学过程中,教练要重视对学生能力的培养,引导学生思考,充分发挥学生主观能动性,让学生养成良好的学习习惯,培养学生自学能力 [12]。
3) 关注科学发展前沿 [13],提高学习化学的兴趣。化学奥赛试题多以科学发展的前沿知识为背景,考查学生知识的掌握程度和运用能力。在教学过程中,教练应将有机反应与药物、香料、天然产物等的合成工艺联系起来,向学生展示化学在医药、化工、食品等领域的广泛应用,让学生了解化学对于社会发展、人民生活水平提高的重要作用,提高学生学习化学的兴趣。此外,学生也要积极阅读文献期刊,了解化学发展的前沿,学习科学家的思维方式,培养自己的创造性思维,开拓视野,提高自己的综合素质。
4) 正视奥赛,有良好的心理素质。正确理解化学奥赛的宗旨和目的,奥赛培训不能过于功利化。学生不要有太大的压力,根据自己的能力,设置合适的目标,拿奖不是奥赛的最终目标 [14]。学生参加化学奥赛更重要的是提高自己的逻辑思维能力和解决问题能力,开拓视野,了解科学发展前沿,培养自己的创新精神。其次,心理素质对参赛学生很重要。老师要帮助学生自我认识、调整情绪,提高学生的心理素质。学生具有良好的心理素质,考试时才能思路清晰、逻辑严谨。
NOTES
*通讯作者。