摘要:
目的:探讨莫西沙星单药治疗无铜绿假单胞菌感染危险因素的慢性阻塞性肺疾病急性加重期患者的临床应用价值,评价其疗效和安全性。方法:采用随机、对照的研究方法,选取2018年12月至2020年1月于山西医科大学附属汾阳医院呼吸与危重症医学科及老年医学科住院的慢性阻塞性肺疾病急性加重期患者130例,随机分为实验组及对照组,分别在基础治疗,包括呼吸支持、糖皮质激素、支气管舒张剂及祛痰等辅助药物治疗上加用莫西沙星及阿莫西林/克拉维酸,治疗后评价其疗效及实验室指标。结果:临床疗效方面,实验组有效率81.5%,对照组有效率73.8%,差异无统计学意义(X2值1.110、P = 0.292)。实验室指标方面,治疗后白细胞计数实验组(6.78 ± 2.23) × 109/L,对照组(7.81 ± 2.86) × 109/L,差异有统计学意义(t值−2.282,P = 0.024)。治疗后的降钙素原实验组(0.154 ± 0.195) ng/ml,对照组(0.239 ± 235) ng/ml,差异有统计学意义(t值−2.240,P = 0.027)。存在II型呼吸衰竭患者PCO2治疗前后变化值实验组(20.62 ± 6.40) mmHg优于对照组(13.93 ± 9.26) mmHg,差异有统计学意义(t值2.570、P = 0.015)。实验组FEV1/pred治疗后(63.59 ± 13.56)%,对照组(54.43 ± 12.57)%;差异有统计学意义(t值3.998、P < 0.001)。实验组FEV1/FVC治疗后(55.16 ± 8.76) %,对照组(51.26 ± 10.24)%,差异有统计学意义(t值2.335、P = 0.021)。抗生素使用时间及平均住院时间实验组[(6.75 ± 1.94)、(9.78 ± 2.40)]d均低于对照组[(8.85 ± 1.99)、(11.37 ± 2.56)]d,差异有统计学意义(t值−6.081、−3.679,均P < 0.001)。随访6个月内的急性加重情况,差异无统计学意义(X2值0.074、P = 0.785)。结论:莫西沙星可以用于治疗无铜绿假单胞菌感染危险因素的慢性阻塞性肺疾病急性加重期患者,有着更好的肺功能改善,更短的抗菌药物使用时间及住院时间,在合并II型呼吸衰竭亚组中更有优势,安全性好。
Abstract:
Objective: To evaluate the efficacy and safety of moxifloxacin monotherapy in patients with acute exacerbation of chronic obstructive pulmonary disease without risk factors of Pseudomonas aeruginosa infection. Methods: A total of 130 patients with acute exacerbation of chronic obstructive pulmonary disease who were hospitalized in Department of Respiratory and Critical Care Medicine and Department of Geriatrics, Affiliated Fenyang Hospital of Shanxi Medical University from December 2018 to January 2020 were randomly divided into experimental group and control group, who received basic treatment respectively. Moxifloxacin and amoxicillin/clavulanate were added to respiratory support, systemic corticosteroids, bronchodilators, expectorants and other adjuvant medications. The efficacy and laboratory indicators were evaluated after treatment. Results: In terms of clinical efficacy, the effective rate was 81.5% in the experimental group and 73.8% in the control group, the difference was not statistically significant (X2 = 1.110, P = 0.292). In terms of laboratory indicators, the white blood cell count in the experimental group after treatment was (6.78 ± 2.23) × 109/L, control group (7.81 ± 2.86) × 109/L, the difference was statistically significant (t value −2.282, P = 0.024). Procalcitonin group after treatment (0.154 ± 0.195) ng/ml, control group (0.239 ± 235) ng/ml, the difference was statistically significant (t value −2.240, P = 0.027). The change of PCO2 in patients with II type respiratory failure before and after treatment in the experimental group (20.62 ± 6.40) mmHg was better than that in the control group (13.93 ± 9.26) mmHg, the difference was statistically significant (t value 2.570, P = 0.015). After treatment, FEV1/pred was (63.59 ± 13.56)% in the experimental group and (54.43 ± 12.57)% in the control group. The difference was statistically significant (t value 3.998, P < 0.001). In the experimental group, FEV1/FVC was (55.16 ± 8.76)% after treatment, control group (51.26 ± 10.24)%, the difference was statistically significant (t value 2.335, P = 0.021). The duration of antibiotic use and average length of hospital stay in the experimental group [(6.75 ± 1.94), (9.78 ± 2.40)]d were lower than those in the control group [(8.85 ± 1.99), (11.37 ± 2.56)]d. The difference was statistically significant (t value −6.081, −3.679, all P < 0.001). There was no significant difference in acute exacerbation during the follow-up period of 6 months (X2 = 0.074, P = 0.785). Conclusion: Moxifloxacin can be used to treat patients with acute exacerbation of COPD without risk factors for Pseudomonas aeruginosa infection, with the better improvement of lung function, shorter duration of antibiotic use and hospital stay. It is more advantageous in the subgroup of combined II type respiratory failure and has good safety.
1. 引言
慢性阻塞性肺疾病(慢阻肺,chronic obstructive pulmonary disease, COPD)多与有害颗粒或有害气体引起的气道和(或)肺泡异常炎症反应有关。来自阻塞性肺病负担研究BOLD和其他大型流行病学研究显示,估计全球慢阻肺患者达3.84亿 [1],全球每年约三百万人死于慢阻肺 [2]。慢阻肺是老年人的常见病和多发病,随着人口老龄化,致残疾病的发病率通常随着年龄的增长而急剧增加。慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease, AECOPD)是慢阻肺疾病管理过程中的重要事件,细菌感染是慢性阻塞性肺疾病急性加重的主要诱发因素,约占50% [3]。慢性阻塞性肺疾病诊断、治疗和预防的全球策略(GOLD) [4] 推荐AECOPD患者存在细菌感染征象时需使用抗菌药物,初始经验性治疗可选用阿莫西林/克拉维酸、大环内酯类药物或四环素类,欧洲的成人下呼吸道感染处理指南 [5] 及慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识 [6] 在抗菌药物使用时进行了有无铜绿假单胞菌感染危险因素的分层。本研究通过该分层研究无铜绿假单胞菌感染危险因素患者使用莫西沙星单药治疗AECOPD的近期及远期临床疗效,为AECOPD患者的分层临床抗菌药物合理选择提供证据。
2. 方法
2.1. 研究对象
这是一项前瞻性的病例对照研究,研究对象为2018年12月至2020年1月于山西医科大学附属汾阳医院呼吸与危重症医学科及老年医学科住院的慢性阻塞性肺疾病急性加重期患者,根据2018年GOLD [4] 对急性加重的定义选择符合标准的病例130例。本研究通过山西医科大学附属汾阳医院伦理委员会批准,入组前告知研究对象本研究目的并签署知情同意书。
2.1.1. 入选标准
1) 年龄 ≥ 60岁,需住院治疗的AECOPD患者,符合下列条件之一 [4]:a. 严重的症状,如静息状态下呼吸困难突然加重,呼吸频率高,血氧饱和度降低,意识模糊,嗜睡;b. 急性呼吸衰竭;c. 出现新的体征(如:发绀、外周水肿);d. 初始药物治疗失败;e. 有严重的伴随疾病(如心力衰竭或新发心律失常等);f. 家庭支持不足;g. 院外治疗无效或医疗条件差。2) 具备呼吸困难加重、痰量增多和出现脓痰或仅出现以上3种症状中的2种但包括痰液变脓这一症状。3) 无铜绿假单胞菌感染可能因素 [6]:a. 近期(近3个月内)住院史;b. 经常(>4次/年)或近期(近3个月内)抗菌药物应用史;c. 病情严重(FEV1%pred < 30%);d. 应用口服糖皮质激素(近2周服用泼尼松>10 mg/d)。
2.1.2. 排除标准
1) 合并肺炎、急性支气管炎、肺脓肿;2) 对青霉素类及喹诺酮类抗菌药过敏;3) 严重心、肝、肾功能不全;4) 入住重症病房需有创呼吸机辅助通气支持;5) 合并恶性肿瘤;6) 其他系统存在严重且未控制的疾病。
2.2. 研究方法
2.2.1. 用药情况
我们把AECOPD患者随机分为两组,实验组静脉应用莫西沙星(400 mg qd),对照组静脉应用阿莫西林/克拉维酸(1000/200 mg q8h)。两组均给予基础治疗,包括呼吸支持(鼻导管、面罩、高流量)、糖皮质激素、支气管舒张剂及祛痰等辅助药物治疗。
2.2.2. 疗效指标
目前尚无统一评价患者出院及好转的标准,部分研究以患者症状是否回到基线为主要评价指标,本研究根据慢性阻塞性肺疾病急性加重的定义制定疗效评价标准,以患者的主观感受为主,体征及检查指标为辅。主要标准为出院时痰量、脓痰、呼吸困难症状恢复到基线水平 [4] [7];次要标准为包括肺部啰音、感染指标(白细胞、降钙素原)、血气分析、出院8周内症状恶化需额外治疗(抗菌药物/全身激素) [8]。其中出院时存在主要标准中的两项症状、或一项症状加两项次要标准记为治疗失败。同时比较两组间的血气分析及肺功能第1天和第7天变化情况,平均住院时间,随访6个月内患者急性加重情况。
2.2.3. 安全性评估
记录所有患者表现出的不良事件症状,由研究者评估不良反应与研究药物是否存在因果关系,并统计比较不良事件发生率。
2.3. 统计学方法
采用SPSS 22.0软件进行统计分析,计量资料采用
表示,两组比较采用t检验;计数资料采用百分比表示,两组间比较采用c2检验;以P < 0.05为差异有统计学意义。
3. 结果
3.1. 一般资料
实验组65例患者,男性37例、女性28例,平均年龄(69.3 ± 8.8)岁;对照组65例患者,男性39例、女性26例,平均年龄(70.0 ± 8.6)岁。两组患者年龄、性别、体质指数、吸烟、上一年度加重次数及入院时呼吸衰竭情况均无统计学意义(表1)。入院时留取治疗前及晨痰标本,治疗3天后评价患者早期临床反应情况,根据患者症状(呼吸困难、痰量、痰液性质)改善情况(表2),共有9例患者因病情加重或需要联用其他抗菌药物而退出研究,实验组和对照组分别为4例和5例退出研究。
表1. 基线资料
注:*表示治疗3天后痰培养阳性患者症状改善情况,采用例数n(%)表示。
3.2. 临床疗效
实验组(53/65, 81.5%)例有效,12例无效,失败患者中有3例为出院时症状部分好转,8周内再次急性加重;对照组(48/65, 73.8%)例有效,17例无效,其中有5例为出院时症状部分好转,8周内再次急性加重。两组间临床疗效差异无统计学意义(c2值1.110、P = 0.292)。
3.3. 实验室指标
实验室指标分析了感染指标:白细胞计数、降钙素原;通气功能:二氧化碳分压、FEV1/pred及FEV1/FVC在入院时和第7天的变化情况。
感染指标中白细胞计数:实验组治疗前(10.71 ± 4.30) × 109/L,第7天(6.78 ± 2.23) ×109/L;对照组治疗前(10.47 ± 3.47) ×109/L,第7天(7.81 ± 2.86) × 109/L;两组间治疗后差异有统计学意义(t值−2.282,P=0.024)。降钙素原:实验组治疗前(0.490 ± 0.435) ng/ml,第7天(0.154 ± 0.195) ng/ml;对照组治疗前(0.501 ± 0.500) ng/ml,第7天(0.239 ± 0.235) ng/ml;两组间治疗后差异有统计学意义(t值−2.240,P = 0.027)。
通气功能方面,PCO2:实验组治疗前(46.11 ± 11.45) mmHg,第7天(41.06 ± 5.95) mmHg,治疗前后差值(5.04 ± 13.20) mmHg;对照组治疗前(46.46 ± 10.30) mmHg,第7天(42.86 ± 5.49) mmHg,治疗前后差值(3.60 ± 10.01) mmHg;两组间差异无统计学意义(t值0.73、P = 0.483)。比较两组中发生II型呼吸衰竭患者PCO2变化情况,实验组19例(20.62 ± 6.40) mmHg,对照组18例(13.93 ± 9.26) mmHg;两组间差异有统计学意义(t值2.570、P = 0.015)。FEV1/pred:实验组治疗前(48.87 ± 13.40)%,第7天(63.59 ± 13.56)%;对照组治疗前(48.51 ± 15.86)%,第7天(54.43 ± 12.57)%;两组间治疗后差异有统计学意义(t值3.998、P < 0.001)。FEV1/FVC:实验组治疗前(43.83 ± 10.05)%,第7天(55.16 ± 8.76)%,治疗前后差值(−11.33 ± 12.60)%;对照组治疗前(44.19 ± 9.34)%,第7天(51.26 ± 10.24)%,治疗前后差值(−7.07 ± 9.79)%;两组间差异有统计学意义(t值−2.155、P = 0.033)。
3.4. 抗菌药物使用时长及住院时长
实验组抗菌药物使用时长(6.75 ± 1.94)天,对照组抗菌药物使用时长(8.85 ± 1.99)天;两组间差异有统计学意义(t值−6.081、P < 0.001)。实验组住院时长(9.78 ± 2.40)天,对照组住院时长(11.37 ± 2.56)天;两组间差异有统计学意义(t值−3.679、P < 0.001)。
3.5. 随访
在6个月的随访过程中(图1) 19例患者失访,失访率小于20%。实验组(15/56, 26.8%)出现急性加重,对照组(16/55, 29.1%)出现急性加重;两组间差异无统计学意义(c2值0.074、P = 0.785)。
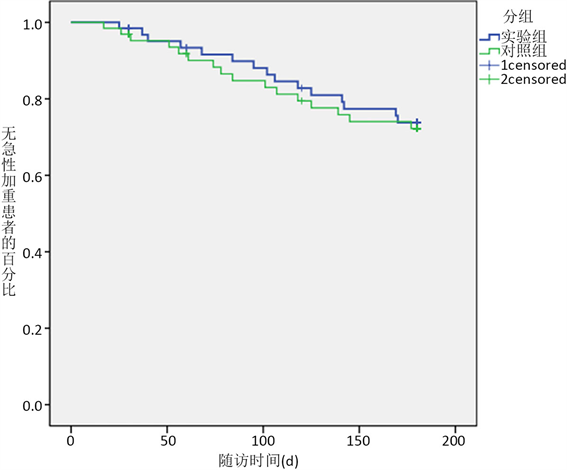
Figure 1. Acute aggravated again within 6 months
图1. 6个月内再次急性加重情况
3.6. 不良反应
实验组出现恶心、腹泻消化道症状4例,静脉炎1例;对照组出现恶心症状5例,皮肤瘙痒1例;予以对症治疗后好转,未出现需停药的不良事件。两组间差异无统计学意义(c2值0.099、P = 0.753)。
4. 讨论
慢性阻塞性肺疾病是一种常见的以持续性呼吸道症状和气流受限为特征的可以预防和治疗的疾病。GOLD指南给出急性加重的定义为呼吸道症状加重以致需要额外的治疗,治疗主要为氧疗、支气管扩张剂、激素和抗菌药物。Cochrane协作网的研究显示 [9] 在AECOPD患者有咳嗽和脓痰增多的情况下,无论选择何种抗生素,相对于安慰剂组来说,短期死亡率降低77%,治疗失败风险降低53%,脓痰风险降低44%。因此,抗感染治疗是AECOPD治疗的重要环节,本研究莫西沙星在临床疗效上并未展示出明显的优势,考虑与以下因素有关,入组时对患者进行筛选后,无铜绿假单胞菌危险因素的患者病情严重程度较低,初次使用抗菌药物敏感性较高;在入组时剔除了合并肺炎及急性支气管炎等感染性疾病的患者。在通过各项实验室检查评价疗效方面,根据GOLD指南推荐的治疗时间为5~7天,选择对比入院第1天和第7天的实验室指标。其中实验组感染指标中的白细胞计数与降钙素原较对照组下降更快,差异有统计学意义;通气功能评价选择了血气分析中的二氧化碳分压及肺功能中的FEV1/pred、FEV1/FVC做为评价患者通气功能改善的指标。本研究结果显示在整体患者中二氧化碳分压改变无统计学意义。我们进行了亚组分析,在Ⅱ型呼吸衰竭患者中,二氧化碳分压的改变有统计学意义。实验组的FEV1/pred、FEV1/FVC较对照组改善更多,结果有统计学意义。同时实验组具有更短的抗菌药物使用时间和平均住院时间,与其他临床研究结果一致。随访6个月再次急性加重次数未见有统计学意义的差异,目前认为急性加重的最佳预测因子为上一年度急性加重次数,与目前主流观点一致。随访6个月再次急性加重次数未见有统计学意义的差异,目前认为急性加重的最佳预测因子为上一年度急性加重次数,与目前主流观点一致。药物不良反应方面并无明显差异。
莫西沙星抗菌谱广,对大多数革兰阳性菌、大多数革兰阴性菌、军团菌、支原体、衣原体敏感,涵盖了大部分呼吸道感染的细菌,并且能在肺泡中聚集。相关文献显示 [10] [11],莫西沙星在治疗AECOPD的疗效与临床常用抗菌药物包括阿莫西林/克拉维酸、头孢曲松、头孢呋辛、克拉霉素、头孢哌酮/舒巴坦和阿奇霉素疗效相当;笔者曾做一综述 [12] 详细阐述了这些内容。疗效相似考虑与以下因素有关:AECOPD不是一种单纯的感染性疾病,症状加重以小气道阻力的增加引起的呼吸困难为主要表现,在积极抗炎和扩张支气管后可改善症状;入组时对患者进行筛选后,无铜绿假单胞菌感染危险因素的患者病情严重程度较低;初次使用抗菌药物敏感性较高;在入组时剔除了合并肺炎及急性支气管炎等感染性疾病的患者。莫西沙星主要优势在于有着更高的细菌清除率;可以缩短住院时间,节约开支;不易产生耐药,在初始抗菌治疗失败的患者中也有良好的疗效 [13]。加拿大一项回顾性研究显示 [14] 氟喹诺酮药物在无并发症的AECOPD患者门诊的短期疗效中没有益处,更适用于反复发作、存在并发症及住院的患者。故莫西沙星可用于无铜绿假单胞菌感染危险因素慢性阻塞性肺疾病急性加重期患者的住院治疗。本研究存在局限性及不足,结果也需理性看待,两药给药次数不同,不能设置盲法;不能采集到患者住院前处于稳定期的慢性阻塞性肺疾病评估测试(CAT)评分,根据患者自诉的症状改善情况评价疗效并不准确客观;部分患者入院时FEV1%pred < 30%,但在治疗后复查肺功能有所改善,故不能单纯通过肺功能严重程度决定抗菌药物使用情况,也需综合考虑。
基金项目
山西省卫生计生委员会科研课题(2017188)。