摘要: 为了掌握我国沙棘属植物主要种(亚种)叶片所含与健康有关的一些生物活性因子,对西藏、新疆、青海、甘肃等地野生的中国沙棘(Hippophae rhamnoides. ssp. sinensis)、云南沙棘(H. r. ssp. yunnanensis)、蒙古沙棘(H. r. ssp. mongolica)、中亚沙棘(H. r. ssp. turkestanica)、江孜沙棘(H. gyantsensis)、肋果沙棘(H. Neurocarpa)、西藏沙棘(H. tibetana)共7个种(亚种),取叶样20个,采用气相色谱–质谱联用技术(GC-MS)测定了肌醇、甲基肌醇、白雀木醇、蔗糖、葡萄糖、果糖、苹果酸和Vc共8个生物活性指标,发现江孜沙棘叶片所含甲基肌醇、蔗糖、葡萄糖、果糖含量最高,云南沙棘叶片所含肌醇、苹果酸、Vc含量最高,蒙古沙棘叶片所含白雀木醇含量最高;而肋果沙棘叶片所含肌醇、蔗糖、葡萄糖、果糖含量最低,西藏沙棘叶片甲基肌醇和Vc含量最低,云南沙棘叶片所含白雀木醇含量最低,中亚沙棘叶片所含苹果酸含量最低。这些测定分析结果,将为不同种(亚种)沙棘在我国“三北”和西藏等地的资源建设和开发利用提供有关科学依据。
Abstract:
In order to learn the bio-active healthy factors relating of species and sub-species in China, the leaves of 20 samples from 7 species and sub-species, namely, Hippophae rhamnoides. ssp. sinen-sis, H. r. ssp. yunnanensis, H. r. ssp. mongolica, H. r. ssp. turkestanica, H. gyantsensis, H. Neurocarpa, H. tibetana, were collected from wild resources locations in Tibet, Xinjiang, Qinghai, Gansu, to analyze the inositol, methylinositol, L-quebrachitol, Sucrose, glucose, fructose, malic acid and Vc, with the method of GC-MS. The results showed that the contents of nositol, sucrose, glucose and fructose in leaves of H. gyantsensis were the highest, and the contents of inositol, malic acid and Vc in leaves of H. r. ssp. yunnanensis were also the highest, and the contents of L-quebrachitol in leaves of H. r. ssp. mongolica were the highest, too, while the contents of inositol, sucrose, glucose and fructose in leaves of H. Neurocarpa were the least, the contents of methylinositol and Vc of H. tibetana the least, and the contents of L-quebrachitol in leaves of H. r. ssp. yunnanensis and the contents of malic acid in leaves of H. r. ssp. turkestanica the least, too. The test results give scientific bases for the afforestation and development of the test species and sub-species of Hippophae in the Three-North and Tibet areas.
1. 引言
医疗保健一直以来是人们保证身体健康、生活安稳的手段之一 [1] [2] [3]。从去年年初以来,新冠疫情在全世界范围内的肆虐,让人们感受到了大自然的高深莫测,特别是人类在天灾人祸面前的束手无策。尊重科学,顺应自然,保持良好的健康心理,拥有科学的健康手段 [4] [5],已成为当务之急。在自然界寻求防疫保健的植物资源,顺应了全民防疫保健和养生风潮的社会大背景。我国适用于保健的植物资源研究很多 [6] - [11],研究成果提出或解决了医疗保健方面存在的一些问题。沙棘属(Hippophae)植物是近年来医疗保健方面研究的一大热点,在本属6种17亚种 [12] 中,我国青藏高原及周边地区分布着其中6种13亚种 [13]。对沙棘果实的保健成分等方面已开展了诸多研发 [14] [15],为提高我国居民的健康水平起到了重要的作用;沙棘叶片的初步研究结果也表明其是一类与果实同样重要的植物资源 [16] [17],值得进行深入研究和开发。本文是对我国分布的主要野生沙棘资源叶片取样测试的与健康有关的一些生物活性因子的分析结果。
2. 材料与方法
2.1. 用于测试的沙棘叶片
用于活性因子取样分析的沙棘叶来源于西藏、新疆、青海、甘肃等地的天然沙棘林,取样时间为2019年9月至10月。基本情况详见表1,涉及到中国沙棘(H. r. ssp. sinensis)、云南沙棘(H. r. ssp. yunnanensis)、蒙古沙棘(H. r. ssp. mongolica)、中亚沙棘(H. r. ssp. turkestanica)、江孜沙棘(H. gyantsensis)、肋果沙棘(H. Neurocarpa)、西藏沙棘(H. tibetana)共7个种或亚种,20个叶样品。

Table 1. Basic information of leaves collecting locations of wild species and sub-species of Hipphphae
表1. 不同野生沙棘种(亚种)叶采样地点基本信息
沙棘叶片取样后立即杀青,然后快递至化验机构做了及时测定分析。
2.2. 测试方法
肌醇(inositol)、甲基肌醇(methylinositol)、白雀木醇(L-quebrachitol)、糖类(蔗糖、葡萄糖、果糖)、苹果酸、Vc:采用气相色谱–质谱联用技术(GC-MS)进行测定分析。
3. 结果与分析
参试沙棘所含糖分组成色谱见图1,该图只是一个样品的测试结果示例,图中:1——赤藓糖醇;2——塔格呋喃糖;3——半乳糖醛酸;4——白雀木醇;5——塔罗糖;6——葡萄糖;7——肌醇;8——蔗糖。
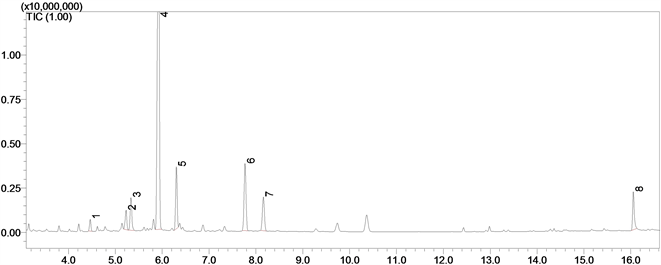
Figure 1. GC-MS chromatogram of sugar fraction of leaves of test Hipphphae
图1. 参试沙棘所含糖分的气质色谱图
7个种(亚种)沙棘20个叶样品的肌醇等8个与健康相关的活性因子指标测定结果,列于表2。


Table 2. All the test results of bio-active factors relating to health of dried leaves of wild species and sub-species of Hipphphae
表2. 不同种(亚种)沙棘干叶与健康相关的一些活性因子测定结果汇总
3.1. 不同种(亚种)间沙棘干叶肌醇含量对比
肌醇学名环己六醇,分子式为C6H12O6,广泛存在于各种天然动物、植物及微生物组织中,因最初由肌肉组织中提取,故得其名。肌醇可通过食物中的D-葡萄糖得到充分供给,因此没有被归入必需营养素中。肌醇共有9个异构体,其中D-手性-肌醇(D-chrio-inositol)与L-手性-肌醇(L-chrio-inositol)互为旋光异构体,其余7种均无旋光性,通常在没有特别说明的时候均指中肌醇(myo-inositol) [18]。肌醇属于多羟基化合物,所以具有相邻羟基的多羟基化合物所特有的反应特性。肌醇和胆碱结合之后会产生卵磷脂,这种物质可以降低人体的血脂,预防动脉硬化,促进胆固醇代谢,帮助清除肝脏的脂肪;除此之外,肌醇还具有改善脱发、提高受孕率等作用。
为了更好地反映参试沙棘各种(亚种)间干叶的(总)肌醇含量平均变化情况,将表1有关含量值按种进行平均做图,见图2。
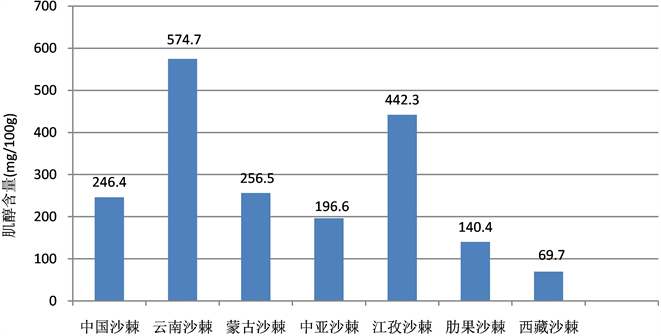
Figure 2. Contrast of inositol of dried leaves among all the test wild species and sub-species of Hipphphae
图2. 不同种(亚种)野生沙棘干叶肌醇含量对比
7个沙棘种(亚种) 20个样品的干叶肌醇含量从最小的30.6 mg/100 g至最高的603.9 mg/100 g (表2),变动幅度很大,平均值为204.7 mg/100 g。从图1可以很直观地看出,有4个种(亚种)的肌醇含量平均值大于总体平均值(204.7 mg/100 g),分别为云南沙棘(574.7 mg/100 g)、江孜沙棘(442.3 mg/100 g)、蒙古沙棘(256.5 mg/100 g)、中国沙棘(246.4 mg/100 g);3个种(亚种)的肌醇含量平均值小于总体平均值(204.7 mg/100 g),分别为中亚沙棘(196.6 mg/100 g)、肋果沙棘(140.4 mg/100 g)、西藏沙棘(69.7 mg/100 g)。
3.2. 不同种(亚种)间沙棘干叶甲基肌醇含量对比
肌醇中的多数可形成甲醚。肌醇甲醚是肌醇的单甲基或双甲基衍生物,也相应地具有众多同分异构体,分子式为C7H14O6。肌醇的单甲醚类衍生物存在于多种高等植物中,以D-松醇(D-pinitol)、白雀木醇和红杉醇(sequoyitol)的研究报道居多,其他肌醇单甲醚类衍生物L-甲基肌醇、D-甲基肌醇、D-芒柄醇(D-ononitol)、1-D-O-甲基肌醇、L-松醇、1-O-甲基黏质纤维醇等,均具有类似的较强亲水能力及多羟基糖醇的普遍性质 [19]。肌醇甲醚可以影响动物体内的生理过程,包括降血糖、抗炎及抗肿瘤等。
各种(亚种)间干叶的甲基肌醇含量平均变化情况,见图3。

Figure 3. Contrast of methylinositol of dried leaves among all the test wild species and sub-species of Hipphphae
图3. 不同种(亚种)野生沙棘干叶甲基肌醇含量对比
7个沙棘种(亚种)20个样品的干叶甲基肌醇含量从最小的56.3 mg/100 g到最高的996.4 mg/100 g (表2),变动幅度很大,平均值为263.5 mg/100 g。从图2可以很直观地看出,只有江孜沙棘1个亚种的甲基肌醇含量平均值为331.3 mg/100 g,大于总体平均值(263.5 mg/100 g),其余6种(亚种)的甲基肌醇含量平均值均小于总体平均值(263.5 mg/100 g),分别为西藏沙棘(237.5 mg/100 g)、云南沙棘(228.5 mg/100 g)、中国沙棘(227.6 mg/100 g)、中亚沙棘(192.5 mg/100 g)、蒙古沙棘(78.4 mg/100 g)、肋果沙棘(61.6 mg/100 g)。
3.3. 不同种(亚种)间沙棘干叶白雀木醇含量对比
如前所述,白雀木醇是肌醇的众多甲基衍生物之一,其分子式为C7H14O6,分子量为194.18,最早发现于南美洲的白坚木树(Aspidosperma desmanthum)中,因此也叫“白坚木皮醇”,被称之为是天然存在并具有生物活性的万能结构单元 [20] [21],可用其作为具有光学活性的肌醇衍生物的原材料,对开发治癌、初老期痴呆症和艾滋病等手性药物具有潜在的价值。许多植物也陆续被发现含有该成分 [22] [23] [24] [25] [26],可供制药工业简单而方便地合成无毒、无害而有特效的手性药物,可开发抗生素、抗氧化、酶抑制剂等,用于抑制血管增生、治疗癌症、早老期痴呆症、糖尿病和艾滋病等 [27]。
7个沙棘种(亚种) 20个样品的干叶白雀木醇含量从最小的3.70%至最高的14.05% (表1),变动幅度很大,平均值为9.46%。为了更好地反映各种(亚种)间的平均变化趋势,将表1白雀木醇含量值按种进行平均做图(图4),可以很直观地看出,有3个种(亚种)的白雀木醇含量平均值大于总体平均值(9.46%),分别为蒙古沙棘(11.60%)、江孜沙棘(11.07%)、西藏沙棘(10.07%),其中西藏沙棘、江孜沙棘为进化程度高的沙棘种(亚种);5个种(亚种)的白雀木醇含量平均值小于总体平均值(9.46%),分别为肋果沙棘(8.85%)、中国沙棘(8.84%)、中亚沙棘(8.77%)、云南沙棘(6.95%)。7个种、亚种间的白雀木醇排序,总体趋势与甲基肌醇相近。
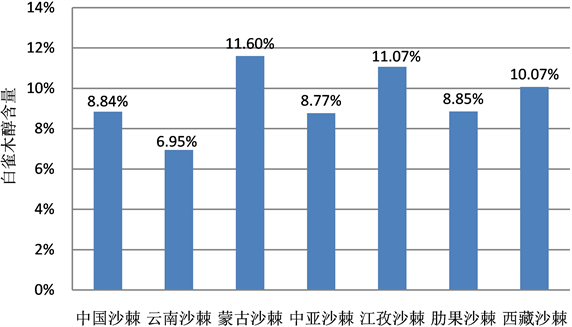
Figure 4. Contrast of L-quebrachitol of dried leaves among all the test wild species and sub-species of Hipphphae
图4. 不同种(亚种)野生沙棘干叶白雀木醇含量对比
3.4. 不同种(亚种)间沙棘干叶糖酸等含量对比
葡萄糖在生物学领域具有重要地位,是活细胞的能量来源和新陈代谢中间产物,即生物的主要供能物质;果糖在天然糖中甜度最高,主要用于食品甜味添加剂。葡萄糖、果糖与肌醇三者为同分异构体,分子式相同(C6H12O6),都含有6个碳,以六元环的形式存在。苹果酸有特殊愉快的酸味,是人体内部循环的重要中间产物,易被人体吸收,因此作为性能优异的食品添加剂被广泛应用于食品、医疗和保健品等领域。Vc结构类似葡萄糖,其分子中第2及第3位上两个相邻的烯醇式羟基极易解离而释出H+,故具有酸的性质,又称L-抗坏血酸。Vc是一种抗氧化剂,具强还原性,许多重要的生物合成过程中都需要其参与作用。。为了更好地反映各种(亚种)间干叶的糖(蔗糖、果糖、葡萄糖)、酸(苹果酸、Vc)等指标平均变化情况,将表1中各指标含量值按种(亚种)进行平均,详见表3。

Table 3. Mean values of sugars and acids of dried leaves among all the test wild species and sub-species of Hipphphae
表3. 不同种(亚种)野生沙棘干叶糖酸等指标测定平均值
从表2中可以看出,5个糖酸指标平均值,按种(亚种)由大到小的排序依次为:
蔗糖:江孜沙棘、西藏沙棘、中亚沙棘、蒙古沙棘、云南沙棘、中国沙棘、肋果沙棘;
葡萄糖:江孜沙棘、蒙古沙棘、中国沙棘、中亚沙棘、云南沙棘、西藏沙棘、肋果沙棘;
果糖:江孜沙棘、云南沙棘、中亚沙棘、蒙古沙棘、中国沙棘、西藏沙棘、肋果沙棘;
苹果酸:云南沙棘、蒙古沙棘、中国沙棘、江孜沙棘、西藏沙棘、肋果沙棘、中亚沙棘;
Vc:云南沙棘、中亚沙棘、蒙古沙棘、肋果沙棘、中国沙棘、江孜沙棘、西藏沙棘。
从大趋势上来看,3个糖类指标(蔗糖、果糖、葡萄糖)的排序较为接近,而苹果酸排序与糖类指标具有一些相反的排列趋势,Vc排序居于糖、酸其间。
4. 讨论
4.1. 肌醇和甲基肌醇
肌醇是一种水溶性亲脂维生素,具有与维生素B1、维生素H类似的作用,故通常将其归类为维生素B族,曾被称为维生素B8,在细胞内起着传递讯息及供给营养的作用。目前全球肌醇产量3 kt/a,我国和日本是世界上主要肌醇生产国;而全球肌醇需求量约35 kt/a,缺口很大。美国、西欧、东南亚各国是主要肌醇消费市场,其中保健品、化妆品和医药品占70%左右;饲料、食品行业占20%左右;其它领域10%。国内肌醇年消费量100 t以上,主要用于医药产品的生产,近两年来在饮料、奶制品、化妆品行业也有所应用。
一些新鲜水果的肌醇含量很高,比如柑橘含有300 mg/100 g,葡萄含有200 mg/100 g,黑莓含有170 mg/100 g,猕猴桃含有140 mg/100 g,此外豆类也含有100~200 mg/100 g,蔬菜含量变异很大,为1~100 mg/100 g,蔓越莓和草莓含有约15 mg/100 g左右 [28]。一些在芬兰、俄罗斯和我国山西取样测定沙棘果实的肌醇含量研究 [29],指出肌醇含量在亚种间差别很大,其中:中国沙棘为26.0 ± 15.6 mg/100 mL,蒙古沙棘为19.9 ± 3.3 mg/100 mL,海滨沙棘为7.7 ± 3.8 mg/100 mL,3种沙棘果实的肌醇含量与蔓越莓和草莓较为接近。
本文中提供沙棘叶片测定数据全为干基含量。为了与前述果实内容进行对比,下面所列数据均为参试沙棘的鲜叶肌醇含量。肌醇在不同种(亚种)鲜叶中的平均含量,以蒙古沙棘最低,为27.0 mg/100 g,江孜沙棘最高,达258.7 mg/100 g。从蒙古沙棘来看,肌醇在鲜叶中的含量稍高于鲜果含量。中国沙棘鲜叶的肌醇含量为147.3 mg/100 g,远高于其果实含量。从野生沙棘鲜叶的总体情况来看,肌醇测定的高值介于柑橘与葡萄果实之间,低值高于3种(亚种)的沙棘鲜果。说明沙棘鲜叶的肌醇含量高于沙棘鲜果,且与柑橘类新鲜果实相近。
干旱、低温、盐碱化等环境胁迫,往往会导致肌醇和甲基肌醇含量的增加 [30] [31]。不过由于野生沙棘基本上是物竞天择、自然选择的结果,采样地的沙棘应是基本适应当地自然环境条件的。因此,参试沙棘的肌醇含量、甲基肌醇含量排序,不否认自然环境的作用,但更应承认沙棘种(亚种)间的不同遗传基因所致。不过这只是推测,还需要以后开展更加深入的研究才能获得可靠结论。
4.2. 白雀木醇
白雀木醇是肌醇的衍生物,常作为前体药物或药物,具有降低胆固醇、促进健康毛发的生长及防止脱发等作用。早在1976年,Rasputina等用96%乙醇溶液抽提沙棘叶,并成功分离出白雀木醇 [32]。2003年,陕西省交通医院和西安交通大学药学院从沙棘叶中分离得到肌醇 [33]。芬兰土库大学研究团队于2005年在沙棘果实中分离出白雀木醇(2-O-甲基-1,2,3,4,5,6-六羟基环己烷),并发现其含量在不同沙棘种或亚种间不同,中国沙棘远高于海滨沙棘(H. r. ssp. rhamnoides)和蒙古沙棘 [34] [35] [36]。
国内重视沙棘白雀木醇的研究,是于2009年俄罗斯别洛库里卡召开的ISA会议上听取芬兰土库大学Yang B.教授的报告后才开始的。北京林业大学先后开展了沙棘白雀木醇提取制备、表征和器官间含量分布等的有关研究 [37] [38],发现白雀木醇含量以干叶中最高,其次为鲜果肉,沙棘鲜籽含量最低;在生长季随着叶片生长,白雀木醇含量呈现为逐渐升高趋势,至9月份含量最高,为沙棘资源中白雀木醇的开发应用提供了科学的依据。
北京大学的有关试验研究 [39] [40] 表明,沙棘果汁能显著降低2型糖尿病模型db/db小鼠的体重,减轻肥胖,且能显著改善2型糖尿病多食、多饮、多尿的症状;含有低剂量白雀木醇的沙棘果汁改善2型糖尿病多饮症状作用显著。研究证实,白雀木醇是中国沙棘果汁改善血糖,防治糖尿病的活性成分,其进一步的研究尚在进行中,但就目前结果而言,完全可以证实沙棘果汁改善2型糖尿病的作用。
本文不同种(亚种)沙棘干叶白雀木醇的测定数据排序为:蒙古沙棘(11.60%)、江孜沙棘(11.07%)、西藏沙棘(10.07%)、肋果沙棘(8.85%)、中国沙棘(8.84%)、中亚沙棘(8.77%)、云南沙棘(6.95%)。对比芬兰土库大学的有关中国沙棘果实白雀木醇含量远高蒙古沙棘的研究结果,从干叶测定结果来看,蒙古沙棘反而是最高的,比中国沙棘高2.76个百分点。这又从另外一个方面说明,有些沙棘种(亚种)间呈现的规律,随着生境的不同,也会发生很大的变化。芬兰土库大学测定的3个沙棘亚种,中国沙棘来源于我国山西(暖温带大陆性季风气候),蒙古沙棘来源于俄罗斯西伯利亚(亚寒带大陆性气候),海滨沙棘来源于芬兰(海洋性气候)。看来所谓3个亚种间的区别,可能更多地受制于3个截然不同自然环境条件的影响。当然这方面也需要再进行深入研究,才能得出可靠的结论。
5. 结论
对我国青藏高原及周边地区自然分布的野生沙棘资源叶片采样分析,发现其含有的肌醇、甲基肌醇、白雀木醇及糖酸类等与健康有关的一些生物活性成分含量比较丰富。以下为参试7个沙棘种(亚种)叶片8项指标的测定结果:
肌醇含量平均值为263.5 mg/100 g,从最低的61.6 mg/100 g (肋果沙棘)到最高的331.3 mg/100 g (江孜沙棘)变化。
甲基肌醇含量平均值为204.7 mg/100 g,从最低的69.7 mg/100 g (西藏沙棘)到最高的574.7 mg/100 g (云南沙棘)变化。
白雀木醇含量平均值为9.46%,从最低的6.95% (云南沙棘)到最高的11.60% (蒙古沙棘)变化。
蔗糖含量平均值为539.2 mg/100 g,从最低的32.2 mg/100 g (肋果沙棘)到最高的1488.2 mg/100 g (江孜沙棘)变化。
葡萄糖含量平均值为900.6 mg/100 g,从最低的256.8 mg/100 g (肋果沙棘)到最高的1360.4 mg/100 g (江孜沙棘)变化。
果糖含量平均值为528.3 mg/100 g,从最低的234.5 mg/100 g (肋果沙棘)到最高的803.7 mg/100 g (江孜沙棘)。
苹果酸含量平均值为322.0 mg/100 g,从最低的154.7 mg/100 g (中亚沙棘)到最高的1167.3 mg/100 g (云南沙棘)变化。
Vc含量平均值为113.6 mg/100 g,从最低的65.3 mg/100 g (西藏沙棘)到最高的189.5 mg/100 g (云南沙棘)变化。
可见,江孜沙棘叶片所含甲基肌醇、蔗糖、葡萄糖、果糖含量最高,云南沙棘叶片所含肌醇、苹果酸、Vc含量最高,蒙古沙棘叶片所含白雀木醇含量最高;而肋果沙棘叶片所含肌醇、蔗糖、葡萄糖、果糖含量最低,而西藏沙棘叶片所含甲基肌醇和Vc含量最低,云南沙棘叶片所含白雀木醇含量最低,中亚沙棘叶片所含苹果酸含量最低。
在所测8个指标中,江孜沙棘叶片有4个成分含量居于最高位,为在西藏地区进一步开展江孜沙棘资源建设和开发利用提供了强有力的科技支撑。云南沙棘叶片所含肌醇和Vc含量最高,同样为在西南地区开展云南沙棘资源建设和开发利用提供了科学依据。蒙古沙棘在我国北疆有自然分布,而在黑龙江、新疆广为栽培的“大果沙棘”也属于这一亚种,叶片较高的白雀木醇含量,为其综合开发利用指明了新的方向。
我国野生沙棘叶片资源功能和地位的测定分析,不仅是对其果实开发的重要补充,而且为充分利用各类自然资源,开展叶用型工业原料林资源建设,从而提高整体沙棘产业综合水平,意义深远且重大。
基金项目
水利部财政项目“水土保持业务”(126216223000200001)。