1. 引言
纳米TiO2由于具有优异的光稳定性、热稳定性、无毒性、光催化、光掩蔽等特性,成为了过去三十年中研究最为广泛的纳米材料之一 [1] [2],被广泛应用于光催化 [3] [4]、化学制氢 [5] [6]、锂电池 [7] [8]、抗紫外 [9]、自清洁 [10]、食品 [11] 等工业行业。纳米TiO2之所以具有诸多的优异性能,一方面取决于其本身的化学组成,另一方面取决于其颗粒独特的尺寸。而纳米颗粒由于自身具有极大的表面能,极易自身自发聚集而导致尺寸效应丧失。因此为了有效防止其自发聚集,人们在其体系中加入分散剂,通过分散剂分子之间的静电斥力等作用降低颗粒之间的表面自由能,增加纳米TiO2的稳定性。常用的分散剂从电荷类型上有离子型 [12] [13] 和非离子型分散剂 [14] [15]。从分子大小上来分有小分子分散剂和聚合物分散剂。小分子分散剂具有良好的吸附性能,但其在纳米TiO2颗粒表面进行单分子层吸附时,保护层厚度不够理想,另外离子型分散剂还会因为同种电荷的静电排斥,导致保护层排列不够致密。故此,人们为了克服小分子分散剂的缺陷,开发了聚合物分散剂。目前已见报道的聚合物分散剂主要有聚丙烯酸酯类 [13] [16],聚氧乙烯醚类 [17]。它们在结构上多属于二元共聚物,到目前为止,三元嵌段结构的聚合物分散剂还鲜有报道。
我们课题组前期以双丙酮葡萄糖(DAG)、丙烯酸叔丁酯(tBA)和N-异丙烯丙烯酰胺(NIPAM)为单体,通过可逆加成断裂链转移自由基聚合(RAFT)制备了三嵌段糖基聚合物PGNA (结构式见式1),该物质良好的pH和温度双重智能响应行为 [18]。本文设计利用PGNA分子在结构上的双亲性,作为新的聚合物分散剂用于纳米TiO2的分散,不仅能够克服传统小分子分散剂分子之间的静电斥力,同时可与分散基质多点锚固,在纳米TiO2颗粒表面形成高分子层,增加颗粒间的空间位阻排斥,实现对纳米TiO2颗粒的分散与稳定。
2. 实验部分
2.1. 试剂与仪器
丙烯酸叔丁酯(tBA,阿拉丁,99%)中的抑制剂用NaOH溶液水洗除去,然后减压蒸馏。N-异丙基丙烯酰胺(NIPAM,东京 Kasei Kogyo有限公司,98%)在正己烷中重结晶三次后真空干燥。3-氧-丙烯酰基- 1,2,5,6-双-氧-异丙叉基-α-D-葡萄糖利用丙烯酰氯与1,2,5,6-双-氧-异丙叉基-α-D-葡萄糖(阿拉丁)反应制得。三硫代碳酸酯S,S’-二(α,α’-二甲基-α’’-乙酸)-三硫代碳酸酯(CMP)根据文献 [19] 制备。引发剂偶氮二异丁腈(AIBN,上海试剂有限公司中国,99%)用乙醇重结晶后真空干燥。二恶烷(AR,上海润捷化学试剂有限公

Scheme 1. Synthesis of PGNA
式1. PGNA的合成
司)中加入氢化钠和钠丝,二苯甲酮为指示剂,回流1~2 h后常压蒸馏。纳米TiO2为锐钛型(阿拉丁,99.8%,100 nm)。蒸馏水,THF以及其他试剂均为分析纯(国药集团)。
紫外可见光谱仪(TU-1901 Double-beam UV-Vis spectrophotometer);荧光光谱仪(F-7000 fluorescence spectrometer (Japan));Bruker 500 MHz NMR核磁共振仪(DMSO-d6为溶剂,TMS为内标);Nicolet 5700红外光谱仪(KBr压片)。NDJ-8S布氏旋转式粘度计(上海乐傲实验仪器有限公司),Nano-ZS90激光粒度仪(英国Malvern公司)。场发射扫描电子显微镜(Hitachi S-4800),凝胶色谱分析仪(美国polymer公司PL-GPC 220型)。
2.2. PGNA合成
根据前期工作合成了6支PGNA样品(表1)。其合成共5个步骤 [18]:1) 利用RAFT聚合合成大分子链转移剂PtBA-CMP;2) 双嵌段聚合物PNIPAM-b-PtBA的合成;3) 三嵌段聚合物PAIDPG-b-PNIPAM-b-PtBA的合成;4) PAIDPG-b-PNIPAM-b-PtBA脱硫;5) 脱硫后的聚合物水解得到PAG-PNIPAM-PAA。合成路线如式1所示。

Table 1. 6 PGNAs with different molecular weights (the approximate molar ratio of PAG:PNIPAM:PAA = 1:4:4)
表1. 6支不同分子量PGNA (PAG:PNIPAM:PAA之间物质的量之比大约为1:4:4)
2.3. 吸附等温线
分别配制50 mL浓度为10.0 mg/L、20.0 mg/L、30.0 mg/L、40.0 mg/L、50.0 mg/L、60.0 mg/L、70.0 mg/L、80.0 mg/L的PGNA1的乙醇水溶液(体积比1:1);各称取0.50 g纳米TiO2于8只100 mL具塞锥形瓶中并标号,分别加入上述含有PGNA1的乙醇水溶液,随后向每只锥形瓶中分别补加乙醇水溶液配制成总质量为50.0 g的悬浮液,其中纳米TiO2质量分数为1%,PGNA1的质量分数分别为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%;配制完成后将八只具塞锥形瓶放入超声波清洗器中超声分散约3 h;分散完成后取出具塞锥形瓶,放于25℃水浴恒温振荡器中振荡约12 h至吸附平衡为止;吸附完成后取出具塞锥形瓶,分别倒入8只具塞离心管中,标号后放入离心机内,在14,000 rpm的转速下离心30 min后取上层清液在在紫外分光光度计上测定其吸光度,得出上层清液中残留的PGNA1的浓度,从而计算出PGNA1的吸附量,计算公式如下:
(1)
(1)式中,Q代表PGNA1的吸附量(mg/g),Ci和Ct分别代表PGNA1在吸附体系中的起始浓度及最终浓度(mg/L),V代表吸附体系的体积(ml),m代表吸附体系的总质量(mg)。
加入PGNA2至PGNA6的悬浮液的吸附试验与PGNA1相同。
2.4. 沉降实验
分别配制50 mL浓度为0.35 g/L的PGNA1、PGNA2、PGNA3、PGNA4、PGNA5和PGNA6的乙醇水溶液;各称取2.5 g纳米TiO2于六只100 mL具塞量筒中并标号,分别加入上述含有糖基聚合物的乙醇水溶液,随后向每只具塞量筒中分别补加乙醇水溶液配制成总质量为50 g的悬浮液,其中纳米TiO2质量分数为5% (占总质量),糖基聚合物质量分数为0.7%(占纳米TiO2的质量);配制完成后将六只具塞量筒放入超声波清洗器中超声分散约3 h;分散完成后取出具塞量筒,静置让其进行自由沉降,12 h后分别吸取等量的上部悬浮液在紫外分光光度计上测定其吸光度。
2.5. 粘度测定
分别配制25 mL浓度为2.4 g/L、4.8 g/L、9.6 g/L、14.4 g/L、16.8 g/L、19.2 g/L、21.6 g/L、24.0 g/L、26.4 g/L、28.8 g/L的PGNA3的乙醇水溶液;各称取60 g纳米TiO2于十只150 mL烧杯中并标号,分别加入上述含有PGNA1的乙醇水溶液,随后向每只烧杯中补加乙醇水溶液配制成总质量为100 g的悬浮液,其中纳米TiO2质量分数为60%,PGNA1的质量分数(占纳米TiO2的质量)分别为0.1%、0.2%、0.4%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%;配制完成后将十只烧杯覆盖上多层保鲜膜封口后放入超声波清洗器中超声分散约3 h;分散完成后取出烧杯,使用布氏粘度计在60 rpm转速下测定其粘度。
2.6. 粒度测定
分别配制100 mL浓度为0、2.0 mg/L、4.0 mg/L、6.0 mg/L、8.0 mg/L、10.0 mg/L、12.0 mg/L、14.0 mg/L的PGNA1的乙醇水溶液;各称取0.1 g纳米二氧化钛于八只150 mL烧杯中并标号,分别向后七只烧杯中加入上述含有PGNA1的乙醇水溶液,随后向每只锥形瓶中分别补加纯乙醇水溶液配制成总质量为100 g的悬浮液,其中纳米二氧化钛质量分数为0.1%,PGNA1的质量分数分别为0.0%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%;配制完成后将八只烧杯覆盖上多层保鲜膜封口放入超声波清洗器中超声分散约1 h;分散完成后取出烧杯,使用激光粒度仪测定纳米二氧化钛的粒度。
3. 结果与讨论
3.1. 吸附等温线
PGNA1至PGNA6在纳米二氧化钛上的吸附等温曲线如图1所示。图中的所有曲线都是通过Langmuir等温吸附线对吸附平衡时PGNA在纳米TiO2上的吸附量进行拟合而成的,具体拟合公式如下 [19]:
(2)
(2)式中,Qe代表吸附平衡时该PGNA在纳米TiO2上的吸附量(mg/g),Ce代表吸附平衡时该PGNA在溶液中的浓度(mg/l),Qm和b是Langmuir吸附常数,分别代表最大吸附量(mg/g)以及吸附能(l/mg)。
Langmuir吸附常数的Qm和b的数值可以通过非线性回归分析获得,图1中各曲线在非线性回归分析中得到了数据如表2所示。

Table 2. Langmuir isotherm nonlinear regression analysis constants
表2. Langmuir等温式非线性回归分析数值

Figure 1. The isotherm absorption curves of PGNA onto nano-TiO2
图1. PGNA在纳米TiO2上的等温吸附曲线
由图1可以看出,PGNA在在纳米TiO2上的吸附是单分子层吸附,符合Langmuir吸附等温式。随着PGNA用量的增加,PGNA在纳米TiO2上的吸附量也有所增加,当PGNA的用量达到0.7% (W/W)左右时吸附等温线的走向开始趋于平缓,当用量达到0.8% (W/W)时等温吸附量几乎不再增加,基本达到吸附平衡状态。对于几种分子量大小不同的分散剂而言,随着糖基分散剂分子量的增加,其在单位面积纳米TiO2上所吸附的分子数量却在逐渐减少,即具有最小分子量的PGNA1在吸附平衡时具有最高的吸附量,而具有最大分子量的PGNA6在吸附平衡时的吸附量却最小,这是因为纳米TiO2上的活性吸附点是有限的,分子量越低空间位阻越小,有利于吸附,反之分子量越大空间位阻也越大,不利于吸附,吸附量降低。
3.2. 沉降实验
测定了相同浓度(TiO2质量分数为5%,糖基聚合物质量分数为0.7%)不同分子量PGNA悬浮液自由沉降12 h后的吸光度值A(图2)。吸光度A与单位体积内的纳米TiO2粒子数是成正比的,可以利用吸光度值来表达纳米二氧化钛在分散体系中的稳定性。分子量的大小体现了分子的长短,也决定了各链节的长短(所合成的PGNA中三链段PAG:PNIPAM:PAA之间的物质的量之比大约为1:4:4),而各链节的长短对其吸附锚固能力和溶剂化作用有决定性的影响。分散剂的分子量过小或过大都不利于其起到良好的分散作用,因为分子量过小时溶剂化链的长度不足以阻隔纳米TiO2颗粒间的吸引力,分子量过大则容易导致因锚固不牢固而致使糖基分散剂从纳米TiO2颗粒上脱落。从图中可以看出在沉降了12 h之后,分子量为14,346 Da的PGNA3的分散体系吸光度值最大,发生沉降的纳米TiO2最少,分散体系最稳定。
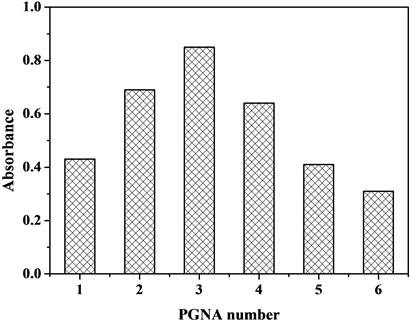
Figure 2. Absorbance values of the dispersion using PGNA within 12 h (
5%, W糖基聚合物0.7%)
图2. PGNA悬浮液自由沉降12 h后的吸光度值(
5%,W糖基聚合物0.7%)
3.3. 粘度测试
粘度能够反映出体系分散效果,纳米颗粒分散越均匀,粒径越平均,体系粘度会降低。在纳米TiO2的分散体系中加入PGNA3后,粘度明显降低,分散体系得到了良好的改善;随着PGNA3的增加,粘度逐渐降低,至用量约为0.7%时,粘度降到最低,等温吸附实验中已有得出PGNA3的用量约为0.7%时基本达到吸附平衡的结论,故当超分散剂用量大于0.7%时,体系中游离的糖基聚合物的量逐步增加,多出的糖基聚合物的溶剂化链缠绕纠结在一起,致使体系粘度不但不再降低反而升高,最终导致体系稳定性减弱(见图3)。
3.4. 粒径测定
为了进一步证明纳米TiO2得到了很好的分散,测定了PGNA3在不同浓度条件下纳米TiO2的平均粒径。结果表明,没有分散剂时,平均粒径高达近400 nm。而随着分散剂的用量增加,颗粒粒径不断降低,在糖基聚合物用量为0.7%~0.8%时粒径尺寸达到最低点,粒径约120 nm。进一步增加PGNA3的用量,其粒径反而有所增大,这是因为当分散剂在纳米TiO2颗粒表面吸附饱和以后,过多的糖基聚合物之间的链缠绕纠结,反而在一定程度上损害了其分散能力。同时不难发现,粒径变化与粘度变化是一致的(见图4)。
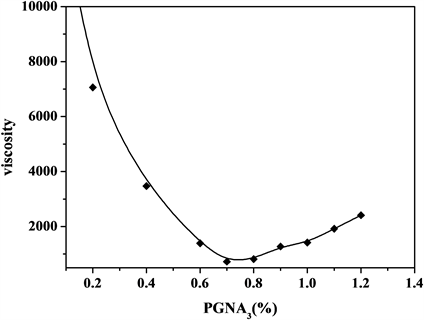
Figure 3. The effect of PGNA3 dosage on the viscosity
图3. PGNA3用量对纳米TiO2分散体系粘度的影响

Figure 4. The effect of PGNA3 dosage on the nano-TiO2 particle size
图4. PGNA3用量对纳米TiO2的粒径的影响
3.5. SEM和FT-IR
为了进一步证明PGNA吸附于纳米TiO2颗粒表面,对未加入分散剂的纳米TiO2和加入0.7% (W/W)PGNA3的纳米TiO2进行了FT-IR表征(见图5)。由图中可以看出,使用0.7%的PGNA3处理后的纳米二氧化钛在FT-IR光谱上上多出了2处峰值(1735 cm−1和1653 cm−1),这两个吸收峰是PGNA3上羧基和酰胺基上羰基C=O的伸缩振动,但是由于PGNA3的用量非常少(仅0.7%),使得它在FT-IR谱图上的峰值也很小,但是这个峰值的出现足以说明PGNA3在纳米TiO2上的吸附是存在的。
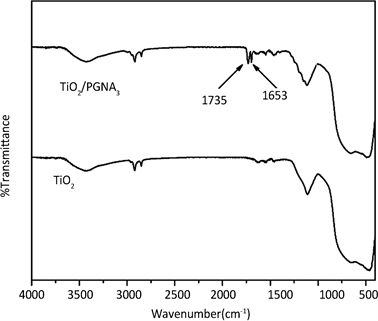
Figure 5. FT-IR spectra of untreated nano-TiO2 and nano-TiO2 dispersed with PGNA3 of 0.7% (W/W)
图5. 未经处理的纳米TiO2与使用0.7% (W/W) PGNA3处理后的纳米TiO2的FT-IR谱图
SEM可以直接观测到纳米TiO2颗粒的分散程度,通过扫描电镜观测了未经处理的纳米TiO2和用PGNA3处理后的纳米TiO2的分散状态,由图6a可以看出,没有加入纳米TiO2的团聚现象非常严重,而图6b中纳米TiO2的团聚现象明显减轻,颗粒的轮廓清晰可见,由此可见三元糖基聚合物PGNA对纳米TiO2确实具有良好的分散性能。

Figure 6. (a) SEM of nano-TiO2 without PGNA; (b) SEM of nano-TiO2 dispersed with PGNA3 of 0.7% (W/W)
图6. (a) 未经处理的纳米TiO2的SEM图;(b) 0.7%的PGNA3处理后的纳米TiO2的SEM图
4. 结论
1) 以DAG、tBA和NIPAM为单体,AIBN为引发剂,CMP为链转移剂,通过RAFT聚合制备了6个分子量不同的三嵌段糖基聚合物PGNA。
2) 将PGNA应用于纳米TiO2的分散,PGNA在纳米TiO2颗粒表面为单分子层吸附,遵循Langmuir吸附等温式;分子量为14,346 Da的PGNA3分散性能优异,在纳米TiO2颗粒表面最大吸附量为5.35 mg/g;平均粒径为120 nm。
3) FT-IR和SEM表明PGNA确实吸附于纳米TiO2颗粒表面,PGNA对于纳米TiO2颗粒展现了良好的分散性能。
基金项目
江苏省高校自然科学研究基金(NO.19KJB430030)和南通市科技项目(NO.JC2020130, JC2020133, JC2020134)资助。