1. 引言
少数民族发酵奶酪制品,在当地饮食文化中起主要作用,传统发酵奶酪中蕴藏着丰富的微生物资源。这些历经千年进化和自然优化的微生态体系中保留着许多赋予传统发酵奶酪特殊质地和风味的多种微生物,为有益微生物的发掘提供了宝贵的资源。近年来研究发现,酵母作为一种辅助发酵剂,在乳制品发酵和成熟过程中可以影响其风味,抑制有害细菌的生长,有些菌株可预防和治疗急性痢疾、降低机体胆固醇、抗氧化和抗辐射等益生活性作用 [1] [2]。有研究表明,有些酵母菌不仅不会对乳制品的品质造成负面影响,相反,还会对发酵乳制品提供有益作用,尤其对奶酪的风味形成起到了非常重要的作用。在奶酪成熟过程中,酵母菌的蛋白水解、脂类降解、乳糖降解能力以及乳酸和柠檬酸同化起到很重要的作用 [3],与奶酪的风味形成关系密切。
我国乳品产业发展迅速,市场对奶制品功能性需求不断增大,开发具有益生特性的乳制品成为行业未来发展趋势,从传统发酵乳制品中筛选具有潜在益生特性的酵母菌应用于乳制品加工中,开发新型乳制品已经是迫在眉睫。成果将打破发酵菌种单一的现状,研究混菌发酵的方法,开发具有我国自主知识产权的酵母菌菌株及相关产品,为传统乳制品的开发提供理论和实践支持。本研究以内蒙古阿拉善和乌审旗传统奶酪为原料,筛选具有潜在益生活性酵母菌,通过形态观察、生理生化试验及5.8S rDNA ITS1/ITS4区域序列同源性分析鉴定菌种,并测定其耐酸及耐胆盐性能。以期筛选到益生性能较好的酵母菌,为其在发酵食品中的应用提供依据。
2. 材料与方法
2.1. 材料试剂及设备
试验材料:在内蒙古地区的阿拉善和乌审旗采集传统奶酪,标号记录采样地点后封口低温(4℃)储存,并及时进行筛选分离。
试验药品:胆盐、酵母膏、蛋白胨、葡萄糖、蔗糖、乳糖、麦芽糖、棉子糖、可溶性淀粉(均为分析纯),试剂均来自于博迈德公司;2*Taq PCR Master mix (货号:T201-01)、胶回收试剂盒(货号:DH101-01),定制引物均由博迈德生物提供;YPD培养基、YEPD固体培养基、碳源培养基、氮源培养基 [4]。
试验仪器:PCR扩增使用Biometra PCR仪,电泳仪为bio-rad,紫外可见分光光度计(SP-721/721E)上海光谱仪器有限公司;标准型洁净工作台(SW-CJ-2FD)上海博迅实业有限公司;显微镜(CX21)日本奥林巴斯株式会社。
2.2. 实验方法
2.2.1. 传统奶酪中酵母菌的分离筛选
取1 g样品,溶于9 mL无菌水中,混匀后置于25℃培养箱。培养1 h后,接种1 mL于YPD液体培养基中活化,25℃培养24 h~36 h,然后在PDA培养基上用平板稀释法分离活化菌株。培养板在25℃下培养。观察并记录菌落特征。选取形态不同的单菌落,染色后观察细胞形态,将具有酵母特征的单菌落接种于PDA培养基中纯化培养3~4次,镜检合格后,二次纯化的酵母YEPD斜面,25℃培养24 h~36 h,然后4℃保存备用 [5]。
2.2.2. 潜在益生酵母菌的筛选
1) 耐酸试验
所选菌株的耐酸性测定,试验调节培养基的pH值分别为(1.5,2.0,3.0,5.0和6.5)。测定32株酵母菌株在不同pH值下的耐受性。将4%的细菌悬浮液加入5种不同pH值的液体筛选培养基中 [6],以中性条件pH值作为空白对照。在30℃下,以180 r/min转速振荡24 h培养,测定OD600 nm的吸光度。
2) 耐胆盐试验
将上述耐酸性好的酵母菌株接种于含0%、0.2%、0.4%和0.6%猪胆盐的固体胆盐培养基中,恒温培养12 h,用菌落计数法计算活菌数 [7]。观察不同胆盐浓度对酵母生长的影响。耐胆汁盐能力计算公式为:耐受率(%)耐受性(%) = ΔE/ΔF × 100;Δf:对照培养基中细胞增长量;ΔE:细胞在添加胆盐的培养基中增长量。
3) 模拟人体温度下的生长测试
将所选菌株的悬浮液接种于YEPD固体培养基上,在37℃摇床(180 r/min)培养24 h,采用活菌平板计数法计数。试验设置3组重复。
4) 人工模拟胃液耐受能力测定
按0.5%的量向液体肉汤培养基中加入NaCl,调pH3.0,高压灭菌。无菌条件下添加胃蛋白酶,使其浓度为5 g/L,制成模拟胃液。将菌悬液以10%的量加入到模拟胃液中,37℃培养2 h。将模拟胃液处理前后的菌液分别均匀涂布于固体肉汤培养基固体平板上,作三个平行,37℃培养48 h。用平板计数法计算活菌数,比较胃液处理前与处理后菌株的存活量,判断菌株对胃液的耐受能力。
Δlog (存活率) = 胃液处理后的活菌数/胃液处理前的活菌数
2.2.3. 菌株的生理生化鉴定
生化鉴定方法参照《酵母菌的特征与鉴定手册》 [8],通过繁殖方式观察、碳源同化试验、氮源同化试验、产酸试验等生理生化特征进行鉴定 [9],根据菌株的培养形态特征及生理生化特性初步确定其分类地位。
2.2.4. 菌株的分子学鉴定
1) 引物序列 [10]
ITS1: 5’-TCCGTAGGTGAACCTGCGG -3’
ITS2: 5’-TCCTCCGCTTATTGATATGC-3’
2) 酵母基因组DNA提取过程
① 超净台中取出部分菌体于无菌研钵中,加入适量干冰,进行快速研磨至粉状,加入细胞裂解液PL (400 uL),继续研磨至液态;
② 移液枪取出上述液体于1.5 mL无菌EP管,65℃水浴15 min,取出,自然冷却至室温;
③ 上述EP管中加入等体积酚氯仿溶液,充分混合,进行抽提。离心5 min。缓慢取上清与1 mL乙醇溶液中(含50 uL,3M乙酸钠),并轻轻混匀,于−20℃冷冻60 min。
④ 13000 rpm离心10 min,并有1 mL 70%乙醇水溶液漂洗2遍。去除上清留下沉淀,室温放置5~10 min,至溶液挥发。
⑤ 加入50 uL溶解液TE。充分溶解。
⑥ 取2 uL溶液加入到2 uL 2x Loading Buffer,进行1%琼脂糖凝胶电泳。(160 V, 15 min),得到基因组DNA凝胶电泳图谱。
3) PCR扩增
扩增体系及条件见表1:

Table 1. Amplification system and conditions
表1. 扩增体系及条件
4) PCR产物电泳检测及回收测序
取上述扩增产物50 uL进行2%琼脂糖凝胶电泳(160 V, 13 min),将目标片段大小(500 bp左右)切割与2 mL EP管中,加入600 uL溶胶液,65℃水浴10 min,经吸附柱回收PCR产物。然后将回收产物进行测序。
2.2.5. 数据分析
将菌株的5.8S rDNA基因序列提交到NCBI数据库进行DNA序列的同源比对,将相似度高的序列与测定序列通过Clustalx进行多重序列比对,比对结果用MEGA软件中的Neighbor-Joining法构建系统发育树 [11]。
3. 结果与分析
3.1. 益生酵母菌筛选
3.1.1. 菌株耐酸性
对筛选酵母菌进行益生性筛选实验发现,在不同pH值条件下,(bing-8和a-3)菌株均能够正常生长,且生长活性较高,在高酸(pH = 1.5)条件下,测定其吸光值均高于0.4,在此条件下,酵母菌细胞均能存活,表明这2株菌具有较好的耐酸特性。
3.1.2. 菌株耐胆盐测定
在胆盐含量浓度达到1 g/L条件下,(bing-8和a-3)菌株增长率分别达到13.68%、6.05%,而在5 g/L胆盐下增长率分别为13.01%和3.03%,增长率略微下降,说明bing-8和a-3在5 g/L胆盐下具有一定的生长力、耐受性。在模拟胃液中培养4 h后,bing-8和a-3株酵母菌数量略微降低,有较好的耐胆盐性,具有一定的存活性。
3.1.3. 人体温度下的生长测试
菌株耐温性实验中,(bing-8和a-3)菌株在37℃恒温培养24 h,2株酵母菌生长正常,结果显示37℃条件菌株生长不受影响。
3.1.4. 人工模拟胃液耐受能力测定
菌株粘附在肠黏膜上,形成稳定菌群,是促进人体肠道内的菌群平衡的首要条件 [12],胃液的pH一般在3.0左右 [13],所以在人工模拟胃液(pH 3.0)的环境中对2株代表性菌株进行培养,用平板计数法统计胃液处理前后平板中的活菌数。结果见表2。

Table 2. Results of artificial gastric juice tolerance test
表2. 人工模拟胃液耐受试验结果
注:*表示P < 0.05差异显著;**表示P < 0.01差异极显著;上标含有相同字母的无显著差异。
由表2可以看出,在模拟胃转运过程中菌株活菌数虽有不同程度下降,但经过人工模拟胃液处理2h后都能保持活菌数在106 CFU/mL以上,且差异极显著,显示出菌株在胃液中具有不同程度的耐受能力。菌株bing-8的Δlog值为+0.85,比胃液处理前的活菌数有所增加,说明该菌株能够在胃液中存活并生长,有很强的耐受能力。菌株a-3的Δlog值在−1至0之间,存活率较高,耐受能力较强。
3.2. 菌落形态及细胞形态特征
菌株bing-8培养皿中有单菌落出现,菌落形态呈椭圆形,表面光滑湿润,干燥,颜色呈乳白色,表面有凸点,边缘整齐。显微镜下细胞染色为蓝色,形态为椭圆。无性繁殖方式为芽殖,一端出芽。a-3酵母菌培养皿中有单菌落出现,菌落形态呈圆形,表面光滑湿润,干燥,颜色呈白色,边缘整齐。显微镜下细胞染色为蓝色,形态为圆型,无性繁殖方式为芽殖,一端出芽,划线接种于YPD固体培养基培养后,菌落形态及美兰染色结果见图1。
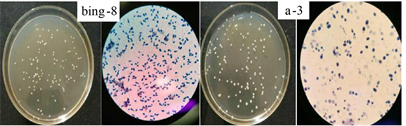
Figure 1. Colony morphology and cell morphology of (bing-8 and a-3) yeast (100×)
图1. (bing-8和a-3)酵母菌菌落形态及细胞形态(100×)
3.3. 酵母菌的生理生化鉴定结果
结合图1酵母菌的菌落形态和表3生理生化试验鉴定结果,分离株均为芽殖,在糖发酵实验中,葡萄糖、半乳糖和蔗糖可以被发酵,乙醇和柠檬酸可以在碳源同化实验中被同化,硝酸盐在氮源同化实验中不能被同化,属于毕赤酵母。

Table 3. Physiological and biochemical identification results of strains
表3. 菌株的生理生化鉴定结果
注:“+”表示阳性;“−”表示阴性。
3.4. 酵母菌的5.8S rDNA鉴定
3.4.1. 分离菌株5.8S rDNA PCR扩增结果
通过对酵母菌株DNA用5.8S rDNA的区引物进行PCR扩增,扩增电泳图如图2。可以看出(bing-8和a-3)酵母菌株的DNA片段长度在500 bp左右。符合酵母菌5.8S rDNA区理论预期值 [14],可初步鉴定为酵母菌。
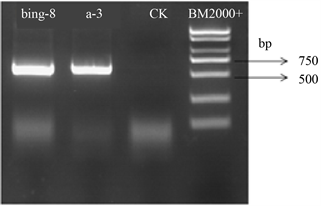
Figure 2. PCR amplified electrophoresis map of (bing-8 and a-3) strains
图2. (bing-8和a-3)菌株PCR扩增电泳图
3.4.2. 基于5.8S rDNA基因序列的酵母菌株系统发育分析
2株分离酵母菌的分子生物学鉴定结果DNA测序结果在NCBI网站上进行序列同源性比对,最终确定两株菌为发酵毕氏酵母(Pichia fermentans)。用MEGA6.0构建系统进化树见图3。
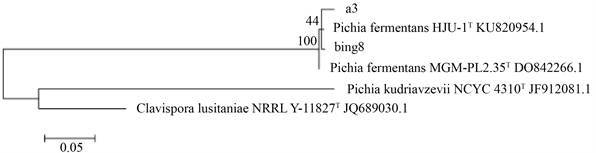
Figure 3. Phylogenetic tree constructed by yeast strain 5.8S rDNA
图3. 酵母菌株5.8S rDNA构建的系统进化树
4. 结论
本试验从内蒙古阿拉善和乌审旗传统方法生产的奶酪中,进行益生酵母菌的分离,对分离菌株进行耐酸性、耐胆盐、模拟人体温度下的生长测试及胃液耐受能力测定,最终筛选得到2株益生酵母菌bing-8和a-3。釆用传统的培养方法进行形态观察,通过生理生化试验结合5.8S rDNA分子生物学鉴定,结果显示2株益生酵母菌均为发酵毕赤酵母(Pichia fermentans)。
基金项目
内蒙古教育厅资助项目(NJZY19059)。
参考文献
NOTES
*通讯作者。