1. 引言
真菌性角膜炎是一种致盲率极高的眼病,主要好发于热带和亚热带地区,在发展中国家最为常见 [1] [2]。真菌性角膜炎常见的致病菌包括曲霉菌属、镰刀菌属、弯孢菌属和念珠菌属 [3]。目前,随着广谱抗生素和糖皮质激素的滥用及角膜接触镜配戴的广泛应用,真菌性角膜炎患病率有逐年增加的趋势 [4] [5]。作为世界上最大的发展中国家,农业作为我国的重要产业,我国真菌性角膜炎发病的主要原因为植物性外伤。然而,目前临床上使用的治疗真菌性角膜炎的药物具有角膜局部渗透作用差、刺激性强、角膜毒性大和特异性差等缺点,并且也无法解决过度的炎症反应导致的角膜基质破坏的问题,此外,手术治疗存在免疫排斥、供体缺乏等问题也是真菌性角膜炎治疗的棘手问题 [6]。因此,寻找一种安全无毒、有效的治疗真菌性角膜炎的药物是亟需解决的问题。
固有免疫作为机体抵御病原体入侵的重要防线。当致病真菌经破损的角膜上皮侵入上皮下组织后,可以产生多种酶类破坏角膜组织并促进菌丝在角膜中的扩散,此外,真菌细胞壁表面的病原体相关模式分子被位于角膜上皮表面的模式识别受体识别时便可启动固有免疫 [7] [8] [9]。眼表的模式识别受体主要存在于角膜上皮、结膜上皮、巨噬细胞及树突状细胞等细胞面表面。其中,C型凝集素样受体、Toll样受体和核苷酸结合寡聚化结构域样受体等作为参与真菌性角膜炎的模式识别受体,在真菌性角膜炎的免疫应答过程中起到重要的作用。树突状细胞相关的C型凝集素-1即Dectin-1受体作为C型凝集素受体家族中的重要角色,真菌细胞壁表面的β-葡聚糖可以被Dectin-1受体特异性识别进而诱导机体产生先天性免疫应答,快速介导下游炎症反应的产生,产生的炎症因子和趋化因子参与抗真菌免疫炎症反应 [10] [11] [12] [13]。Toll样受体中的TLR-2存在于细胞表面,在真菌性角膜炎中可以触发IL-6、IL-1β和TNF-a和趋化因子等炎症细胞因子的释放,参与炎症反应 [14]。血凝素样氧化低密度脂蛋白受体1 (LOX-1),作为参与真菌性角膜炎炎症过程的模式识别受体的一种,已有研究证实抑制LOX-1/IL-1β信号传导通路可以减轻炎症反应 [15]。目前已有多项研究证实真菌性角膜炎中TLR-2,Dectin-1,LOX-1表达升高,而抑制TLR-2,Dectin-1,LOX-1的表达会减轻真菌性角膜炎的炎症反应 [10] [15] [16]。
CS是主要存在于动物的软骨,皮肤,血管,韧带和肌腱中,是由重复的二糖单元组成糖胺聚糖,其中D-葡萄糖醛酸和N-乙酰半乳糖胺通过β-1,4-糖苷键相连 [17]。已有研究证实CS具有抗炎、免疫调节、心脑血管保护、神经保护、抗氧化、抗凋亡、细胞黏附调节、抗肿瘤等众多的药理作用 [18] - [23]。研究已经证实,CS有显著的抗炎作用,并且已经作为临床上用于治疗骨关节炎的有效药物 [24]。在动物骨关节炎模型中,CS发挥抗炎作用与其使Erk1/2和p38MAPK磷酸化的减少以及NF-κB的核反式激活有关 [25]。但目前尚未发现CS在真菌性角膜炎中作用机制的研究。本文主要针对CS在小鼠烟曲霉菌性角膜炎中的抗炎作用进行研究。
2. 实验材料
2.1. 实验物品
2.1.1. 实验对象
购自济南朋悦实验动物繁育有限公司SPF级雌性C57BL/6小鼠(7~8周龄)小鼠,经检疫均合格,实验前检查小鼠全身情况并于裂隙灯下检查眼部情况确保眼部健康,所有动物使用均符合中国科学技术部实验动物的人道待遇指导(vgkfcz-2006-398),并且均符合美国眼科和视觉研究协会的有关伦理要求和相关规定。
2.1.2. 实验烟曲霉菌
购买于中国普通微生物菌种保藏管理中心的标准烟曲霉菌菌株(编号3.0772)。
2.1.3. 实验细胞
购自中国科学院(上海)的小鼠RAW 264.7细胞系。
2.2. 实验主要相关耗材
2.2.1. 细胞培养及真菌培养所需实验试剂和耗材
细胞培养瓶 美国Corning公司;Sabouroud培养基 北京Solarbio公司;组织研磨棒 美国Corning公司;无水乙醇江苏强盛功能化学股份有限公司;PBS磷酸盐缓冲液粉末(2 L)北京Solarbio公司;蛋白胨北京Solarbio公司;Tween 20、Tween 80 美国Sigma-Aldrich公司。
2.2.2. 构建动物模型所需的实验耗材与试剂
微量注射器(10 μl) 瑞士Hamilton公司,Parafilm封口薄膜上海生物有限公司;一次性注射器(30 G)上海康德莱公司;组织研磨棒(玻璃)江苏金佩有限公司;眼科专用手术显微器械上海眼科耗材中心。
2.2.3. 实验用药
CS(CS) MCE公司。
2.2.4. PCR实验试剂及耗材
EP管(1.5 ml, 2 ml)美国Corning公司;RNAiso Plus日本TaKaRa有限公司;三氯甲烷(氯仿)江苏强盛功能化学股份有限公司;异丙醇江苏强盛功能化学股份有限公司;SYBR PremixExTaq (Til RNaseH Plus)日本TaKaRa有限公司;无水乙醇江苏强盛功能化学股份有限公司;Prime Script RT逆转录试剂盒日本 TaKaRa有限公司;PCR八联排薄壁管(0.2 ml,含平盖)美国Axygen公司;DEPC-treated water (100 ml)北京Byotime公司;Tip枪头(1000 μl、200 μl、10 μl) 美国Axygen公司。
2.3. 实验方法
2.3.1. 烟曲霉菌的培养与制备
在无菌超净操作台上将复温的标准烟曲霉菌株吹打后采用平板划痕法接种于Sabouroud琼脂固体培养基上,置于30℃恒温孵育箱内孵育4~5天,确保其在培养基内正常生长,并且在显微镜下密切关注菌株的生长状态,待培养基长出菌丝后,在无菌超净操作台上使用含有0.1% Tween20的PBS缓冲液冲洗培养基,收集孢子。经洗涤、离心(4℃、12,000 g、5分钟)、弃上清、重悬,4℃低温保存。
2.3.2. 建立小鼠烟曲霉菌性角膜炎模型
使用1 ml无菌注射器腹腔注射浓度为8%水合氯醛(0.4 ml/kg)麻醉小鼠。在眼科手术显微镜下,使用30 G一次性注射器针头在瞳孔缘对应的角膜做一深达中部基质层的点状划痕,使用10 μL Hamilton微量注射器将2 μL孢子悬液(2.5 × 107 cfu/mL)注射至小鼠右眼中央角膜基质层,左眼不予处理,作为空白对照组。将小鼠随机分为两组,分别为400 μg/ml浓度的CS处理组和PBS处理组。给药方式为滴眼液点眼,给药频率为一天四次,在建模后的第1、3天,对小鼠角膜使用眼科裂隙灯下拍照观察并进行临床评分。评分标准参照WU [26]。
2.3.3. RAW细胞处理
将RAW细胞接种于12孔板上,于恒温箱培养至融合率达到80%时,使用灭活的烟曲霉菌菌丝悬浮液(菌丝终浓度为5 × 106 cfu/ml)刺激1小时后,加入不同浓度的CS (100 μg/ml、200 μg/ml和400 μg/ml)或PBS,灭活的烟曲霉菌菌丝悬浮液刺激8小时后使用细胞刮收集RAW细胞于EP管中,用于Real-Time RT-PCR实验,用于检测TLR-2,Dectin-1和LOX-1的mRNA表达。
2.3.4. Real-Time RT-PCR实验方法
1) 提取Total RNA
将12孔板RAW细胞每孔中加入500 μl RNA裂解液,细胞刮轻刮孔底,移液枪收集样本至EP管中;将取小鼠角膜组织置于装有800 μl RNA裂解液的EP管中,超声细胞破碎仪破碎角膜组织。将两者置于冰盒裂解30分钟。4℃,12,000 rpm,离心10分钟后提取上清液移至EP管中。向提取的上清液中加入与RNA裂解液1/5体积量相等三氯甲烷,,振荡混匀,室温静置5 min,4℃,12,000 rpm,离心15分钟后提取上清液移至EP管中。继续将提取上清液中加入等体积异丙醇,振荡混匀,室温放置10 min,4℃,12,000 rpm,离心10分钟后弃上清液,保留RNA沉淀。75%乙醇洗涤RNA沉淀,重复振荡混匀,4℃,12,000 rpm,离心10分钟后弃上清液,保留RNA沉淀,待EP管中的液体完全蒸发后,向管底加入10 μl DEPC水溶解RNA沉淀,充分振荡–离心–振荡,操作结束后即刻测定RNA的含量、纯度和纯度。
2) Total RNA含量及浓度测定
调整核酸蛋白分析仪的OD值(optical density, OD)至0后,取1 μl样本进行测定,在260 nm、280 nm处OD值以及OD260/OD280的比值R,(RNA纯净度:R值 > 1.6),测量三次取平均值。
3) PCR
将SYBR Premix Ex Tap 10 μL、引物1 μL、cDNA模板2 μL、DEPC水7 μL混合后加至八连排,充分离心、振荡、再离心后立即置PCR仪上,进行扩增反应。PCR反应条件:95℃ 30 s (预变性);95℃ 45 s (变性);60℃ 30 s;95℃ 15 s (退火、延伸);60℃ 30 s;95℃ 15 s (溶解)。根据循环数计算样本mRNA 的相对表达量。引物序列见表1。

Table 1. Primer sequence of target gene
表1. 目的基因引物序列
F, forward; R, reverse.
2.4. 统计学方法
细胞及小鼠角膜中有关目的基因结果的实验数据通过x ± s来表示。两组之间的临床评分差异采用 Mann-Whitney U检验。实验数据用x ± s表示,采用单因素方差分析(ANOVA)对三组或三组以上的数据进行比较,并采用未配对双尾t检验对多组数据进行比较。P < 0.05差异具有统计学意义,所有实验进行两次以上以确保实验的可行性和可重复性。
3. 结果
3.1. CS抑制烟曲霉菌诱导的RAW细胞中模式识别受体的表达
使用不同浓度的CS处理组模式识别受体TLR-2,Dectin-1和 LOX-1的mRNA相对表达量无变化,烟曲霉菌菌丝处理组模式识别受体TLR-2,Dectin-1和 LOX-1的mRNA相对表达量升高,烟曲霉菌菌丝处理后使用不同浓度的CS处理组与单纯烟曲霉菌菌丝处理组相比,模式识别受体TLR-2,Dectin-1和 LOX-1的mRNA相对表达量减低,并且降低幅度呈剂量依赖性(图1(A),图1(B),图1(C))。
 注:A-C用不同浓度的CS或PBS处理灭活的烟曲霉菌菌丝刺激的RAW细胞,CS处理组RAW细胞中的模式识别受体TLR-2、Dectin-1、LOX-1的mRNA相对表达相较于PBS处理组降低(n = 6组) (*P < 0.05, **P < 0.01, ***P < 0.001)。
注:A-C用不同浓度的CS或PBS处理灭活的烟曲霉菌菌丝刺激的RAW细胞,CS处理组RAW细胞中的模式识别受体TLR-2、Dectin-1、LOX-1的mRNA相对表达相较于PBS处理组降低(n = 6组) (*P < 0.05, **P < 0.01, ***P < 0.001)。
Figure 1. The mRNA expression of TLR-2、Dectin-1 and LOX-1 in the chondroitin sulfate treatment group and PBS treatment group after stimulation of RAW cells by Aspergillus fumigatus hypha suspension
图1. 烟曲霉菌菌丝刺激RAW细胞后CS处理组与PBS处理组TLR-2、Dectin-1和LOX-1的mRNA表达
3.2. CS抑制小鼠烟曲霉菌性角膜炎中模式识别受体的表达
在烟曲霉菌感染小鼠角膜后的第3天,取各组小鼠角膜进行RT-PCR实验,检测角膜中模式识别受体mRNA相对表达量的变化。结果显示,相对于PBS处理组,CS处理组中模式识别受体TLR-2,Dectin-1和LOX-1的mRNA相对表达量明显降低,差别具有统计学意义(图2(A),图2(B),图2(C))。
 注:A-C烟曲霉菌感染小鼠角膜第3天,与PBS处理组相比,CS处理组角膜中TLR-2、Dectin-1、LOX-1的mRNA表达显著降低(n = 6组) (*P < 0.05, **P < 0.01, ***P < 0.001)。
注:A-C烟曲霉菌感染小鼠角膜第3天,与PBS处理组相比,CS处理组角膜中TLR-2、Dectin-1、LOX-1的mRNA表达显著降低(n = 6组) (*P < 0.05, **P < 0.01, ***P < 0.001)。
Figure 2. The mRNA expression of each group of TLR-2, Dectin-1 and LOX-1 in the cornea of mice with Aspergillus fumigatus keratitis 3 days after infection
图2. 烟曲霉菌性角膜炎小鼠角膜中感染后3天各组TLR-2、Dectin-1和LOX-1的mRNA表达
3.3. CS处理后小鼠烟曲霉菌性角膜炎的临床评分降低
在小鼠烟曲霉菌性角膜炎模型中,CS处理组与PBS处理组相比,小鼠角膜溃疡的面积相对减小,角膜透明度相对增高,并可以减少角膜穿孔率(图3(A))。相对于PBS处理组,CS处理组的临床评分明显降低(图3(B))。提示CS可以缩小溃疡灶,提高角膜透明度,减少角膜穿孔率,降低临床评分,进而对患有烟曲霉菌性角膜炎的角膜起到保护作用。
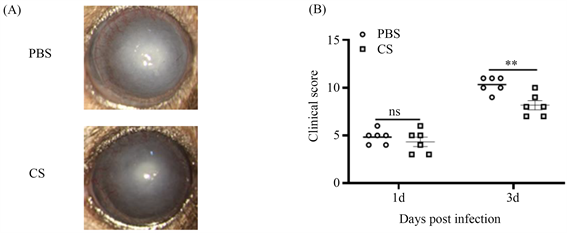 注:A. 在第3天,CS或PBS治疗的小鼠角膜的代表性裂隙灯照片B.在第1天和第3天,用CS或PBS治疗的小鼠烟曲霉性角膜炎的临床评分分析(n = 6组) (*P < 0.05, **P < 0.01, ***P < 0.001)。
注:A. 在第3天,CS或PBS治疗的小鼠角膜的代表性裂隙灯照片B.在第1天和第3天,用CS或PBS治疗的小鼠烟曲霉性角膜炎的临床评分分析(n = 6组) (*P < 0.05, **P < 0.01, ***P < 0.001)。
Figure 3. The clinical scores of CS in the treatment of A. fumigatus keratitis in mice
图3. CS治疗小鼠烟曲霉菌角膜炎的临床表现及临床评分
4. 讨论
真菌性角膜炎是一种严重危害视力的疾病 [15]。曲霉菌,镰刀菌,念珠菌,弯孢菌和青霉菌为常见的致病真菌,其中镰刀菌和曲霉菌感染诱发的真菌性角膜炎最为常见 [27]。目前,由于缺乏有效的抗真菌药物,临床上治疗真菌性角膜炎是非常棘手的问题,渗透性差,生物利用度差以及与全身药物相关的副作用等特点是目前可用的抗真菌药物的缺点,因此与许多其他形式的角膜炎相比,真菌性角膜炎的预后相对较差 [6]。真菌性角膜炎发病过程首先触发先天性免疫,随后有效的适应性免疫便可被激活。真菌与角膜上皮的模式识别受体(PRR)识别。模式识别受体中Toll样受体,C型凝集素受体和LOX-1等可以参与真菌性角膜炎的免疫反应过程 [28] [29] [30] [31]。在小鼠烟曲霉性角膜炎模型中模式识别受体的表达增加明显高于非角膜炎对照组,炎症反应的严重程度也明显高于非角膜炎组,过度的炎症反应会对角膜组织造成损伤,从而影响角膜的透明性,对患者的视力产生严重影响 [32]。而抑制模式识别受体的表达可能会通过抑制炎症反应进而改善真菌性角膜炎的预后,对真菌性角膜炎可能起到治疗性的作用。
CS是从动物(猪,牛,鸡,鲨鱼)的软骨中提取的酸性粘多糖 [33],具有抗炎、免疫调节、抗氧化等多种药理学活性 [18] [19] [21]。其抗炎作用尤为重要,在骨关节炎的治疗中被广泛应用 [24]。研究证实,CS可以抑制大鼠膝关节软骨中OA诱导的前列腺素过氧化物2和转化生长因子-β的表达 [34]。在软骨细胞中,CS通过细胞表面受体介导,降低p38丝裂原活化蛋白激酶和信号调节激酶1/2的磷酸化,从而抑制NF-κB的核易位,减少促炎细胞因子(TNF-α、IL-6)以及促炎酶(磷脂酶A2、环氧合酶2、基质金属蛋白酶-13和一氧化氮合酶2)的释放进而起到抗炎的作用 [35] [36]。我们的研究发现,在烟曲霉菌感染的巨噬细胞中检测到模式识别受体TLR-2、Dectin-1、LOX-1的表达升高可明显被CS下调。我们认为在炎症反应过程中,CS可以抑制巨噬细胞中部分PRR的表达。不仅如此,在我们建立的小鼠烟曲霉菌性角膜炎模型中,同样检测到CS可以下调模式识别受体TLR-2、Dectin-1、LOX-1的表达。并且CS裂隙灯下的炎症评分显示在小鼠烟曲霉菌性角膜炎的模型中,CS治疗组相对于对照组角膜的透明度高,溃疡面积减小,穿孔率低。我们的研究表明CS在小鼠烟曲霉菌性角膜炎中可以减轻炎症反应,起到一定的治疗作用。但是,关于CS在小鼠烟曲霉菌性角膜炎中发挥作用的具体机制目前尚未见报道,我们会针对CS在小鼠烟曲霉菌性角膜炎中抗炎的具体机制进行更加深入的探索,可为今后CS在烟曲霉菌性角膜炎中药物治疗作用的研究奠定基础。
NOTES
*通讯作者。