1. 引言
硝化细菌是一类细菌的总称,它们广泛分布在自然界中的土壤和水源中,是氮循环的重要组成部分。由细菌进行的硝化作用主要分为两个部分,一个是由氨或铵根离子氧化到亚硝酸盐,由Nitrosomonas等属的细菌完成;另一个是由亚硝酸盐氧化到硝酸盐,由Nitrobacter、Nitrospira等属的细菌完成 [1] [2] [3]。此外,也存在可完成这两个反应、有多种硝化产物的细菌,如Alcaligenes属的一些物种。在含有硝化细菌的水体中可能会出现自发形成的反硝化细菌菌群,它们可以通过还原硝化细菌产生的硝酸盐获得能量,终产物大部分为氮气,少部分为铵根离子。硝化细菌在水质净化过程中起重要作用,在水产养殖业中应用广泛,而反硝化菌群可达到防止水体中硝酸盐过多积累的效果,因此均有很大培养价值。目前商品化的“硝化细菌”菌种往往混有多种杂菌(其中部分菌种在生产过程中混入了杂菌;部分菌种因培养基适合异养菌生长而在后期处理过程中混入了杂菌),这可能对其应用产生影响。大部分硝化细菌因不属于含抗性基因的品系而无法用抗生素富集培养,一般的培养基则不能抑制杂菌生长繁殖。
2. 方法
2.1. 硝化细菌与反硝化细菌的培养
未经基因改造的硝化细菌没有抗生素抗性基因,无法通过含抗生素的培养基筛选。本研究利用它能氧化铵根获得能量的特性,利用四种简单的无机盐配制了三组成分配比不同,但都不含有机氮源的培养基(表1)。经查阅资料和前期预实验得知,在其它成分相同情况下,加入适量磷元素有利于硝化细菌生长 [4]。因此,我们也引入了少量的Na2HPO4,每组用量相同。
三组培养基中NaCl和Na2HPO4的用量不变;NH4Cl (氮源及能量来源)和NaHCO3 (碳源)的总质量也不变,二者的比例分别为2:1,1:1和1:2 (见表1)。该配比的变化会导致pH的变化,但三组的pH值均落在适宜硝化细菌生长的区间之内。每组培养基配置了3个培养皿(直径为100 mm),接种材料为市场上常见的硝化细菌混合菌液(样本来自北京广源工艺品市场)。接种后放置于28℃培养箱(斑马鱼饲养最适温度和湿度)中静置培养,3~10日连续观察、记录菌落形态和生长状况。取菌落生长状况较好的一组,按其配比重新配置培养基并接种,进行重复实验。

Table 1. Components ratio of each culture media
表1. 各组培养基的成分配比
2.2. 菌落的测序与定种
长出较密集菌落后,观察菌落形态,用2 mL移液枪枪头小心挑出样本:取大、小菌落各2个得混合样本1;取大菌落4个得样本2;取小菌落4个得样本3。将3份样本分别转移到装有1 mL液体培养基(NH4Cl 1.00 g/100mL, NaHCO3 0.50 g/100mL, Na2HPO4 0.10 g/100mL, NaCl 1.00 g/100mL)的1.5 mL离心管中,在28℃培养箱放置过夜,提取核糖体16S rRNA并进行16S rRNA测序以鉴定菌种。
获得16S rRNA序列后,采用NCBI (National Center for Biotechnology Information)网站上的BLAST (Basic Local Alignment Search Tool, 2.11.0+)工具找出与每个样本特征最接近的前100个16S rRNA序列,应用TreeView X (5.0版本)软件构建系谱树,分析其与已知样本的亲缘关系。
3. 结果
3.1. 菌落生长状况
经过10天的培养,三组培养皿中均长出了菌落。在生长时间相同的条件下,第2组菌落覆盖面积最少,第1组平均覆盖面积比第3组稍多,但差别并不明显。第二次接种培养基及液体培养基采用第1组的配方。
肉眼可见两种形态明显不同的菌落(见图1):一种较大,边缘模糊且不规则,颜色更黯淡,命名为菌落A;另一种较小,边缘清晰且更有光泽,常伴生在菌落A的周围,命名为菌落B (见图2)。样本1的测序结果显示为双峰,表明确实有两种细菌。样本2与样本3均为单峰。3个组的培养皿中均存在菌落A、B且形态相同。
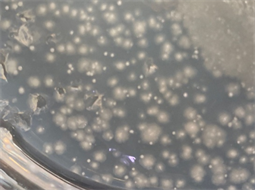
Figure 1. Two different kinds of colonies on the culture medium
图1. 培养基上两种形态不同的菌落
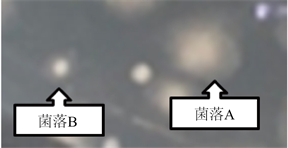
Figure 2. Shapes of Type A and B colonies
图2. 菌落A、B形状示意图
3.2. 序列比对结果及系统发生树构建
16S rRNA BLAST比对结果表明,菌落A属于Alcaligenes faecalis,与其最接近的该种序列相似度为98.87% (见图3、图4);而菌落B属于Dysgonomonas属的一种细菌(比对结果最接近者为95.58%,有明确定种的最接近序列为93.29%,见图5),这种细菌很可能为新种。
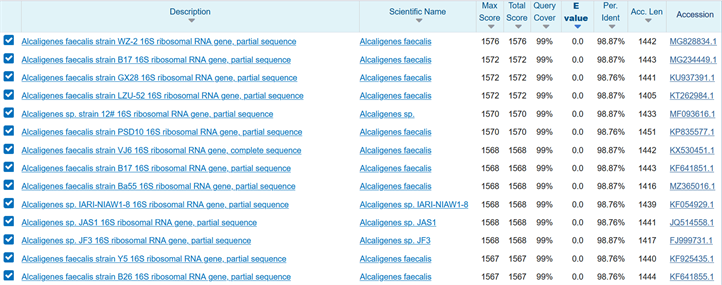
Figure 3. 16S rRNA sequence alignment results of Type A colonies
图3. 菌落A 16S rRNA序列比对结果


Figure 4. Sequence alignment result of Type A colonies and Alcaligenes faecalis
图4. 菌落A与Alcaligenes faecalis的序列比对结果
除序列比对结果外,菌落A也在形态特征上与Alcaligenes faecalis的菌落基本吻合,为较大的白色菌落,且边界较模糊,形状偏离正圆形 [5]。
图中Dysgonomonas oryzarvi序列并不是BLAST结果中最接近样本的序列,但它是与样本最接近的有明确定种的序列。通过构建样本的系统发生树,可确定与新种序列较为接近的已知序列(见图6)。
除Dysgonomonas oryzarvi外,系统发生树上的CFB菌群指由Cytophaga,Fusobacterium和Bacteroides三个属的细菌组成的菌群。它们在系谱上有差异,但在一些DNA序列上显示出相似性。它们都是适应无氧环境的杆状细菌 [6]。其中Bacteroides与Dysgonomonas同属Bacteroidetes门。
Dysgonomonas属的一种细菌Dysgonomonas capnocytophagoides的菌落特征和本实验中的菌落B的
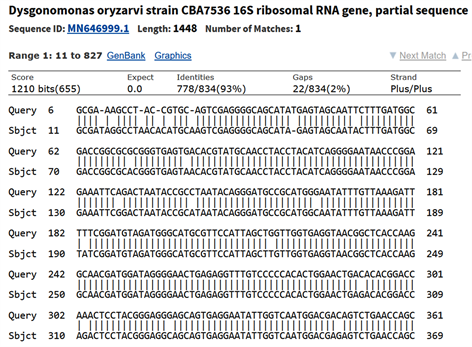

Figure 5. Sequence alignment result of Colony B and Dysgonomonas oryzarvi
图5. 菌落B与Dysgonomonas oryzarvi的序列比对结果

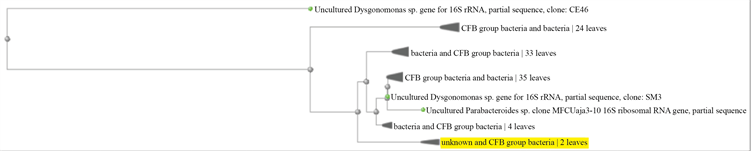
Figure 6. Phylogenetic tree of the Dysgonomonas species constructed respectively with Neighbor Joining and Fast Minimum Evolution
图6. Neighbor Joining和Fast Minimum Evolution两种方法构建的Dysgonomonas系统发生树
特征相似,二者均为较小的灰白色的完整圆形菌落 [7],且进化树上距离样本最远和最近的分支都含Dysgonomonas属的细菌,据此基本可以确定菌落B属于该属。
3.3. 菌种代谢特征分析
Alcaligenes faecalis是一种硝化细菌,可氧化铵根至不同氧化态,产物为亚硝酸根、硝酸根、一氧化氮、一氧化二氮和羟胺等 [8] [9] [10] [11] [12]。相比Nitrosomonas、Nitrosococcus等其他利用铵根的硝化细菌,Alcaligenes faecalis的特殊之处在于在有氧气和铵根存在的情况下,还可以进行反硝化作用,还原亚硝酸根和硝酸根,产生一氧化二氮和少量氮气。反硝化作用往往在开始培养24 h内开始进行;在本实验超过240 h的观察周期内,基本可以肯定有还原产物一氧化二氮和氮气产生 [13] [14]。
Alcaligenes属的另一些细菌也具有这种性质,如Alcaligenes sp. TB可先将铵根氧化为羟胺,再氧化为亚硝酸盐,最后到硝酸盐;也可还原硝酸盐到亚硝酸盐,再到一氧化氮(或一氧化二氮),最后到氮气 [15]。
Dysgonomonas属的细菌是兼性厌氧菌,可寄生在动物体内,代谢淀粉、纤维素等多糖,在污水、腐烂的食物中也有发现。该属没有作为硝化细菌的记录,反而在文献中常出现在还原性菌群里,并与Pseudomonas和Bacillus等反硝化菌并列;该属的一些物种在微生物燃料电池(microbial fuel cell)的菌群中被发现 [16] [17] [18]。
结合其往往生长在Alcaligenes faecalis周围的现象,它在本实验的培养环境下有可能是作为反硝化细菌出现的,直接利用了Alcaligenes faecalis生成的硝化产物(说明Alcaligenes faecalis的反硝化作用并没有将其硝化产物的浓度降到太低的水平)。虽然它也可以通过用氧气氧化分解糖类的方式生存,但培养基并上没有发现其它采用这种能量供给方式的杂菌,说明Alcaligenes faecalis本身产生的糖类并不足以支撑一般的好氧异养菌消费,因此Dysgonomonas采用反硝化作用提供能量的可能性更大。
4. 讨论
4.1. 硝化细菌培养方法的比较
目前已报道了多种硝化细菌培养基配方。除必要的铵根离子外,培养基配方常会采用不同的碳源,包括乙酸钠、碳酸氢钠、琥珀酸盐、二水合柠檬酸钠等。此外,它们往往会包含不同的金属盐,如镁盐、锰盐、铜盐、铁盐等。
例如一个模拟废水的配方包括:氮元素1 g/L,以(NH4)2SO4的形式添加;磷元素0.07 g/L,以KH2PO4的形式添加;NaHCO3 3 g/L;微量元素混合溶液2 mL/L。微量元素混合溶液包含:EDTA,5.0 g/L;ZnSO4∙7H2O,2.2 /L;CoCl2·6H2O,1.6 g;MnCl2∙4H2O,5.1 g;CuSO4∙5H2O,1.6 g;(NH4)6Mo7O24∙4H2O,1.1 g;CaCl2∙2H2O,5.5 g;FeSO4∙7H2O,5.0 g。pH约为7.9 [19]。另一个富集硝化细菌的配方含有相同的元素,但其含量不同 [20]。
一个用于富集一种Nitrospira属的细菌的培养基配方包括:NH4Cl,0.5 mM/L;KH2PO4,50 mg/L;KCl,75 mg/L;MgSO4∙7H2O,50 mg/L;NaCl,584 mg/L;CaCO3,4 g/L (微溶);TES (specific trace element solution),1 mL/L;SWS (selenium-wolfram solution),1 mL/L。TES包含:MnSO4∙H2O,34.4 mg/L;H3BO3,50 mg/L;ZnCl2,70 mg/L;Na2MoO4∙2H2O,72.6 mg/L;CuCl2∙2H2O,20 mg/L;NiCl2∙6H2O,24 mg/L;CoCl2∙6H2O,80 mg/L;FeSO4∙7H2O,1 g/L。SWS包含:NaOH,0.5 g/L;Na2SeO3∙5H2O,3 mg/L;Na2WO4∙2H2O,4 mg。富集过程中,CaCO3缓冲系统使得pH保持在7.8左右 [21]。
一个简单的Alcaligenes faecalis培养基包括:柠檬酸钠9.5 × 10−3 mol/L,NH4Cl 9.35 × 10−3 mol/L,KH2PO4 1.47 × 10−3 mol/L,MgSO4∙7H2O 1.62 × 10−4 mol/L,CaCl2∙2H2O 1.36 × 10−7 mol/L,FeSO4∙7H2O (EDTA合) 3.6 × 10−5 mol/L,pH由碳酸钠或氢氧化钠调至6.5 [12]。
一个由PYGV培养基改进、培养纯净的Dysgonomonas oryzarvi sp. nov.的培养基包括:每升中K2HPO4 0.45 g,KH2PO4 0.45 g,NH4Cl 0.36 g,MgCl2∙6H2O 0.075 g,CaCl2∙2H2O 0.09 g,NaCl 0.9 g,BBL 1 g,酵母提取物0.5 g,葡萄糖1 g,L-半胱氨酸-HCl∙H2O 0.3 g,8% (w/v) Na2CO3 2.5 mL,维生素混合物2 mL,pH为7.3 [18] [22]。由于Dysgonomonas属的物种不能氧化铵盐获得能量,其单独培养的培养基中应包含有机碳源和氮源。
相比之下,本论文的配方仅保留了必要的碳源和氮源,以及调节渗透压的氯化钠,并添加了少量促进生长的磷酸氢盐。所有的成分(除琼脂糖)都是简单易得的无机物。本论文的3组培养基中,第2组生长状况最差,而第1组和第3组的生长状况更为接近,其中的原因尚不清楚,可能与培养基的pH值或代谢中消耗的碳氮比例有关。然而如果主要影响因素为pH值,三组的菌落覆盖面积应为递增或递减或中间高两边低的状况。
4.2. 群落状况分析
硝化细菌和反硝化细菌出现在同一菌群中的现象并不罕见,并且目前已有Alcaligenes属和Dysgonomonas属细菌出现在同一群落中的报道。在被汽油污染的土壤中,生长出了可利用其中碳氢化合物的菌群,其中包括这两个属的细菌 [23]。在甘蔗生成的酒糟中,也发现了包括Alcaligenes属和Dysgonomonas属细菌在内的菌群 [24]。已有多篇将硝化细菌和反硝化细菌共同培养的报道;其目的是在移除水体中铵根的同时不使硝酸盐含量增加 [25] [26]。然而在本研究进行过程中,未找到仅将Alcaligenes属和Dysgonomonas属细菌共同培养的报道。
目前未能查明混合菌液中是否含有其它种类的反硝化细菌。若有,则可能由于其环境最适合Dysgonomonas生长,导致其在竞争中完全压过了其它反硝化菌。我们将在后续实验中调整培养基的成分配比及培养温度,探究是否会有其它反硝化菌落长出。
5. 结论
本项目通过16S rRNA 测序和进化树构建,为不含有机氮源的选择培养基中分离出的两种菌落进行了定种。其一为硝化细菌Alcaligenes faecalis;其伴生菌落为兼性厌氧菌Dysgonomonas属的新种,通过反硝化代谢获得能量。该实验结果对水产养殖相关菌群的进一步分析和利用具有一定意义。