摘要: 费城染色体阳性急性髓系白血病(Ph+AML)是一种罕见的AML亚型,2016年修订的世界卫生组织(WTO)髓系恶性肿瘤将其归类为预后不良伴有遗传学异常的AML暂定型。Ph+AML是有别于慢性髓系白血病的一组高度复杂的异质性疾病,对化疗反应差,易复发,预后不佳,具有独特的临床和血液学特点。
Abstract:
Philadelphia chromosome-positive acute myeloid leukemia (Ph+AML), as a rare subtype of AML, is classified as provisional AML of poor prognosis accompanied with genetic abnormalities according to the 2016 revision of World Health Organization (WTO)-defined myeloid malignancy. Ph+AML is a group of highly complex heterogeneous diseases different from chronic myeloid leukemia (CML) with poor response to chemotherapy. It is characterized by easy recurrence, poor prognosis, and unique clinical and hematological features.
1. 引言
费城染色体(Ph染色体)是9号和22号染色体长臂的相互易位,称为t(9;22) (q34;q11),是慢性髓细胞白血病(CML)的标志,在急性淋巴细胞白血病和混合表型急性白血病患者中也很常见。在急性髓系白血病(AML)中,Ph染色体的发生率为0.5%~3% [1]。Ph染色体阳性AML (Ph+AML)患者预后极差,常规化疗多不能达到完全缓解或极易复发,中位生存期仅9个月 [2]。Ph+AML发病率低,国内外报道病例少。本文报道1例两次诱导化疗未缓解的原发耐药急性髓系白血病伴Ph染色体阳性,患者家属对此知情同意。
2. 病例资料
患者,男性,49岁,因“发热3天”入院,既往体健,入院查体:体温37.2℃,脉搏84次/分,呼吸21次/分,血压123/62 mmHg。急性病容,睑结膜苍白,巩膜无黄染,胸骨无压痛,全身浅表淋巴结未触及肿大,双肺呼吸音清,未闻及干湿性啰音,心腹查体无特殊,肝脾无肿大,双下肢无水肿。患者3天前无明显诱因出血发热、乏力,体温最高38.7℃,伴畏寒、寒战,伴下肢酸痛,就诊于我院急诊,血常规提示:WBC 37.43*109/L (参考值3.5~9.5*109/L),NEU 20.25*109/L (参考值1.8~6.3*109/L),RBC 2.34*1012/L (4.3~5.8*1012/L),HGB 73 g/L (参考值130~175 g/L),PLT 38*109/L (参考值125~350*109/L);C-反应蛋白46.46 g/L (参考值0~5 g/L)。消化系统超声未见肝脾肿大。骨髓细胞形态学提示:骨髓中可见原始细胞约53%,极少部分原始细胞POX弱阳性。血片:原始细胞比例约33%。流式:骨髓中约18.8%异常髓系原始细胞;免疫分型:CD34+、CD13+、CD117+、CD33+、CD38+、MPOdim、HLA-DR-;染色体:46,XY,t (9;22) (q34;q11.2) (4)/46,XY(11)。细胞遗传学与分子生物学:融合基因BCR-ABL P190阳性,阳性率3.47%;FLT3-ITD,NPM1,C-kit/D816,CEBPA,PML-RARa,MLL和CBFb/MYH11均为阴性。骨髓活检:部分区域纤维组织增生,部分区域增生较活跃(>90%),幼稚阶段细胞增多,粒系各阶段细胞可见,以中幼及以下阶段细胞为主,红系各阶段细胞可见,以中晚幼红细胞为主,形态学可识别的巨核细胞少见,少量淋巴细胞散在分布,纤维组织增生,网状纤维染色,MF-2级(见图1)。诊断为急性髓系白血病伴t(9;22)阳性间隔感染性发热。排除化疗禁忌后,于2020年9月24日起给予IA方案化疗,具体用药:盐酸阿糖胞苷100 mg,d1-5,盐酸伊达比星10 mg,d1-3。2020年10月18日复查骨髓常规:1) 骨髓增生明显活跃。2) 在计数的细胞内未见粒细胞及有核红细胞。3) 淋巴细胞比例约占4.0%。4) 髓系原始细胞比例约占95.5%。5) 破碎细胞易见。6) 全片共找到2个颗粒型巨核细胞,血小板少见。血片:片中可见约94%的髓系原始细胞,诊断AML未缓解。2020年10月18日再次给予HAE方案化疗,具体用药:盐酸阿糖胞苷200 mg,d1-7,高三尖酯碱3 mg,d1-7,依托泊苷0.1 g,d1-5。2020年11月10日复查骨髓穿刺提示AML未缓解,血常规提示:WBC 56.20*109/L,RBC 1.89*1012/L,HGB 56 g/L,PLT 71*109/L。综上诊断为原发耐药型AML合并Ph染色体阳性,家属拒绝进一步治疗,给予小剂量阿糖胞苷姑息性降白细胞,至当地医院姑息治疗,于2021年1月16日死亡,总生存期4月。
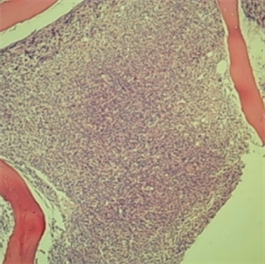 (a)
(a)  (b)
(b)
Figure 1. Initial bone marrow biopsy
图1. 初诊骨髓活检
3. 讨论
Ph染色体在慢性髓系白血病患者中阳性率大于95%,在急性淋巴细胞白血病及急性髓系白血病中阳性率前者17%~25%,后者0.9%~3% [3]。2016年世界卫生组织(WHO)分型将Ph+AML归为预后不良伴有遗传学异常的AML暂定型,被认为是一种罕见高危白血病,它原发于AML,此类患者没有任何证据提示曾经患有CML [4]。其发病率低,国内外多为个案报道,缺乏大样本报道,没有系统的预后数据。
Ph+AML首先需与CML急变期进行鉴别,无明显肝脾肿大,无CML慢性期病史,无CML急变期骨髓特征,CML最常见的异常染色体为8号染色体三体、der (9)和17q等色体,这些染色体畸变在Ph+AML中不太常见 [5] [6]。CML的一个非常重要的标志是伴随的嗜碱性粒细胞比例>2%。然而,在本例Ph+AML中,外周血检查显示白细胞中嗜碱性粒细胞的比率为0,低水平的嗜碱性粒细胞更有利于支持Ph+AML的诊断。部分Ph+AML是由Ph阴性或Ph阳性的骨髓增生异常综合征(MDS)、骨髓增值性肿瘤(MPN)转化而来的,其典型的骨髓异常造血及外周血特征可与CML鉴别 [7] [8]。
本例Ph+AML疾病进展迅速,分别给予IA及HAE方案进行诱导化疗,均未缓解,提示为原发耐药型,且患者合并BCR/ABL P190融合基因阳性、Ph染色体阳性,为AML罕见类型,具有独特的临床和血液学特点,临床疗效和预后极差。BCR/ABL融合蛋白可扰乱下游信号通路,导致肿瘤细胞增殖增强、分化停滞和细胞死亡抵抗,这可能是这种特殊类型AML预后差,进展迅速的原因。因此及早使原发病达到缓解,尽快行异基因造血干细胞移植对延长病人生存期十分重要。尽管Ph+AML的BCR/ABL融合基因的类型不尽相同,但产物都有酪氨酸激酶的活性,酪氨酸酶抑制剂(TKIs)可使蛋白质上的酪氨酸残基磷酸化,抑制细胞的增殖。有研究证明,应用TKIs治疗,可使得Ph阳性急性淋巴细胞白血病获得17%细胞遗传学和29%血液学缓解,中位进展时间为2.2个月 [9] [10]。TKIs是CML最成功的分子靶向治疗,但很少Ph+AML患者受益于TKIs治疗 [11],Neuendorff等人 [12] 提出,使用TKIs治疗Ph+AML可获得血液血反应,但维持时间短,易复发,可能不足以控制疾病的进展,因此他们认为TKIs不能作为Ph+AML的一线治疗。Ph+AML的最佳治疗方法尚未确定。然而,TKIs作为抢救治疗的一部分是一种合理的方法。有文献报道7例Ph+AML患者应用格列卫联合化疗治疗,完全缓解(CR)率为58%,CR后给予化疗或尽快行异基因造血干细胞移植,中位生存时间为24个月,效果明显优于单用化疗或TKIs治疗的患者 [13] [14] [15]。遗憾的是本例患者仅接受2次化疗诱导,均未缓解,未进行TKIs联合化疗或其他新药治疗。由此我们得出经验,初诊或复查难治AML患者应进行BCR/ABL基因筛查,个体化治疗,Ph+AML患者可应用TKIs联合化疗,或Bcl-2抑制剂Venetoclax联合化疗治疗 [16],在获得完全缓解后尽快给予异基因造血干细胞移植,延长患者生存期。
总之,Ph+AML是一类预后较差的白血病,不同于CML急变期,化疗联合TKIs或Bcl-2抑制剂可使患者获得CR,但其维持时间短,易复发,获得CR后序贯异基因造血干细胞移植可提高疗效,改善预后。
参考文献
NOTES
*通讯作者。