1. 引言
多晶型现象,普遍地存在于固体化合物中,在药物中尤为突出 [1]。晶体结构的不同会导致产品理化性质上的差异,主要表现在溶解度、熔点、稳定性、溶出度以及生物利用度等方面。晶型的差异会直接影响制剂的工艺以及剂型。 [2] 美国雅培公司开发的用于治疗HIV的药物利托那韦,存在两种晶型 [3] [4],晶型I稳定,无效,晶型II不稳定,但有效,晶型II在长期储存过程中会转化为稳定但无效的晶型,给雅培公司造成2亿美元的损失,该药物被迫下市。
甘氨酸是结构简单,晶型种类较多的一种氨基酸,常用为研究多晶型的模型药物 [5]。目前报道的晶型有6种 [6],其中γ-晶型是常温常压下热力学最稳定晶型 [7]。Fischer等 [8] 在1905年发现了甘氨酸存在多晶型现象,以此为契机,发现了α-型,γ-晶型于1954年由Iitaka [9] 发现。Murli等 [10] 研究发现将α-晶型加压至23 GPa,发现了δ-晶型,而Dawaon和Goryainov [11] 发现β-晶型只要0.8 GPa的压力下就会转化为δ-晶型。Boldyreva [12] 和Dawson [13] 研究发现,对常温常压下稳定的γ-晶型施与一定的压力,最终会转化为ε-晶型。Xu等 [14] 研究发现,将甘氨酸水溶液置于液氮中淬火冻结,会形成玻璃相,对此玻璃相加热至209 K,发现了甘氨酸的第六种晶型。
甘氨酸各晶型之间能够相互转化,介稳晶型α-晶型和β-晶型均可以转化为稳定晶型γ-晶型 [15] [16],研究发现高温 [7] [13]、高压有利于甘氨酸介稳晶型的转化,外加物理场如超声波 [17]、激光 [18] 等对甘氨酸的转晶过程也有着一定的促进作用。目前市场上甘氨酸主要以亚稳晶型α-晶型为主而且掺杂γ-晶型,产品性质不稳定,容易结块,因此对产品理化性质以及储存带来问题。因此常温常压状态下甘氨酸各晶型之间的转化显得尤为重要。
本文从介稳晶型α-晶型定向转化为γ-晶型的问题出发,一方面考察湿度对甘氨酸各晶型之间的固–固转化,另一方面考察溶剂、添加剂等溶液环境对晶型转化的影响。主要考察了0~94% RH湿度对转化的影响,另外研究了pH、添加剂以及不同溶剂对α-晶型定向转化为γ-晶型的转化效果的影响。
2. 实验与方法
2.1. 单晶培养
方法一:环境室温10℃,配制甘氨酸饱和水溶液(纯度 ≥98%,阿拉丁),室温下静置缓慢蒸发,经过3 d,可自发成核生成小的单晶颗粒,再过7 d左右的时间,小颗粒又继续生长后,取出测样。
方法二:在饱和甘氨酸水溶液中加入氨水,用pH计测定溶液的pH = 8.0,调节恒温水浴锅为30℃,将饱和溶液置于水浴锅中,开启搅拌,使溶液充分混合,取上层清液于安剖瓶中,静置于室温为10℃的环境下,7 d后,发现有晶体析出。
2.2. 湿度对晶型转化的影响
称取一定量α-晶型甘氨酸产品置于扁平称量瓶中,配置室温下K2CO3 (AR,≥99.5%,国药集团),NaBr (AR,≥99.5%,国药集团),NaCl (AR,≥99.5%,国药集团),KBr (AR,≥99.5%,国药集团)的饱和盐溶液,置于玻璃干燥器中,另外准备干燥的P2O5置于干燥器中,将称取的α-晶型甘氨酸置于不同湿度环境中,称量其质量的变化,并对最终的α-晶型甘氨酸进行表征。
2.3. 添加剂对晶型转化的影响
称取一定量的α-晶型甘氨酸产品至水溶液中,调节水浴锅到40℃,配置成饱和溶液,在饱和溶液中加入一定0.5 g Nacl (AR,≥99.5%,国药集团),Na2CO3 (AR,≥99.5%,国药集团),NaNO3 (AR,≥99.5%,国药集团),KCl (AR,≥99.5%,国药集团),CaCl2 (AR,≥99.5%,国药集团),MgCl2 (AR,≥99.5%,国药集团),所有溶液在水浴锅中保持40℃左右并持续搅拌3天,结束搅拌后用真空泵减压抽滤,常温干燥。
2.4. 溶剂种类对晶型转化的影响
称取一定量的α-晶型甘氨酸产品,调节水浴锅到40℃,配置成乙醇(AR,≥95%,国药集团)、氯仿(AR,≥99%,国药集团)溶剂下饱和溶液,由于甘氨酸难溶于乙醇、氯仿,因此会有很多固体并没有溶解。水浴锅中保持40℃左右并持续搅拌3天,结束搅拌后用真空泵减压抽滤,常温干燥。
称取定量的α-晶型甘氨酸产品至水溶液中,调节水浴锅到40℃,配置成饱和溶液,在饱和溶液中加入0.1 mol/L的NaOH (AR,≥96%,国药集团),NH3∙H2O (AR,26%~28%,国药集团)或者HCl (AR,36%~38%,国药集团),HAc (AR,≥99.5%,国药集团)到一定的pH值来碱化或酸化水溶液,水浴锅中保持40℃左右并持续搅拌3天,结束搅拌后用真空泵减压抽滤,常温干燥。
3. 结果与讨论
3.1. 单晶培养结果
对方法一和方法二所培养的单晶进行粉末衍射,得到的结果分别如图1所示。根据文献报道,甘氨酸有六种多晶型 [19],研究发现,方法一培养出的单晶属于α-晶型,特征峰主要在30˚,方法二培养出的单晶属于γ-晶型,特征峰主要在25˚。
3.2. 湿度对晶型转化的影响
配置的不同饱和溶液在室温15℃下的相对湿度如表1所示。在干燥环境下α-晶型的甘氨酸转化后的结果如图2所示,特征衍射峰并未发生变化,配置的不同饱和溶液在室温15℃下的相对湿度如表1所示。在干燥环境下α-晶型的甘氨酸转化后的结果如图2所示,特征衍射峰并未发生变化,
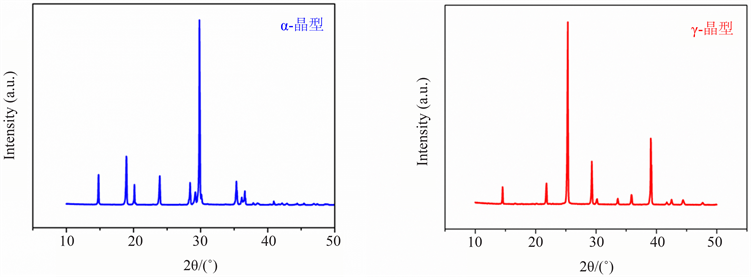
Figure 1. XRD Powder of α-form and γ-form
图1. α-晶型和γ-晶型XRD粉末衍射图

Table 1. Relative humidity of different kinds of saturated solutions
表1. 不同种类的饱和溶液的相对湿度

Figure 2. XRD Powder of α-form with the humidity of 0%
图2. α-晶型在相对湿度为0%的环境中的粉末衍射图
其他湿度条件下转化的结果如图3所示,单晶实验发现,α-晶型的特征衍射峰在30˚,γ-晶型的特征衍射峰在25˚,从图3可以看出,在RH = 45%饱和K2CO3溶液中,α-晶型并没有发生转化,随着湿度的不断增高,α-晶型转化的趋势比较明显,比对标准图谱,在一定的湿度条件下,α-晶型都存在定向转化为γ-晶型的趋势。随着湿度的增加,γ-晶型的特征峰越来越明显,而且强度越来越高。在RH = 93%的环境湿度下,甘氨酸晶体大部分转化成γ-晶型,而在NaCl和NaBr饱和溶液得出相对湿度高的NaCl的饱和溶液的环境中,大多数的α-甘氨酸晶转变为γ-晶型,而相对湿度较低的NaBr饱和溶液中,少部分的α-晶型已经转化为γ-晶型。实验过程中,最终产品的显微镜片,如图4所示,从图中可以看出,颗粒细小的是原料α-晶型,而出现大颗粒晶体的则是转化后的γ-晶型,在环境湿度达到晶型湿度转化的临界相对湿度时,相对湿度越高,越容易发生转化,并不断从α-晶型转化到γ-晶型,并伴随着结块现象。

Figure 3. XRD after transformation under different humidity conditions
图3. 不同湿度条件下晶型转化后的粉末衍射图谱

Figure 4. Picture of α-form transformation in NaBr (a)和BaCl (b)saturated solution
图4. α-甘氨酸在NaBr (a)和BaCl (b)饱和溶液转化的晶体图
3.3. 添加剂对晶型转化的影响
α-晶型转化的最终结果如表2所示,从表中可以得出,阴离子对多晶型结晶没有明显影响,而主要是阳离子起作用。镁离子,钙离子这两个阳离子对α-晶型没有抑制作用,而钠离子和钾离子会对α-晶型生长有强烈阻碍作用,从而会结晶出γ-晶型。说明钠离子和钾离子与α-甘氨酸有特殊的相互作用,在一定钠离子和钾离子浓度下就会抑制α-晶型甘氨酸结晶生长。

Table 2. The influence of different additives of transformation results
表2. 不同添加剂对晶型转化的影响
甘氨酸在醇和氯仿溶液的中转化的结果如表3所示,从表中可以看出,在乙醇和氯仿溶液中,未出现晶型的转变,说明中性溶剂不影响甘氨酸的解离,不会促进晶型转化。而在酸性或碱性溶液中,均能够转化为γ-晶型甘氨酸,其原因在于甘氨酸是两性化合物,酸化过程会使甘氨酸解离成
,降低了甘氨酸中-COO−显碱性的离子浓度,同理碱化过程会使解离成-COO−,则会降低甘氨酸中
显酸性的离子浓度,从而抑制了α-晶型的生长,在这种情况下,对于γ-晶型的生长环境就相对较好,因而能正常生长,随着两性离子浓度不断降低,γ-晶型就会不断生长。

Table 3. The influence of different solvents on the transformation of α-form glycine
表3. 不同溶剂种类对α-晶型甘氨酸晶型转化的影响
4. 结论
本文在甘氨酸水溶液和氨水中培养的单晶为α-晶型和γ-晶型。本文研究了湿度、盐类添加剂、溶剂种类对α-晶型定向转化为γ-晶型的影响,研究发现湿度越大越有利于α-晶型的转化,存在一个临界转化湿度,当环境湿度小于临界转化湿度,α-晶型晶型不转化,而大于临界转化湿度时,α-晶型则会定向转化为γ-晶型。研究结果表明,+1价金属离子有利于α-晶型的转化,在一定条件下均能转化为γ-晶型,阴离子和+2价金属离子均不会促进α-晶型的转化。另外研究发现,中性溶液有利于α-晶型的存在,而在一定浓度的酸性或碱性溶液下,α-晶型也能定向转化为γ-晶型。
基金项目
国家自然科学青年基金(21908114)南通市科技厅项目(J20181123)。
NOTES
*通讯作者。