摘要: 目的:探讨乐胃饮加味方对人胃癌NCI-N87细胞的作用机制。方法:采用不同浓度乐胃饮加味方处理NCI-N87细胞,透射电镜检测细胞超微结构改变,qRT-PCR检测自噬相关基因Beclin1、p62、凋亡相关基因Caspaese-3及PI3K、AKT和mTOR mRNA表达。结果:与对照组比较,乐胃饮加味方组细胞生长状态不良,胞内出现大量自噬小体,Beclin1 mRNA表达升高,p62 mRNA表达下降,Caspaese-3 mRNA表达增加,PI3K、AKT和mTOR mRNA表达均下降。结论:乐胃饮加味方可能通过抑制PI3K/AKT/mTOR信号通路促进自噬,诱导肿瘤细胞凋亡,从而抑制胃癌发展。
Abstract:
Objective: To investigate the mechanism of modified Leweiyin on human gastric cancer NCI-N87 cells. Methods: NCI-N87 cells were treated with different concentrations of modified Leweyin. The ultrastructural changes were detected by transmission electron microscope, and the mRNA expressions of autophagy related genes Beclin1, p62, apoptosis related gene Caspase-3, PI3K, Akt and mTOR were detected by qRT-PCR. Results: Compared with the control group, the cells in the modified Lewiyin group had poor growth status, a large number of autophagy bodies appeared in the cells, the expression of Beclin1 mRNA increased, the expression of p62 mRNA decreased, the expression of caspase-3 mRNA increased, and the expression of PI3K, AKT and mTOR mRNA decreased. Conclusion: Modified Leweyin may promote autophagy and induce apoptosis by inhibiting PI3K/AKT/mTOR signal pathway, so as to inhibit the development of gastric cancer.
1. 引言
胃癌是一种常见的消化道恶性肿瘤,发病率和死亡率逐年上升。其发病机制复杂,呈现多因素、多阶段、多步骤的特点 [1]。尽管手术、化疗、放疗等传统治疗方法是临床主要疗法,但仍存在副作用大、易于复发等问题。研究证实,中医药在防治胃癌发生、控制复发转移等方面具有确切疗效 [2]。乐胃饮加味方是老中医临床经验方,对胃癌的防治具有较好疗效 [3]。自噬(autophagy)是一种II型程序性细胞死亡,过度自噬导致肿瘤细胞损伤,诱导细胞凋亡,是控制肿瘤发生发展的重要机制之一 [4]。磷脂酰肌醇3-激酶(Phosphoinositide 3-kinase, PI3K)/蛋白激酶B (protein kinase B, PKB/AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路在自噬调控中发挥重要作用 [5]。本研究以人胃癌细胞株NCI-N87细胞为研究对象,探讨乐胃饮加味方调控自噬对胃癌细胞的影响。
2. 材料与方法
2.1. 细胞株与试剂
人胃癌NCI-N87细胞株购自中国科学院上海细胞生物学研究所;胎牛血清和RPMI-1640培养基均购自Gibco公司;总RNA快速提取试剂盒购自百泰克生物技术有限公司;HiFiScript gDNA Removal cDNA Synthesis Kit和UltraSYBR Mixture (Low Rox)购自北京康为世纪生物科技有限公司;PCR引物由生工生物工程(上海)股份有限公司合成。乐胃饮加味方(淮山药30 g、薏苡仁30 g、炒白术15 g、炒白芍15 g、郁金15 g、香茶菜15 g)加入10倍量水,煎煮30 min,第二次加5倍量水,煎煮30 min,合并2次煎液,过滤,浓缩后用80%乙醇沉淀24 h,旋转蒸发去除乙醇后,双蒸水调至10 g/ml,备用。
2.2. 仪器
PCR仪(Roche 480) (美国Roche公司);倒置光学显微镜(德国ZEISS公司);超薄切片机(徕卡EM UC7) (德国徕卡公司);透射电子显微镜(Hitachi H-7650) (日本日立公司);离心机(5417R) (德国eppendorf公司)。
2.3. 细胞培养
NCI-N87细胞培养于RPMI-1640培养基(含10%胎牛血清),置于37℃,5%CO2的培养箱中传代培养,每隔3天换液1次,取对数生长期细胞进行实验。
2.4. 药物干预及细胞形态学观察
取对数生长期细胞分为①对照组;②中药低剂量组;③中药高剂量组。对照组不干预,中药低、高剂量组分别以乐胃饮加味方100 mg/ml、200 mg/ml终浓度给药,24 h后在倒置显微镜下观察细胞形态。
2.5. 细胞超微结构观察
给药24 h后,0.25%胰酶消化,收集细胞,1000 rpm离心5 min,加入2.5%戊二醛固定,漂洗三次,1%锇酸固定,漂洗三次,50%、70%、80%、90%、95%、100%乙醇梯度脱水,丙酮置换,不同比例包埋剂–丙酮浸透,纯包埋剂浸透过夜,70℃加热聚合24 h后,修块、超薄切片,醋酸双氧铀/柠檬酸铅双染色后置于透射电子显微镜观察细胞超微结构。
2.6. qRT-PCR检测Beclin1、p62、Caspase-3、PI3K、AKT和mTOR的基因表达
药物处理24 h后,收集细胞,利用总RNA快速提取试剂盒提取总RNA,检测RNA浓度,置−80℃冰箱保存。采用HiFiScript gDNA Removal cDNA Synthesis Kit试剂盒将RNA逆转录成cDNA。使用UltraSYBR Mixture (Low Rox)试剂盒制备PCR反应体系,荧光定量PCR仪检测Beclin1、p62、Caspase-3、PI3K、AKT、mTOR基因表达。real time PCR反应体系(总体积20 μL):上游引物1 μL,下游引物1μL,SYBR premix (2x) 10 μL,模板cDNA 1 μL,ddH2O 7μL。PCR反应条件:95℃预变性10 min;95℃,10 s,退火60℃,30 s,延伸72℃,32 s,共45个循环;95℃,10 s,65℃,30 s。以β-Actin作为内参,用2−ΔΔCT法分析目的基因的相对表达量。(如表1)
2.7. 统计分析
采用SPSS16.0统计软件统计,计数资料均采用均值±标准差(
)来表示,进行多样本均数间比较的单因素方差分析,方差齐时,采用LSD法,方差不齐时,采用Dunnett’s T3,P < 0.05被认为具有统计学意义。
3. 结果
3.1. 乐胃饮加味方对细胞形态的影响
未经干预的胃癌细胞生长状态良好,乐胃饮加味方干预后,细胞间隙变大,出现空泡等生长不良情况(如图1)。
 对照组 中药低剂量组中药高剂量组
对照组 中药低剂量组中药高剂量组
Figure 1. Cell growth in each group (10×)
图1. 各组细胞生长情况(10×)
3.2. 乐胃饮加味方对细胞超微结构的影响
如图2所示,对照组细胞结构完整,核质比正常,线粒体呈椭圆形,数量较多,内质网丰富,可见较多微绒毛和细胞突起。与对照组比较,乐胃饮加味方高剂量组细胞线粒体数量减少,部分线粒体嵴断裂、水肿,空泡化;溶酶体增加,并出现较多自噬小体(箭头所示);细胞微绒毛和突起明显减少。乐胃饮加味方低剂量组细胞超微结构介于对照组和高剂量组之间。
 对照组 中药低剂量组中药高剂量组
对照组 中药低剂量组中药高剂量组
Figure 2. Ultrastructure of cells in each group (15 k)
图2. 各组细胞超微结构(15 k)
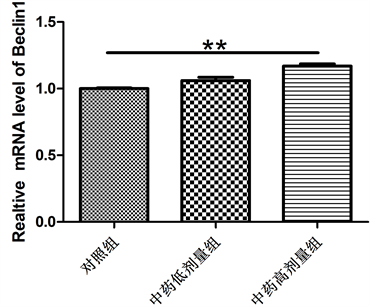
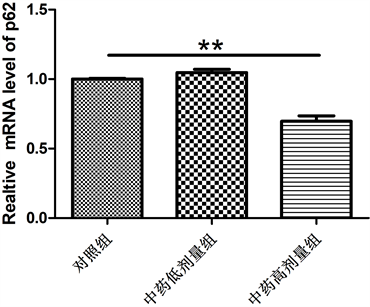
3.3. 乐胃饮加味方对Beclin1、p62表达的影响
如图3所示,与对照组比较,乐胃饮加味方高剂量组Beclin1 mRNA表达增加,p62 mRNA表达降低,差异均具有显著性意义(P < 0.01)。乐胃饮加味方低剂量组Beclin1 mRNA和p62 mRNA表达与对照组差异无显著性意义(P > 0.05)。
 注:与对照组比较,**P < 0.01
注:与对照组比较,**P < 0.01
Figure 3. mRAN expression of Beclin1 and p62 in each group
图3. 各组Beclin1、p62 mRAN表达
3.4. 乐胃饮加味方对Caspase-3基因表达的影响
如图4所示,与对照组比较,乐胃饮加味方高剂量组Caspase-3 mRNA表达增加,差异具有显著性意义(P < 0.01)。乐胃饮加味方低剂量组Caspase-3 mRNA表达与对照组差异无显著性意义(P > 0.05)。
 注:与对照组比较,**P < 0.01
注:与对照组比较,**P < 0.01
Figure 4. mRAN expression of Caspase-3 in each group
图4. 各组Caspase-3 mRAN表达
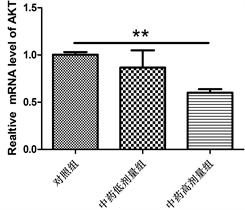
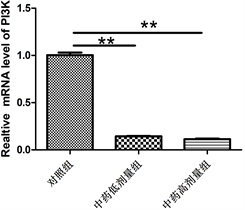
3.5. 乐胃饮加味方对PI3K、AKT、mTOR基因表达的影响
如图5所示,与对照组比较,乐胃饮加味方低剂量组PI3K、mTOR mRNA表达下降,差异具有显著性意义(P < 0.01)。乐胃饮加味方高剂量组PI3K、AKT和mTOR mRNA均较对照组显著下降(P < 0.01)。

 注:与对照组比较,**P < 0.01
注:与对照组比较,**P < 0.01
Figure 5. mRAN expression of PI3K, AKT and mTOR in each group
图5. 各组PI3K、AKT、mTOR mRAN表达
4. 讨论
自噬是一种细胞自我消化过程,在饥饿、缺氧等条件下,胞质内大量自噬溶酶体包裹并降解受损的细胞器和蛋白质,以维持细胞内环境的稳定。然而,过度提升的自噬流促进细胞凋亡 [6]。Beclin1和p62是重要的自噬调控基因,自噬发生时,p62表达下降而Beclin1表达上升 [7]。研究发现Beclin1高表达可以抑制胃癌细胞的生长 [8]。PI3K/AKT/mTOR信号通路是自噬负调控经典途径,同时具有促进肿瘤细胞增殖、拮抗细胞凋亡等作用,在肿瘤的生成、发展和复发转移中发挥重要调控作用 [9]。因此,该信号通路中的靶点抑制剂是抗肿瘤药物研究的热点。
乐胃饮加味方由淮山药、薏苡仁、炒白术、炒白芍、郁金、香茶菜组成,全方健脾化湿柔肝、清热解毒祛瘀,标本兼治,发挥固本清源的作用。实验研究表明,乐胃饮加味方改善胃癌前病变大鼠胃黏膜萎缩、肠化等病理状态,降低IL-6、IL-1β、TNF-α等炎症因子,阻断胃炎向胃癌发展,具有预防胃癌发生的功效 [10]。本研究表明,乐胃饮加味方还能抑制胃癌NCI-N87细胞增殖。超微结构检测发现乐胃饮加味方能促进自噬小体增加,qRT-PCR检测发现乐胃饮加味方能调控自噬调控基因Beclin1表达增加,p62表达下降,表明乐胃饮加味方促进肿瘤细胞自噬发生。经乐胃饮干预后,凋亡相关基因Caspase-3明显增加,表明本方能促进细胞凋亡。同时,乐胃饮加味方还能降低PI3K/AKT/mTOR信号通路中PI3K、AKT和mTOR的表达。综上所述,乐胃饮加味方可能通过抑制PI3K/AKT/mTOR信号通路促进自噬,诱导肿瘤细胞凋亡,从而抑制胃癌发展。
基金项目
浙江省自然科学基金资助项目(No.LY18H270013, LQ17H270001)。