1. 引言
胰十二指肠切除术是肝胆胰外科手术中操作难度最大、手术创伤最大的手术,对患者的生理产生极大的干扰,且术后容易出现各种并发症,并发症的发生率高达25%~50%,死亡率约5% [1]。现回顾研究我院1例胰十二指肠术后患者,术后出现多种并发症,经我院积极治疗后好转出院的病例。
2. 病例资料
患者,女性,68岁,因“胰十二指肠术后胰漏1月余”于2021-03-30收入我院肝胆胰外科。入院前1+月,患者因“发现壶腹部占位1月”于外院就诊,于2021年2月24日在全麻下行“胰十二指肠切除术”,术后出现胰漏,腹腔感染(肺炎克雷伯杆菌),给予抗感染治疗后未见明显好转,仍有胰漏、进食差,全身状况差,后到我院就诊。查体:右上腹留置腹腔引流管两根,可见少量乳白色引流液,浑浊。诊断“1) 胰十二指肠切除术后;2) 十二指肠腺癌;3) 手术后胰瘘;4) 低蛋白血症;5) 腹腔感染;6) 营养不良”。2021-03-31检验结果提示:降钙素原0.302 ng/ml,CRP 58.29 mg/l,白细胞13.03 × 109/l,中性粒细胞总数11.21 × 109/l,中性粒细胞百分数86.00%。引流液淀粉酶(AMY) 13442.70 U/l。乳糜定性试验阳性。暂给予患者头孢哌酮钠舒巴坦钠抗感染,奥曲肽抑酶,补充人血白蛋白,考虑到患者营养不良,请营养科会诊,行补充性肠外营养治疗。
患者于2021年4月1日突然出现上腹部正中切口破溃渗液,可见浑浊液体渗出,量约20 ml,探查发现与腹腔相通。综合考虑腹腔引流不畅,有手术探查指征,沿原手术切口切开约10 cm,可见皮下脓液渗出,质稠,留取脓液送培养。术中用电刀切开长约8 cm腹膜,松解部分粘连,探查腹腔,可见上腹腔粘连严重,包裹原腹腔引流管,上腹腔未见明显脓液,下腹腔及盆腔较多积液,吸净积液,于右结肠旁沟放置腹腔引流管,关闭腹膜,于原脓肿处放置冲洗引流管2根。患者回病房后给予脓腔冲洗管低流量盐水冲吸,同时原腹腔引流管每日用少量盐水冲洗,保持引流通畅。
2021年4月3日患者开始出现发热症状,最高体温38.5℃,无畏寒寒战。急送相关实验室检查,降钙素原(PCT) 0.214 ng/ml,CRP 126.41 mg/l,白细胞(WBC) 11.77 × 109/l,中性粒细胞总数(NEU) 9.49 × 109/l,中性粒细胞百分数(NEU%) 80.5%。考虑到术前脓液吸收,术中创伤应激状态会导致发热,因而继续采用抗感染治疗方案,给予退热治疗后体温逐步恢复正常。
2021年4月5日接检验科危急值,脓液培养提示肺炎型肺炎克雷伯氏菌,该菌为产KPC酶耐碳青霉烯类抗菌药物肠杆菌科细菌(CRE),可考虑使用头孢他啶–阿维巴坦或替加环素进行治疗。我院暂无头孢他啶–阿维巴坦,外购费用昂贵。感染科会诊后,综合各方面原因,暂给予替加环素50 mg q12h,首剂加倍,加强引流。
2021年4月8日患者原腹腔引流管引流量少,经引流管冲洗发现2条引流管有相通,冲洗时部分浑浊液体经引流管旁渗出。右结肠旁沟引流管可见470 ml液体引出,腹水样,无浑浊,考虑低蛋白血症,渗出液可能,继续加强营养,补充人血白蛋白,利尿治疗。患者腹部切口仍见脓液渗出,冲洗效果欠佳,评估患者伤口情况后,予以床旁清创,安置持续负压吸引装置。
2021年4月14日第二次床旁清创,再次安置持续负压吸引装置。
患者反复发热,于2021年4月16日再次请感染科会诊,建议更换为头孢他啶阿维巴坦2.5 g q8h静脉滴注,考虑合并真菌感染可能,同时考虑加用抗真菌药物。患者于2021年4月16日21:00出现全身湿冷,测得血压81/57 mmHg,心率106次/分,血氧饱和度98%,考虑感染性休克。给予5%葡萄糖注射液45 ml + 去甲肾上腺素10 mg静脉泵入。转重症医学科进一步治疗。
转ICU后急查血提示:白细胞(WBC) 38.49 × 109/l,CRP 58.29 mg/l,降钙素原(PCT) 13.49 ng/ml。患者重症腹腔感染,脓毒性休克,给予美平 + 万古霉素 + 替加环素抗感染治疗。
2021年4月18日血培养外周直接涂片结果为真菌孢子,假菌丝。考虑患者真菌血症,加用米卡芬净抗真菌治疗。调整抗感染治疗方案为:美罗培南1.0 g q6h + 头孢他定阿维巴坦2.5 g q8h + 米卡芬净100 mg qd。
2021年4月25日调整抗感染治疗方案:美罗培南1.0 g q6h + 米卡芬净100 mg qd。同时行第三次床旁清创,安置持续负压吸引装置。
2021年4月26日营养科会诊,患者腹腔引流液乳糜试验阳性,腹腔引流量600+ ml,调整肠内营养方案为氨基酸型肠内营养粉。
2021年4月28日神经阻滞麻醉下行清创缝合术 + 持续负压引流术。
2021年5月3日乳糜漏减少,加用短肽型肠内营养液 + 氨基酸肠内营养液,减少肠外营养剂量,加强进食。
2021年5月6日头孢哌酮钠舒巴坦钠3.0 g q8h抗感染 + 氟康唑400 mg qd抗真菌。
2021年5月11日拔除腹腔引流管。
2021年5月12日带鼻饲管出院,切口负压吸引,建立家庭病房。
出院1周后拔除鼻饲管,正常进食。出院2周后切口愈合。出院1月后随访,生活基本自理。出院3月后随访,体能恢复,可生活自理,当地医院进一步化学治疗。
患者细菌培养结果详见图1。患者住院期间降钙素原变化趋势详见图2。患者住院期间超敏C反应蛋白变化趋势详见图3。患者住院期间白细胞计数及中性粒细胞计数变化趋势详见图4。患者住院期间乳糜量变化趋势详见图5。患者住院期间切口愈合情况详见图6。
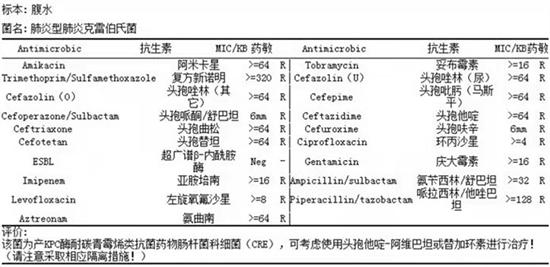
Figure 1. Bacterial culture results and drug sensitivity of the patient
图1. 患者细菌培养结果及药敏
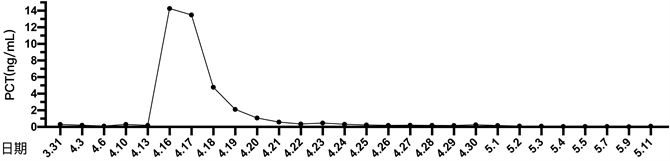
Figure 2. The change curve of procalcitonin
图2. 降钙素原变化曲线
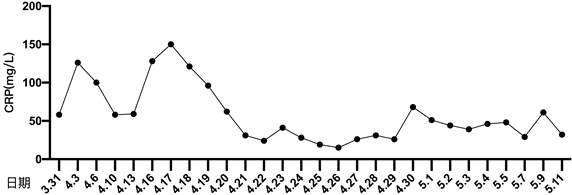
Figure 3. The change curve of hypersensitivity C-reactive protein
图3. 超敏C反应蛋白变化曲线
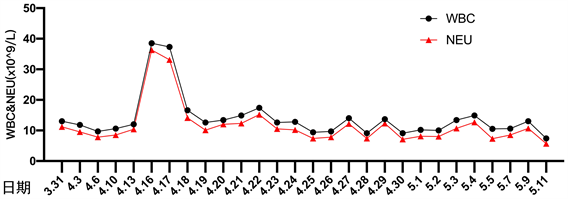
Figure 4. The change curve of white blood cell and neutrophil count
图4. 白细胞及中性粒细胞计数变化曲线

Figure 5. The change curve of chyle drainage
图5. 乳糜引流量变化曲线
3. 讨论
胰十二指肠切除术已成为胰头癌、胆总管下端癌、十二指肠癌、壶腹周围癌的标准术氏。该手术切除器官组织多,淋巴结清扫范围广,同时需要行胰肠吻合、胆肠吻合、胃肠吻合术,手术创伤大,术后亦有出现各种并发症的可能。对于并发症的治疗很棘手,多学科诊疗对于术后并发症的处理显得尤为重要。该患者术后出现多种并发症,先后出现胰漏、乳糜漏、切口裂开感染、脓毒性休克,治疗相当棘手,最终通过多学科综合治疗,好转出院,分享一下该例患者的治疗体会。
3.1. 胰漏的治疗
胰漏是胰十二指肠切除术后常见的常见并发症,术后胰漏的发生率可高达20.5%~45% [2]。对于B级胰漏,若处理不当或不及时,会升级为C级胰漏,出现一个或多个脏器功能衰竭,甚至死亡 [3]。胰腺术后胰漏的死亡率为1%,而C级胰漏相关死亡率高达25.7% [4]。胰腺残端与消化道吻合被视为胰十二指肠切除术的最关键步骤,有文献报道的胰肠吻合方式就有50多种 [5]。陈氏贯穿胰腺纵向U形缝合法术中只需要游离胰腺断端约1.5 cm,降低了因暴露导致胰腺损伤的可能,同时其纵行的U形缝合方式,减少了因打结力度过大导致结扎端胰腺坏死的风险,降低了术后胰漏的发生率 [6]。
胰漏的保守治疗方式有:1) 早期给予禁食,加强抗感染治疗,抑制胰腺外分泌功能,纠正水电解质及酸碱失衡;2) 保持腹腔引流管通畅,给予持续有效的引流或冲洗,如果引流不通畅,可考虑超声引导下穿刺引流置管,有报道研究,滴定式腹腔双套管匀速冲洗在胰十二指肠切除术后胰漏治疗中的效果确切,冲洗时间短,胰漏愈合快,可减少住院时间 [7];3) 加强营养支持治疗,患者术前多合并营养不良,经历大手术创伤后内环境稳态被破坏,合成代谢降低,导致胰肠吻合口不易愈合,因此术后营养支持非常重要。
本例患者术后出现胰漏、乳糜漏,合并腹腔感染等多种并发症,给予充分引流,间断冲洗,奥曲肽抑酶,全身营养支持治疗,腹腔引流液体逐步减少,拔管出院。我们的经验是一旦胰漏发生,在患者局部和全身情况允许的条件下应先试行保守治疗,充分引流,评估是否存在腹腔内出血及腹腔包裹性积液。若保守治疗效果不佳,腹腔引流不充分,应及时穿刺置管,必要时冲洗引流。当出现胰漏继发腹腔内出血,应紧急手术探查,根据术中探查决定手术方式。
3.2. 乳糜漏的治疗
根治性胰十二指肠切除术通常需要大范围的淋巴结廓清,骨骼化血管,尤其是清扫主动脉旁、腹腔干根部和肠系膜上动脉根部淋巴结时,极易破坏淋巴主干和损伤较大的淋巴管,能量器械的使用替代了大部分的结扎和缝合,淋巴管的损伤不能被及时发现,在患者恢复过程中,随着机体营养状态的改善,大量的乳糜样体液从淋巴管断端或损伤处漏出,形成乳糜漏。恶性程度越高,清扫范围越广泛,术后发生乳糜漏的可能性越大。
胰十二指肠切除术后发生乳糜瘘,经积极治疗,大多数预后良好。部分患者发生严重乳糜瘘,出现大量的脂质、离子、蛋白质、免疫细胞的丢失,会造成电解质紊乱、营养不良、低白蛋白血症、免疫功能低下等一系列问题,延长恢复时间,影响患者预后,增加住院时间和费用 [8]。倘若引流不畅,乳糜腹水聚集还可导致腹腔继发性感染,严重亦可危及生命。
对于乳糜漏的治疗,目前通常采用阶梯式治疗策略,即优先采用限制饮食、药物治疗等保守治疗措施,当保守治疗无法成功控制乳糜漏时,才考虑采取侵入性的治疗方法。保守治疗通常需要肠内外营养支持治疗,同时补充人血白蛋白,奥曲肽静脉泵入/皮下注射,维持电解质平衡。
目的是改善机体营养状况,同时减少乳糜液的流量,维持内环境稳定,等待淋巴管自然愈合。现行饮食疗法主要有3种:1) 低脂饮食+ 中链脂肪酸(medium‑chain triglyceride, MCT):食物中的中短链脂肪酸经肠道吸收后直接进入门静脉,低脂饮食可减少肠道乳糜液的流量,为淋巴管的愈合提供时间;2) 肠内营养:以人工配置的营养液代替低脂饮食,根据患者体重及基础代谢率为参考,指导营养方案,更精准地控制摄入的营养成分;3) 全肠外营养(totalparenteral nutrition, TPN):TPN可完全避免肠道吸收水分及脂肪酸,最大限度地降低乳糜液的流量。Pan等对以上3种治疗方案进行对比后发现,肠内营养治疗方案与TPN方案所取得的临床效果类似,且两者均优于低脂饮食 + MCT方案 [9]。在上述治疗方案的基础上,可配合药物治疗,最常使用的是生长抑素类药物,如奥曲肽 [10]。生长抑素类药物可减少内脏血流量和肠道对脂肪的吸收,从而减少乳糜液的流量。
该患者入院时可见原腹腔引流管呈乳白色,乳糜试验阳性,考虑存在乳糜漏。本例患者在营养治疗过程中,根据患者体重及基础代谢率,先制定肠外营养为主的治疗方案,考虑可能出现的肠道菌群失调的问题及患者基础需要量大,适当增加整蛋白肠内营养制剂,患者出现乳糜漏增加的情况。后期将肠内营养方案调整为氨基酸类肠内营养液,同时鼓励患者进食低脂饮食,减少肠外营养,辅以奥曲肽及人血白蛋白,患者乳糜量逐步减少,实现拔管,痊愈出院。
3.3. CRE和真菌感染的治疗
中国细菌耐药监测网的数据显示 [11],肺炎克雷伯菌对亚胺培南、美罗培南的耐药率分别从2005年的3.0%、2.9%上升至2018年的25.0%、26.3%,耐药率上升幅度高达8倍且呈明显增加趋势。肺炎克雷伯菌对碳青霉烯类抗菌药物的耐药机制主要有产KPC 型碳青霉烯酶(Klebsiella pneumoniae carbapenemase, KPC)、外膜蛋白缺失或突变、外排泵过度表达及青霉素结合蛋白变异,其中最主要的是产碳青霉烯酶 [12]。头孢他定阿维巴坦是由半合成头孢菌素和三乙烯二胺类β-内酰胺酶抑制剂阿维巴坦钠组成的新型头孢菌素酶抑制剂复合制剂。阿维巴坦与头孢菌素联用,可恢复头孢菌素对革兰阴性耐药菌的活性 [13]。
该患者入我院时带入腹腔引流管2根,乳白色,浑浊,量少,留取培养提示肺炎型肺炎克雷伯氏菌,该菌为产KPC酶耐碳青霉烯类抗菌药物肠杆菌科细菌(CRE)。同时患者有低热,临床科室获取培养结果后立即感染科会诊,综合各种原因,给予替加环素抗感染治疗。抗感染治疗后体温逐步正常,但1周后再次出现高热,并出现感染性休克表现,转重症监护室治疗。ICU急查血常规提示白细胞(WBC) 38.49 × 109/l,给予美罗培南1.0 g q6h + 替加环素50 mg q12h抗感染治疗,积极临购头孢他定阿维巴坦。到药后给予头孢他定阿维巴坦2.5 g q8h。患者长时间大剂量使用广谱抗生素,导致真菌感染的发生,血涂片提示真菌孢子,假菌丝,加用米卡芬净100 mg qd。经该抗感染及抗真菌治疗方案,患者体温逐步正常,感染指标逐步好转,感染得到控制,逐步停用头孢他定阿维巴坦,给予美罗培南1.0 g q6h + 米卡芬净100 mg qd抗感染治疗。考虑患者可能合并其他细菌感染,且断崖式停用抗生素会导致病情反复,细菌耐药的发生,后续继续降阶梯治疗,改用头孢哌酮钠舒巴坦钠3.0 g q8h抗感染 + 氟康唑400 mg qd抗真菌治疗。经上述治疗,患者感染有效控制,多次复查炎性指标均好转,最后停药,好转出院。
本例患者细菌培养提示CRE,给予替加环素后仍反复出现发热,最后出现感染性休克,脓毒血症。有文献报道 [14],在联合用药方案中包含碳青霉烯组的临床疗效优于未包含组,因此可以继续应用美罗培南;对于碳青霉烯耐药的肺炎克雷伯菌治疗方案中,即使MIC值达到16 mg/l,美罗培南的联合方案组病死率更低,甚至推荐MIC值达至32 mg/l时继续应用美罗培南联合方案,且推荐美罗培南加大剂量,延长输注时间 [15]。该患者给予美罗培南后感染指标有好转趋势,故给予头孢他啶阿唯巴坦 + 美罗培南抗感染,血培养提示真菌感染后,加用抗真菌药物治疗,患者各项感染指标好转,抗感染治疗有效。
3.4. 切口裂开感染的治疗
本例患者入院后出现切口裂开,大量脓性液体渗出,部分与腹腔相通,急诊行清创缝合,同时皮下放置冲洗引流管2根,术后给予皮下冲洗引流,切口换药。切口出现感染,常规换药方式效果差,于床旁多次安置持续负压吸引装置,待创面肉芽组织覆盖,评估无感染情况后给予清创缝合,切口逐步愈合。对于切口裂开,切口严重感染的患者,每日多次换药,不仅增加医护人员工作压力,同时也增加患者的痛苦。持续负压吸引装置可以使引流更加通畅彻底,不受体位限制,防止残余脓腔及死腔的形成,保持创面洁净,为肉芽组织的形成提供条件,缩短二期清创缝合的等待时间。持续负压吸引装置可保持7~10天,减少换药的频率,减轻医护的负担,减少患者的痛苦。
4. 总结
胰十二指肠切除术是肝胆胰外科最大的手术,需要行此类手术的患者多为恶性肿瘤,术前多合并营养不良,营养治疗应贯穿于治疗的全程,术前需行营养风险评估,调整患者营养状态,可降低术后胰漏的发生。胰十二指肠切除术后的患者多需要一定时间的禁食,倘若营养治疗不能及时跟进,会继发吻合口漏、腹腔感染、切口愈合不良等一系列问题。胰十二指肠切除术中需要进行大范围的淋巴结清扫,对于可疑或者明确的淋巴管道应给予结扎或者缝扎,避免大范围使用能量器械,防止术后乳糜漏的发生。对于术后出现腹腔感染,尤其是多重耐药菌感染的患者,感染科应及时参与诊疗,及时调整抗生素的使用,正确合理地使用抗生素对于治疗复杂细菌感染具有重要作用。另外持续负压引流对切口裂开感染具有很好的治疗效果,患者接受度高,值得推广。总之,多学科的治疗模式对于胰十二指肠切除术患者的康复具有重要意义。
参考文献
NOTES
*第一作者。
#通讯作者。