1. 引言
作为世界上最常见的慢性肝病,非酒精性脂肪性肝病(Non-alcoholic fatty liver disease, NAFLD)的定义为在少量或不饮酒的情况下,超过5%的肝细胞发生脂肪变性。NAFLD从组织学上分为良性非酒精性脂肪肝(NAFL)和更严重的非酒精性脂肪性肝炎(NASH),两者的区别在于肝组织是否发生炎症及纤维化 [1] [2]。NAFLD在成人中的患病率为20%~30%,与高血压、血脂异常、中心性肥胖、胰岛素抵抗(IR)或糖尿病密切相关。NAFLD的发病机制及其进展是一个复杂的过程,不能完全用“两击”假说来解释。而“多重打击”学说指出,肠道微生物群、胰岛素抵抗、脂肪组织分泌的激素和肥胖等因素影响肝细胞脂肪含量以及肝脏炎症环境,从而导致慢性肝病炎症状态 [3]。目前临床中尚无有效治疗NAFLD的药物,主要以“健康教育,改变生活方式;控制体重;改善胰岛素抵抗;减少附加打击以免增加肝脏损害”为原则治疗NAFLD。
《名医别录》中曾记载道,栀子“大寒,无毒。主治目热赤痛,胸心大小肠大热,心中烦闷,胃中热气”。除此之外,栀子也是许多传统复方的重要组成部分,如《伤寒论》中的茵陈蒿汤,《普济方》中的栀子汤,《金匮要略》中的栀子大黄汤等 [4]。中药栀子(Gardenia jasminoides Ellis)为茜草科栀子属植物的干燥成熟果实,其性寒、味苦,具有泻火除烦、清热除湿、凉血解毒的功效,药理学研究表明栀子具有多种药理活性,包括抗氧化应激、保肝利胆、护胃、保护内皮细胞、免疫抑制、神经保护及抗焦虑等 [5]。NAFLD在中医理论中属于“肝癖”的范畴 [6],其发病与情志不畅、饮食不节、劳逸失衡、久病迁延等因素相关 [7],有实验证据表明,栀子能够抑制炎症反应,抗氧化应激损伤,从而减轻肝脏脂肪变性 [8] [9]。中药以其多成分、多靶点、多环节、多通道的优势在NAFLD的治疗中屡获良效,攻补兼施是其基本治则。中药栀子在我国广泛应用于治疗NAFLD,但目前具体的分子机制尚不明确。
网络药理学是一门新兴学科,与中医有着许多共通之处。网络药理学从系统生物学和生物网络平衡的角度解释了疾病的发生和发展,是研究中医和疾病之间复杂关系的一种有效方法 [10] [11]。本研究将中药与网络药理学相结合,通过网络药理学的数据挖掘技术,筛选栀子的有效活性成分及作用靶点,以此来探究栀子在非酒精性脂肪肝治疗中的作用机制,为下一步需要进行的实验研究提供基础。
2. 材料和方法
2.1. 栀子的有效活性成分获取及筛选
应用中药系统药理数据库及分析平台(TCMSP) (https://tcmspw.com/tcmsp.php)获取栀子的全部有效活性成分,再对所有有效活性成分进行筛选,筛选标准为口服生物利用度(Oral bioavailability, OB) ≥ 30%和类药性指数(Drug like index, DL) ≥ 0.18。
2.2. 栀子的有效成分对应靶点获取及筛选
将2.1中筛选过后的有效活性成分逐个在“Related Targets”检索,得到对应靶点的靶蛋白名称,在Uniprot (universal protein knowledgebase, https://www.uniprot.org/)数据库中输入靶蛋白名称(target name),查询与靶蛋白名称相对应的基因名称,将靶蛋白名称进行统一,以获得栀子有效活性成分的潜在作用靶点。
2.3. 栀子有效活性成分–作用靶点网络的构建
使用网络映射软件Cytoscape 3.8.2 (http://www.cytoscape.org)构建栀子有效活性成分及其靶标的网络。在网络中,节点(node)代表目标、基因、分子或蛋白质,节点之间的连接称为“边”,代表目标、基因、分子或蛋白质之间的相互作用。节点的“度”值表示网络中节点之间的连接数。度值越大,目标越有可能成为栀子有效活性成分的关键靶点。
2.4. NAFLD疾病靶基因的获取
分别在DrugBank数据库(https://go.drugbank.com/)及GeneCards数据库(https://www.genecards.org)中检索NAFLD的作用靶点,获取可能与非酒精性脂肪肝相关的靶基因名称,删除重复值将结果进行标准化处理。
2.5. 蛋白质–蛋白质相互作用(PPI)网络构建及分析
将2.2中得到的栀子有效活性成分靶点与2.3中得到的NAFLD靶点取交集,将得到的靶点导入到STRING数据库(https://string-db.org)中以获得蛋白质相互作用关系,应用Cytoscape 3.8.2软件中以构建和分析蛋白质–蛋白质相互作用(PPI)网络,使用CytoHubba插件分析PPI网络以获得核心集群和关键靶标,借助STRING数据库建立关键靶标网络。在该网络中,关键靶标通过已知的(从精选数据库中获得和通过实验确定的)、预测的(基因邻接,基因融合和基因共存)以及其他(文本挖掘,共表达和蛋白质同源性)相互作用进行交互。
2.6. 基因功能及通路富集分析
将2.4中获得的交集靶点输入David (https://david.ncifcrf.gov/)数据库中进行自定义分析,选择人类物种,分别进行生物进程(biological process, BP)、分子功能(molecular function, MF)、细胞成分(cellular component, CC)和KEGG通路富集分析,对显著富集(P < 0.01)的功能和通路制作可视化气泡图。
2.7. 核心活性成分–靶点分子对接验证
从TCMSP数据库中下载栀子关键有效成分的mol2文件,导入AutoDock Tools 1.5.6软件并进行处理,保存为pdbqt格式。从PDB数据库(https://www.rcsb.org)下载关键靶点的3D结构,通过PyMOL软件对蛋白质进行去除水分子和多余的非活性配体等处理,导入AutoDock Tools 1.5.6软件加氢、加电荷处理,输出为pdbqt格式。在软件中运行分子对接过程,选择“Genetic Algorithm”计算方法,对对接结果(Blind energy)进行打分,根据结合能及连接位点作图,并利用PyMOL将对接结果可视化。
3. 结果
3.1. 栀子有效成分的汇集及筛选
本研究借助TCSMP数据库检索栀子的有效活性成分,经药代动力学(ADME)筛选出15个化合物,删除其中3个尚未找到作用靶点的化合物,最终得到12个栀子的有效化学成分,见表1。

Table 1. Information on the active ingredients of Gardenia jasminoides
表1. 栀子有效活性成分信息
3.2. 栀子有效活性成分作用靶点的汇集及筛选
将筛选出的12种化合物分别在TCSMP数据库中检索得到其对应靶点,通过Uniprot数据库统一命名后一共得到345个靶点基因信息,删除重复值后得到193个靶点基因。
3.3. 栀子有效活性成分–作用靶点网络的构建
将3.2中获取的结果导入Cytoscape3.8.2软件,对栀子有效活性成分–靶点进行网络构建,主要有效活性成分–靶点网络图结果显示,共有205个节点和345条边,其中205节点包括12个主要有效活性成分节点和193个靶点节点,见图1。根据其自由度由大到小排序靠前的为:quercetin (槲皮素)、kaempferol (山柰酚)、beta-sitosterol (β-谷甾醇)、Stigmasterol (豆甾醇)、Ammidin (欧前胡素)、Mandenol (亚油酸乙酯)、isoimperatorin (异欧前胡素)等,其中槲皮素具有148个潜在作用靶点,其次是山柰酚(60个)和β-谷甾醇(37个)。潜在作用靶点越多,越有可能是栀子发挥关键作用的活性成分。
 12个方形节点表示栀子成分节点,193个菱形节点表示蛋白靶点节点。
12个方形节点表示栀子成分节点,193个菱形节点表示蛋白靶点节点。
Figure 1. Gardenia jasminoides active component-action target network
图1. 栀子有效活性成分–作用靶点网络
3.4. NAFLD疾病靶点的汇集及筛选
在DrugBank数据库和GeneCards数据库中分别获得512个和390个疾病靶点,删除重复值后得到883个NAFLD疾病靶点。
3.5. 蛋白质–蛋白质相互作用(PPI)网络的构建及分析
将193个栀子有效活性成分靶点及883个NAFLD疾病作用靶点取交集,得到45个共同作用靶点,如图2。借助STRING数据库得到该45个靶点的相互作用关系,并将结果导入Cytoscape 3.8.2软件进行分析,该网络由45节点和455个相互作用边组成(图3),分析PPI网络获得的5个关键靶标分别为JUN、白介素6 (IL-6),肿瘤坏死因子(TNF),AKT丝氨酸/苏氨酸激酶1 (AKT1)和肿瘤蛋白P53 (TP53) (图4、图5),其中包括信号分子、钙结合蛋白、激酶、转移/载体蛋白、转移酶和转录因子。
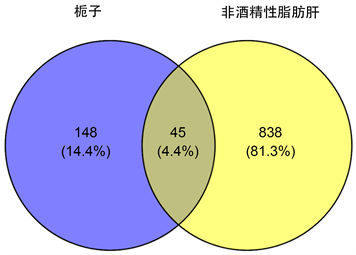
Figure 2. Venn diagram of the intersection of Gardenia jasminoides-NAFLD targets
图2. 栀子-NAFLD作用靶点交集韦恩图

Figure 3. Gardenia gardenia active ingredient-NAFLD PPI network diagram
图3. 栀子活性成分-NAFLD PPI网络图
 方形节点表示关键靶点,圆形节点表示核心集群。
方形节点表示关键靶点,圆形节点表示核心集群。
Figure 4. The core clusters and key targets of Gardenia jasminoides-NAFLD PPI network
图4. 栀子活性成分-NAFLD PPI网络核心集群及关键靶点
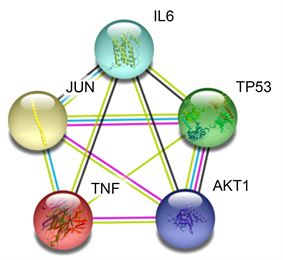
Figure 5. Key targets interaction relationship
图5. 关键靶点相互作用关系
3.6. 基因功能及通路富集分析
借助David数据库将45个靶标进行基因功能及通路富集分析,并将显著富集(P < 0.01)的前10条通路可视化为气泡图。在生物进程富集分析中,共得到330个条目,靶点主要涉及凋亡信号通路、多种应答过程(脂多糖、氧化应激、毒性物质、胰岛素、肿瘤坏死因子和生长因子刺激等)、活性氧代谢过程、神经元死亡调节、小分子代谢过程的调控等多种生物进程。在分子功能富集分析中,共得到56个条目,靶点具备能和细胞因子受体、生长因子受体、受体调节器、蛋白质结构域、转录因子、蛋白酶、蛋白激酶、RNA聚合酶II转录因子结合的分子功能。在细胞组分富集分析中,共得到27个条目,靶点主要分布在膜筏、膜微区、质膜、转录因子、轴突细胞质、胞体、树突等区域(图6)。
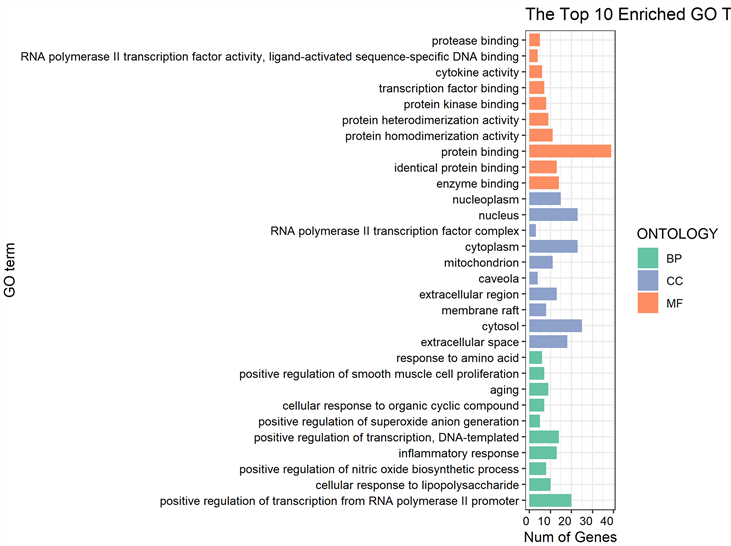
Figure 6. The top 10 pathways with significant enrichment in biological processes, molecular functions and cell components
图6. 生物进程、分子功能、细胞组分显著富集的前10条通路
通过对栀子治疗NAFLD的45个关键靶点进行KEGG通路富集分析,共得到96条生物信号通路,其中排名靠前的通路主要有胰岛素抵抗、癌症通路、肿瘤坏死因子信号通路、MAPK信号通路、toll样受体信号通路、nod样受体信号通路等。按照P值由小到大选择前20条通路可视化为气泡图(图7)。
3.7. 核心成分–关键靶点的分子对接结果
主要有效活性成分–靶点网络图结果显示排名靠前的栀子核心成分为槲皮素与山柰酚,将这两种核心成分分别与5个关键靶点分子对接,其结合能均小于−5 kJ/mol,表明栀子核心活性成分均与关键靶标具有良好的结合活性,见图8,图9。
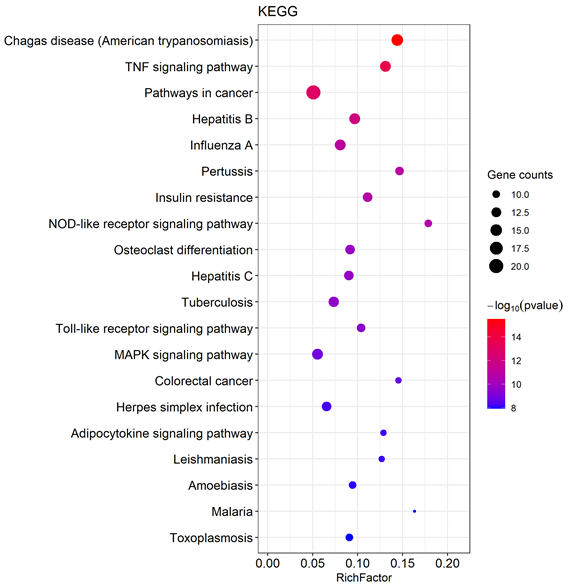
Figure 7. Enrichment analysis of KEGG pathway
图7. KEGG通路富集分析
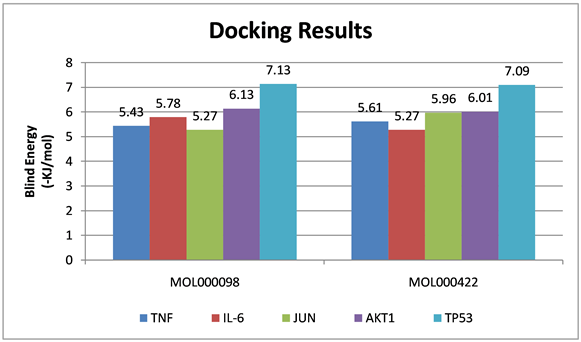
Figure 8. The binding energy of the effective active ingredients of Gardenia jasminoides to the key targets
图8. 栀子有效活性成分对接关键靶点结合能
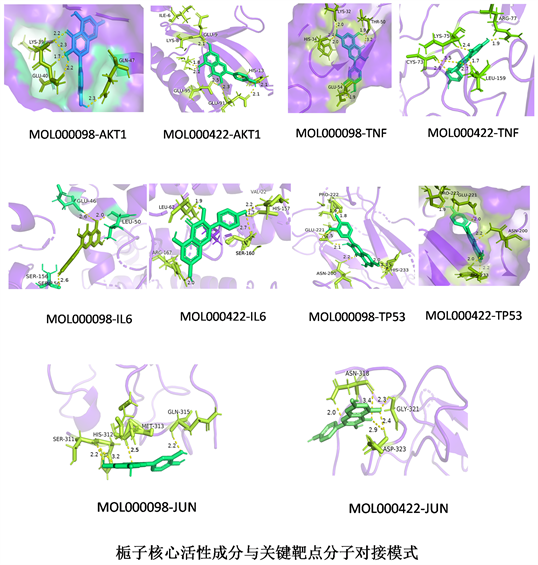
Figure 9. Docking model diagram of core active components and key target molecules of Gardenia jasminoides
图9. 栀子核心活性成分与关键靶点分子对接模式图
4. 讨论
本研究借助数据库及软件在网络药理学的基础上探究栀子这一味单药治疗NAFLD的作用机制,初步得出栀子的有效活性成分及其作用靶点、NAFLD作用靶点以及栀子治疗NAFLD的可能通路。在栀子的有效活性成分中,槲皮素具有最多的作用靶点,据研究表明,槲皮素是一种天然存在的植物化学物质,具有较强的抗氧化、抗癌和抗增殖作用,可通过IRE1a-XBP1通路促进肝脏极低密度脂蛋白的组装及脂噬来改善高脂饮食诱导的NAFLD [12],也可能通过增加硬脂酰辅酶A去饱和酶1 (Stearyl coenzyme A dehydrogenase-1, SCD1)表达和降低肝X受体α (Liver X receptor α, LXR-α)表达以减少肝脏脂质蓄积,抵抗氧化应激以治疗高脂饮食诱导的NAFLD [13]。
通过构建栀子活性成分及非酒精性脂肪肝共同靶点的PPI网络发现,JUN、IL-6、TNF、AKT1、TP53为核心靶点。其中IL-6、TNF等作为炎症因子,通过各种途径影响了非酒精性脂肪肝的发生和发展 [14] 。有人 [15] 发现,IL-6可以通过经典信号传导通路表现抗炎作用,还可以通过反式信号传导通路表现促炎作用。Wieckowska [16] 等人发现非酒精性脂肪性肝炎患者肝脏中IL-6的表达升高且与炎症和纤维化程度呈正相关。肝脏中IL-6的生成增加可能在NASH的发展、系统性胰岛素抵抗和糖尿病中起到重要作用。c-Jun-N末端激酶(JNK)是促炎症的必需因子,IL-6等细胞因子可通过激活NF-κB/JNK/神经酰胺途径,进而抑制胰岛素信号传导,引起炎症反应、胰岛素抵抗,促进NAFLD的发生和发展 [17]。但Ma Y等人发现 [18],IL-6可显著抑制过氧化物酶体增殖物激活受体γ (peroxisome proliferators-activated receptorsγ, PPARγ)及其3个靶基因血小板反应蛋白受体36 (platelet reactive protein receptor 36, Cd36)、脂肪酸结合蛋白4 (fatty acid binding protein 4, Fabp4)和镁离子转运蛋白1 (monoacylglycerol O-acyltransferase 1, Mgat1)的mRNA水平,减少脂质积累,对肝脏起到保护作用。肿瘤坏死因子-α (TNF-α)是一种由巨噬细胞分泌的促炎细胞因子,具有抑制肿瘤细胞增殖、增加抗感染、提高中性粒细胞的吞噬能力等作用,此外它还可以通过激活炎症反应和提高黏附分子的表达来影响血脂 [19],在NAFLD的发生和发展中起到重要作用。TNF-α信号转导由肿瘤坏死因子受体1 (Tumor necrosis factor receptor 1, TNFR1)和肿瘤坏死因子受体2 (Tumor necrosis factor receptor 2, TNFR2)调控,TNFR1广泛表达,而TNFR2的表达仅限于免疫细胞、内皮细胞和神经元。TNFα与TNFR1的结合导致细胞质衔接蛋白和TNF受体相关因子2 (TNF receptor associated factor 2, TRAF2)或受体相互作用蛋白1 (receptor interacting protein1, RIP1)形成蛋白质复合物,随后激活丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK),从而激活JNK或NFκB通路 [20],导致NAFLD的发生发展。有人 [21] 发现,抑制TNFR1可显著抑制JNK及其上游调节因子丝裂原活化蛋白激酶激酶(mitogen activated protein kinases kinases, MKK7)的激活,表明TNFR1在非酒精性脂肪肝MAPK通路的激活中起到重要作用。除此之外,TNFR1还可通过激活胆固醇调节元件结合蛋白1 (Cholesterol regulatory element binding protein 1, SREBP1)及其下游的靶点,如脂肪酸合成酶(fatty acid synthase, FAS)和SCD1,从而导致肝脏甘油三酯含量增加和脂肪变性。
GO生物进程富集分析结果显示,靶点主要涉及凋亡信号通路及胰岛素、氧化应激、肿瘤坏死因子等多种应答过程,推测栀子可能通过调控细胞凋亡、抵抗氧化应激、抑制肿瘤坏死因子表达等多个方面治疗非酒精性脂肪肝。KEGG通路富集结果显示,共同靶点富集显著的前20条信号通路中,与非酒精性脂肪肝相关的有胰岛素抵抗、肿瘤坏死因子信号通路、MAPK信号通路、toll样受体信号通路、nod样受体信号通路等。NAFLD可以导致胰岛素抵抗,进而促进多种代谢性疾病的产生;反过来胰岛素抵抗又导致了NAFLD的形成,两者之间形成恶性循环 [22]。胰岛素是一种由胰腺β细胞分泌的多效性激素,其可通过抑制激素敏感脂肪酶(hormone-sensitive lipase, HSL)磷酸化来抑制脂肪分解,防止脂肪组织向肝脏溢出,从而防止肝脏脂肪变性 [23]。还可以通过降低肝葡萄糖的生成和糖原分解,增加脂肪组织的葡萄糖摄取速率。胰岛素正常情况下与细胞表面受体结合,磷酸化其酪氨酸残基上的几种底物,包括胰岛素受体底物(insulin receptor substrate, IRS) 1、2、3、4,而IRS 1及IRS 2磷酸化脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase, PI3K),导致葡萄糖转运蛋白4 (glucose transporter 4, GLUT4)的易位,提高脂基因的表达 [24]。肝脏中甘油三酯合成酶受碳水化合物反应元件结合蛋白(Carbohydrate response element binding protein, ChREBP)、SREBP-1c和LXRs的转录调控,胰岛素信号通路可通过直接或间接激活ChREBP、SREBP-1c和LXRs及下游的靶点,从而合成甘油三酯,导致肝脂肪变性 [25]。而像TNF、JNK、IL等炎症因子可通过介导胰岛素信号通路加重胰岛素抵抗。toll样受体(TLR)是一类模式识别受体家族,可识别激活固有免疫系统从而在感染性疾病、自身免疫性疾病等多种疾病中发挥关键作用 [26]。有研究 [27] 表明,TLR4可能通过诱导活性氧(ROS)依赖性的激活X盒结合蛋白1 (X—box binding protein 1, XBP1)诱导肝脏脂肪变性及炎症发生。NOD样受体蛋白亚家族(NOD—like receptor proteins, NLRPs)在人体自身炎症免疫反应中起重要作用,各类NLRPs炎症小体参与多种代谢性疾病的发生发展 [28]。有研究表明,NLRP3炎性小体可激活caspase-1,随后蛋白水解激活促炎细胞因子IL-1β和IL-18,诱导小鼠和人的原发性肝细胞发生细胞焦亡,随后释放NLRP3炎性小体蛋白,放大和延续炎性小体驱动的肝纤维化 [29]。
综上所述,本文从网络药理学角度探讨栀子治疗非酒精性脂肪肝的潜在作用靶点及作用机制,发现栀子治疗非酒精性脂肪肝的主要成分为槲皮素、山柰酚、β-谷甾醇等,它可通过胰岛素抵抗、MAPK、TNF、TLR、NLR等多种信号通路发挥作用,表明一种化合物可作用于多个信号通路,一种信号通路可能有多个靶点参与,一个靶点可能在多个化合物中存在,体现了栀子治疗非酒精性脂肪肝的多成分、多靶点、多通道的特点,为进一步研究栀子治疗非酒精性脂肪肝的实验设计提供基础。但由于目前中药研究数据库具有不全面性、滞后性等缺点,我们仍需进一步进行数据挖掘来验证相关观点。
参考文献
NOTES
*通讯作者。