1. 引言
随着人口老龄化的加剧,缺血性脑卒中的发病率逐渐升高,约占脑卒中总数的60%~70%,是脑血管病患者致残的首要原因和主要死因 [1]。大动脉粥样硬化型(Large Artery Atherosclerosis, LAA)脑梗死是我国缺血性脑卒中最为常见的病因分型。既往有研究表明在亚洲人群中颅内动脉粥样硬化为缺血性卒中最常见病因 [2]。脑小血管病(Cerebral small vessel disease, CSVD)主要影像学特征包括近期皮质下小梗死(recent small subcortical infarct, RSSI)、推测为血管源性的腔隙、推测为血管源性的脑白质高信号(white matter hyperintensity, WMH)、血管周围间隙(perivascular space, PVS)、脑微出血(cerebral microbleed, CMB)和脑萎缩 [3]。近来研究表明,LAA型脑梗死患者常同时存在不同程度的CSVD影像学表现。既往研究多探讨了CSVD单一影像学标记物与颅内动脉狭窄的相关性,迄今为止关于LAA型脑梗死患者脑小血管病总体负担与颅内动脉狭窄相关性研究较少,本研究初步探索了LAA型脑梗死患者脑小血管病总体负担与颅内动脉狭窄的相关性,报告如下。
2. 研究对象
回顾性纳入2018年10月到2021年6月期间于青岛大学附属医院神经内科住院、首次发生LAA型脑梗死患者。本次研究共纳入患者228例,其中男性142例,女性86例;年龄39岁~85岁,平均年龄66.19岁。
2.1. 入组标准
1) 所有患者均完善了颅脑磁共振成像(Magnetic Resonance Imaging, MRI)、头颈部计算机断层血管造影(Computed Tomographic Angiography, CTA)等检查以及血液指标检测;脑梗死符合《中国急性缺血性卒中诊治指南2018》 [4] 的诊断标准,并经MRI确诊,且根据中国缺血性卒中亚型(Chinese Ischemic Stroke Subclassification, CISS)分型为LAA型 [5];2) 年龄 ≥ 18周岁;3) 首次罹患缺血性脑卒中,发病至就诊时间 ≤ 7天;4) 无脑出血、脑肿瘤、脑外伤史;无结核、梅毒、结缔组织病等可能导致血管损害疾病;5) 患者或家属知情同意。
2.2. 排除标准
1) 既往脑梗死病史;2) 脑肿瘤、出血性卒中及外伤病史;3) CISS分型为非LAA型;4) 颅外动脉狭窄 > 50%;5) 严重的心肝肾功能不全;6) 具有结核、梅毒、结缔组织病等可能导致血管损害疾病;7) MRI检查的禁忌症,包括昏迷、精神异常、未控制的癫痫、幽闭症、体内有金属异物(假牙、金属植入物、术后金属夹等)、体内装有心脏起搏器及神经刺激器;8) 临床及影像学资料不完整;9) 拒绝参加调查研究。
3. 资料与方法
3.1. 一般临床资料收集
收集患者基础资料,如年龄、性别、BMI、是否有抗血小板药物应用史;血管危险因素,如吸烟史、饮酒史等;既往史,如高血压、糖尿病、高脂血症等。血液指标检测:总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、同型半胱氨酸(Hyc)、空腹血糖。高血压诊断参照《中国高血压防治指南2018 年修订版》 [6]。糖尿病诊断参考《中国 2 型糖尿病防治指南(2017年版)》 [7]。高脂血症诊断参考《中国成人血脂异常防治指南(2016年修订版)》中的一项或多项,或入院前已明确诊断为高脂血症且正在服用降脂药 [8]。
3.2. 影像学评估
所有入组患者在入院7天内完善颅脑MRI、头颈部CTA检查。颅脑MRI应用GESiganHDx3.0T高场超导磁共振扫描仪。颅脑MRI成像序列包括:T1加权像(T1 weight imaging, T1WI)、T2加权像(T2 weight imaging, T2WI)、液体衰减翻转恢复序列(Fluid attenuated inversion recovery, FLAIR)、弥散加权成像 (Diffusion weighted imaging, DWI)以及磁敏感加权成像(Susceptibility weighted imaging, SWI)。扫描层间距1.5 mm,层厚5 mm,视野(FOV) = 240 mm × 240 mm,矩阵 = 320 × 256。收集T1WI和T2WI冠状位及横轴位,T2-FLAIR、DWI和SWI的横轴位。头颈部CTA检查应用64排螺旋CT联合三维血管造影完成,在轴位、冠状位及矢状位进行摄片。其中,管电压120 kV,管电流200 mA,层厚0.625 mm,螺距0.984:1,矩阵256 × 256。扫描范围是从主动脉弓至脑顶部,包括颈内动脉、椎动脉、基底动脉和主要颅内大血管分支。由2名经验丰富的影像科医生及1名神经内科医师共同阅片评定相关影像学指标,若意见不一致时,则由三位医师共同商定。
3.2.1. 颅内动脉狭窄分组标准
颅内血管狭窄率(%) = (1 − 狭窄最重处血管直径/狭窄近端正常血管直径) × 100% [9];颅外血管狭窄率(%) = (1 − 狭窄最重处血管直径/狭窄远端正常血管直径) × 100% [10],见图1。根据动脉狭窄程度进一步分级:0%~49% (轻度狭窄);50%~69% (中度狭窄);70%~99% (重度狭窄)以及完全闭塞。当多根颅内血管同时存在狭窄或同一根血管存在多处狭窄时(串联病变),取最窄处进行严重程度分级。
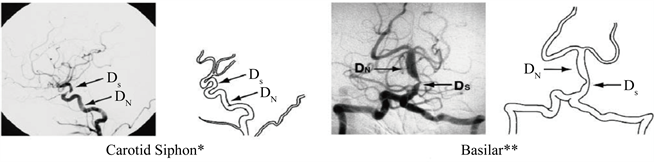
Figure 1. The schematic diagram of cerebral artery stenosis
图1. 脑动脉狭窄示意图
狭窄率 = [1 − (Dstenosis/Dnormal)] × 100%
3.2.2. CSVD影像学诊断标准
1) RSSI:RSSI在影像学上表现为近期发生的位于穿通动脉分布区的小梗死,T1WI序列中为低信号,T2WI和FLAIR序列中为高信号,轴位最大直径 < 20 mm,冠状位或矢状位直径 > 20 mm。病变多分布在内囊后肢、半卵圆中心、豆状核、丘脑前外侧以及幕下区域(脑干和小脑)。DWI序列上为高信号,可作为与陈旧性梗死灶的鉴别方法。尾状核头的梗死是脉络膜前动脉闭塞所致,病因明确,故归入RSSI,而基底节区和内囊直径 > 20 mm的病灶是由几个穿通性动脉同时闭塞导致,不归入此类 [3]。
2) 腔隙:腔隙在MRI上表现为位于皮质下的圆形或卵圆形的类似于脑脊液信号的充满液体的腔隙,在T1WI序列中为低信号,T2WI序列中为高信号,FLAIR序列中为中心低、外周包绕高信号环,直径为3~15 mm。在某些血管性腔隙中也发现FLAIR未抑制的中央高信号积液腔,但在T1WI和T2WI序列中仍呈脑脊液样信号。影像学上腔隙应与PVS区分,两者在MRI上均为脑脊液样信号,并均多发于半卵圆中心和基底节,但是直径 < 3 mm更可能是PVS,>15 mm则更可能是RSSI,而腔隙的大小介于两者之间 [3]。
3) 脑白质高信号:WMH表现为脑白质区域中大小不等的异常信号,在T2WI和FLAIR序列为高信号,T1WI序列为等信号或低信号。WMH病变早期为位于额叶和(或)枕角的小帽状病变,随病变加重,可延伸到皮质下白质区并发生融合,WMH还可发生于基底节和丘脑的白质。自动分割技术可以更精确和快速地定量WMH的负荷和进展 [3]。
4) 脑微出血:CMB具有血液分解产物含铁血黄素的顺磁性特性,在T2*-GRE和SWI上可见小圆形或卵圆形、边界清楚、均质性、信号缺失灶,但在FLAIR、T1WI和T2WI序列中不可见。目前对CMB的直径存在争议,一般认为其直径为2~5 mm,最大可达10 mm,这个上限可以与大范围脑出血进行鉴别。CMB主要位于皮质和皮质下或深部灰质和白质。钙化、空气和脑血管畸形在SWI和T2*-GRE上也可呈低信号,可通过CT、MRI的T2WI、FLAIR序列以及MRI血管成像进行鉴别。血管流空影在SWI不同层面上会出现连续移位,CMB则表现为突然出现和突然消失 [3]。
5) 血管周围间隙:PVS表现为包绕血管、沿着血管走行的间隙,在影像学上,其平行血管走行时呈线样,垂直血管走行时呈现圆形或卵圆形,类似于脑脊液信号。表现为T1WI和FLAIR序列低信号,T2WI序列高信号,直径一般<3 mm。PVS好发于基底节、皮质下、脑干等部位,小脑则较少发生 [3]。
6) 脑萎缩:脑萎缩表现为脑体积减小,并且与脑外伤和脑梗死等损害导致的局部体积减小无关。在头颅CT或MRI止可见脑体积减小、脑室扩大,脑沟脑回增宽。目前,可应用先进的影像学技术对脑萎缩程度进行更精确地测量 [3]。
3.2.3. CSVD总体负担的评定标准
脑小血管病总体负担是CSVD对脑组织损伤的累积效应在颅脑MRI上的表现。2014年Staals [11] 建立了关于总MRI脑小血管病负担的评分量表,包括腔隙、WMH、CMB和PVS等4项CSVD影像学表现。腔隙常位于基底神经节、内囊、半卵圆中心或脑干;大于或等于1个腔隙评为1分。WMH根据部位分为脑室周围白质高信号(Periventricular white matter hypertensity, PVWMH)和深部白质高信号(Deep white matter hypertensity, DWMH)。Fazekas量表评估WMH的评分标准如下:① PVWMH:无病变为0分;帽状或铅笔样薄层病变为1分;光滑的晕圈病变为2分;脑室旁不规则且累及深部白质的高信号为3分;② DWMH:无病变为0分;点状病变为1分;逐渐融合的病变为2分;大面积融合的病变为3分 [12];延伸到深部白质的PVWMH (Fazekas评分为3分)和(或)融合的DWMH (Fazekas评分为2~3分)病变评为1分。CMB常位于小脑、脑干、基底节、白质或皮质–皮质下交界处;大于或等于1个CMB评为1分。参照半定量量表对PVS进行评估 [13],共分为5个等级,0个为0级,1~10个为1级,11~20个为2级,21~40个为3级,>40个为4级;中–重的BG-PVS (半定量分级为2~4级)评为1分。总CSVD评分为0~4分,分数越高,CSVD病变越重。本次研究中,将CSVD总分为0分的患者归为无/轻度CSVD总体负担组,将CSVD总分为1分或2分的归为中度CSVD总体负担组,将CSVD总分为3分或4分,分为重度CSVD总体负担组。因此,本研究中将患者分为无/轻度(CSVD总评分0分)、中度(CSVD总评分1~2分)和重度(CSVD总评分3~4分)三组。
3.3. 统计学方法
应用SPSS26.0软件进行统计学处理。连续变量用均数 ± 标准差(
)表示,或中位数(M)和四分位间距(IQR)表示,多组间比较,连续变量符合正态分布且方差齐,应用方差分析,否则用Kruskal-Wallis H检验。分类变量用频数(n)和百分率(%)表示,组间比较应用c2或Fisher精确检验分析。将有统计学意义指标进一步应用多因素logistic回归分析。应用Spearman等级相关分析,评估CSVD总体负担严重程度与颅内动脉狭窄程度关系,P < 0.05为有统计学意义。
4. 研究结果
4.1. 研究对象基线资料及分组情况
本次研究共收集入组患者228例,根据CSVD总体负担评分情况,将患者分为无/轻度(CSVD总评分0分)、中度(CSVD总评分1~2分)和重度(CSVD总评分3~4分) CSVD总体负担三组,其中无/轻度组共36例(15.79%),中度组共98例(42.98%),重度组共94例(41.23%)。颅内动脉轻度狭窄共58例(25.44%),中度狭窄66例(28.95%),重度狭窄62例(27.19%),完全闭塞共42例(18.42%)。
4.2. 不同CSVD总体负担组临床基线资料及与颅内动脉狭窄相关性分析
本次研究结果发现,不同严重程度的CSVD总体负担组,在年龄、高血压、高同型半胱氨酸等方面存在差异,并且差异具有统计学意义(P < 0.05);而在性别、吸烟史、饮酒史、糖尿病、冠心病、高脂血症、抗血小板药物应用史、BMI等方面无显著差异(见表1)。CSVD总体负担严重程度与颅内动脉狭窄程度呈正相关(见表2)。

Table 1. No/light, medium, severe CSVD overall load group clinical data comparison
表1. 无/轻、中、重度CSVD总体负担组临床资料比较
注:BMI:体质量指数;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白;LDL-C:低密度脂蛋白;Hcy:同型半胱氨酸。

Table 2. The relationship between the total burden of cerebral small vessel disease and intracranial artery stenosis
表2. CSVD总体负担严重程度与颅内动脉狭窄程度相关性
5. 讨论
2015年中国脑小血管病诊治专家共识推荐意见中特别提到“大动脉粥样硬化造成的颈部脑血管和颅内大的血管狭窄也可以合并年龄相关或高血压相关的脑小血管病” [14],近年研究发现,LAA型脑梗死患者常同时存在不同程度的脑小血管病影像学表现。CSVD起病多隐匿,但有证据表明CSVD总体负担的严重程度与卒中后残疾 [15]、卒中后复发 [16] 和卒中后幸存者的生活质量 [17] 相关,因此临床上应该重视LAA型脑梗死合并存在CSVD的情况,关注颅内动脉狭窄与CSVD总体负担相关性,进一步指导LAA型脑梗死患者的诊治。
本研究发现,在LAA型脑梗死患者中,年龄、高血压、高同型半胱氨酸水平为CSVD总体负担的影响因素,颅内动脉狭窄程度与总SVD严重程度呈正相关。目前国内外大量研究表明高龄和高血压是CSVD独立的危险因素 [18] [19]。LAA型脑梗死患者中高龄及高血压人群CSVD总体负担高可能与动脉粥样硬化造成的血管内皮损伤有关。人体丙二醛含量随年龄增长而增加,丙二醛作为花生四烯酸分解的终产物,对细胞有剧毒,可造成血管内皮功能障碍 [20]。血管内皮功能损伤可激活一系列炎症反应,促进动脉粥样硬化发展、小血管管壁破坏,细胞外基质沉积,氧化应激和一氧化氮(nitric oxide, NO)利用率降低,进一步导致CSVD发生、发展。BF Verhaaren等 [21] 研究认为高血压与多个CSVD影像学表现,如腔隙性脑梗死、脑白质病变、脑微出血发生、发展密切相关;范玉华等 [22] 认为血压变异性是CSVD明确的危险因素;本研究结果显示,高血压为CSVD总体负担的影响因素。分析原因可能是:长期高血压促使脑小血管壁脂质透明样变性和淀粉样变性,进而血管壁增厚、管腔狭窄,血流动力学发生改变,血流动力学改变又进一步导致血栓形成,长期高血压还引起血-脑屏障通透性改变,引起脑白质水肿、脑组织损伤,加重脑组织低灌注和缺血改变,引起相应CSVD影像学变化 [23]。在本次研究中,Hcy为CSVD总体负担的影响因素,但关于Hcy与CSVD相关性目前存在争议 [24],尚需要大样本研究进一步说明。在本次研究中,糖尿病、空腹血糖不是CSVD总体负担的危险因素;而Brundel M等 [25] 针对糖尿病与CSVD的研究表明,高血糖与CSVD相关。推测原因可能与本次纳入人群中糖尿病发病率较高,空腹血糖不能完全反映患者平均血糖水平有关。
既往研究认为CSVD与颈动脉粥样硬化具有相关性 [26],本研究探讨了LAA型脑梗死患者CSVD总体负担与颅内动脉狭窄的相关性,发现二者之间存在正相关关系。考虑原因可能是:① CSVD与颅内大血管病变具有共同危险因素,如高血压、糖尿病、高脂血症及吸烟等,上述危险因素促进颅内大、小血管病变的发生及发展,对二者的影响具有同步性;② 可能与大动脉严重狭窄导致的慢性低灌注状态造成远端小血管内皮功能障碍有关。发生急性缺血性卒中后,梗死灶周围会有新生血管形成及侧支循环建立。在新生血管形成早期,血管结构与功能尚不完善,血管内皮生长因子、血管生成素1、基质金属蛋白酶等表达增加导致血管通透性增加,最终导致BBB破坏 [27];③ 血液在流经动脉狭窄区后会出现血流动力学改变,形成湍流和低管壁剪切力 [28],进一步损伤血管内皮,导致脑小血管病变,并且狭窄越严重,血流动力学改变越明显,因此CSVD总体负担严重程度与颅内动脉狭窄程度呈现正相关。
6. 总结
综上所述,LAA型脑梗死患者CSVD总体负担严重程度与颅内动脉狭窄程度呈正相关。但关于颅内大血管病变与脑小血管病共同发生、发展机制,仍需要进一步研究。探讨LAA型脑梗死患者脑小血管病总体负担与颅内动脉狭窄相关性,对LAA型脑梗死患者急性期及二级预防治疗中抗栓药物选择、出血转化及预后评估具有重要指导意义。
NOTES
Email: ytlkwangyulan@163.com