摘要: 目的:应用生物信息学方法,研究冻结肩与肩关节不稳患者关节囊基因表达谱芯片数据,挖掘冻结肩关节囊中关键表达的基因。方法:选择GEO数据库中冻结肩基因表达谱芯片数据集(GSE140731),筛选出冻结肩及肩关节不稳两组患者数据中的差异表达基因。将GO和KEGG分析应用于冻结肩中差异表达基因,并利用STRING和Cytoscape软件构建蛋白质–蛋白质相关作用网络(PPI)。结果:冻结肩患者关节囊中有545个差异表达基因,其中上调420个,下调125个。对差异基因进行GO富集分析,发现差异基因的生物学功能及分子功能主要富集在炎症反应、细胞对TNF及IL-1的反应、细胞外基质分解与重构,细胞因子及趋化因子活化、细胞黏附。KEGG信号通路富集分析表明这些差异基因主要与PI3K/Akt、细胞因子与细胞因子受体间相互作用、细胞外基质与受体间相互作用等信号通路有关。PPI分析筛选了3个关键基因:IL6、COL1A1、COL1A2。结论:应用生物信息学分析冻结肩患者关节囊中基因表达谱发现,炎症反应及纤维化机制在冻结肩的发病过程中发挥重要作用并揭示了潜在的关键调控基因及相关信号通路。
Abstract:
Objective: By applying bioinformatics methods, to investigate differential genes (DEGs) between frozen shoulder and shoulder instability. Method: The raw gene expression data was downloaded from the Gene Expression Omnibus (GEO) database. Go and KEGG analysis were applied for differentially expressed genes in frozen shoulder, and a protein-protein interaction (PPI) network was constructed using STRING and Cytoscape software. Result: A total of 545 DEGs were obtained, of which 420 genes were up-regulated and 125 genes were down-regulated in frozen shoulder. GO showed that the biological function and molecular function of DEGs were mainly involved in inflammatory response, cell response to TNF and IL-1, extracellular matrix decomposition and remodeling, activation of cytokines and chemokines, and cell adhesion. KEGG pathway involved PI3K/Akt pathway, protein digestion and absorption, ECM-receptor interaction, cytokine-cytokine receptor interaction, focal adhesion. Three hub genes were recognized by PPI analysis, including IL6, COL1A1, COL1A2. Conclusion: Bioinformatics analysis of gene expression profiles in the frozen shoulder patients revealed that inflammatory response and fibrosis mechanisms play an important role in the pathogenesis of frozen shoulder and revealed potential key regulatory genes and related signaling pathways.
1. 引言
冻结肩(frozen shoulder, FS),是一种以肩关节主动和被动活动度显著下降并伴有疼痛为特征的疾病 [1] [2]。到目前为止,冻结肩的发病机制虽尚不明确,但通常认为其发病是炎症和纤维化共同作用的结果 [3]。FS患者肩关节囊内增生的成纤维细胞产生含有大量致密胶原(COL)的细胞外基质(ECM),可导致关节囊的纤维化,从而限制肩关节活动范围 [4] [5]。而基质金属蛋白酶(MMP)能够降解ECM,调节成纤维细胞产生的细胞外基质的重构 [6]。目前FS没有标准的治疗方案,常见的非手术治疗包括药物治疗、康复锻炼等。药物治疗主要以对症止痛为主,从而帮助患者达到更好的康复锻炼效果。但这些治疗方式不能从根本上解决患者肩关节囊纤维粘连的情况,且治疗周期长,关节活动度不能完全恢复。手术治疗以肩关节松解为主,这种手术方式虽然能够使纤维粘连的关节囊松解,但费用及术后疼痛等因素加重患者的负担 [7]。
因此,深入探索FS发病的分子机制及信号通路,对于寻找阻断FS病程,加速FS患者患肩功能康复的新的治疗方法具有重要临床意义。本研究通过分析FS患者的基因表达谱,探究其发病机制中可能的关键基因及相关信号通路。
2. 资料与方法
2.1. 资料来源
查阅基因表达数据库(GEO) (http://www.ncbi.nlm.nih.gov/geo),获得基因芯片数据GSE140731,芯片数据是基于GPL96 平台的Affymetrix Human Genome U133A Array所获得的人全基因转录本生物信息,包含26例FS和22例肩关节不稳(SI)患者的关节囊组织的转录组学数据。
2.2. 方法
1) 使用R语言软件的DESeq2包对原始数据进行统计学分析,设定条件为FDR (false-discovery rate) P-value < 0.05,LFC (log2 fold change)的截断值 < −1.5和>+1.5,并将最终的得到的差异基因绘制热图。
2) 基因本体(GO)分析是一个生物信息学分析的经典方法,该方法通常被用来描述基因或基因产物在体内的正常生物学作用。基因组百科全书(KEGG)是一个数据可集合,通常被用来揭示差异基因潜在的作用。使用DAVID在线分析软件(https://david.ncifcrf.gov/)对筛选出的差异表达基因进行GO和KEGG通路富集分析。采用sangerbox单基因数据分析平台(http://sangerbox.com/)绘制KEGG通路和GO富集分析图。
3) 使用STRING数据库(STRING, http://string-db.org)对差异基因编码的蛋白进行蛋白互作网络(PPI)分析(置信度 > 0.7),并将结果导入Cytoscape (3.7.2)软件中形成PPI图。
2.3. 统计学方法
差异基因利用t检验的P值和差异倍数值进行筛选,筛选的标准为上调或者下调差异倍数 > 1.5且P < 0.05。
3. 结果
1) 对比FS和SI患者的肩关节囊组织,获得545个差异表达基因,其中上调420个,下调125个。根据FDR值,将前100个差异基因绘制热图(图1),可见FS组基因均为上调。
2) 对差异基因进行GO富集分析,发现差异基因的生物学功能及分子功能主要富集在细胞黏附、炎症反应、细胞对TNF及IL-1的反应、细胞外基质分解与重构,细胞因子活化、趋化因子活化。
① 差异基因主要的生物学过程(图2)主要包括细胞粘附(cell adhesion)、细胞外基质组织(extracellular matrix organization)、炎症反应(inflammatory response)、骨骼系统发育(skeletal system development)、细胞对肿瘤坏死因子的反应(cellular response to tumor necrosis factor)、细胞外基质分解(extracellular matrix disassembly)、胶原原纤维组织(collagen fibril organization)、细胞对白细胞介素-1的反应(cellular response to interleukin-1)及软骨内骨化(endochondral ossification)有关。
② 差异基因参与的分子功能(图3)主要为钙离子结合(calcium ion binding)、金属内肽酶活化(metalloend-opeptidase activity)、肝素结合(heparin binding)、细胞因子活化(cytokine activity)、细胞外基质结构组成(extracellular matrix structural constituent)、金属肽酶活化(metallopeptidase activity)、鸟苷–核苷酸交换因子活性(rasguanyl-nucleotide exchange factor activity)、趋化因子活化(chemokine activity)、细胞外基质结合(extracellular matrix binding)及血小板衍生生长因子结合(platelet-derived growth factor binding)。
3) 差异表达基因的PPI包含212个节点。节点的度值表示相互作用的节点的个数,节点颜色的深度与节点度值呈正比关系。将节点度值 > 25作为筛选关键基因的标准,共筛选出3个关键基因(图4):IL6、COL1A1、COL1A2。
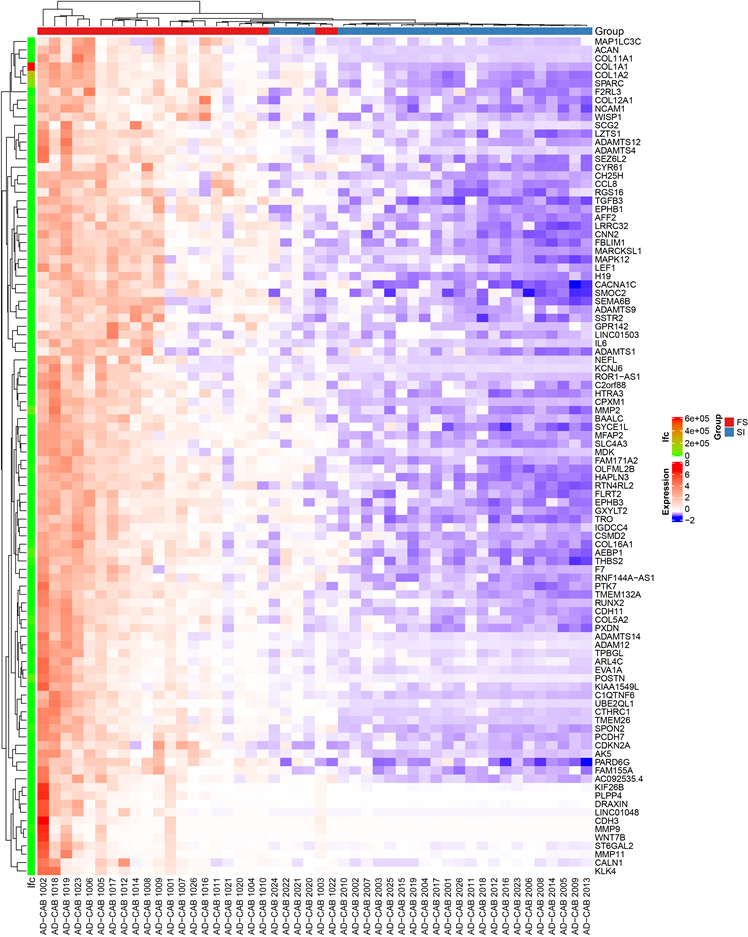
Figure 1. Heat maps of differentially expressed genes
图1. 差异表达基因的热图

Figure 2. The differentially expressed genes in the articular capsule of the two groups were mainly involved in the biological process
图2. 两组患者关节囊中差异表达基因主要参与的生物学过程
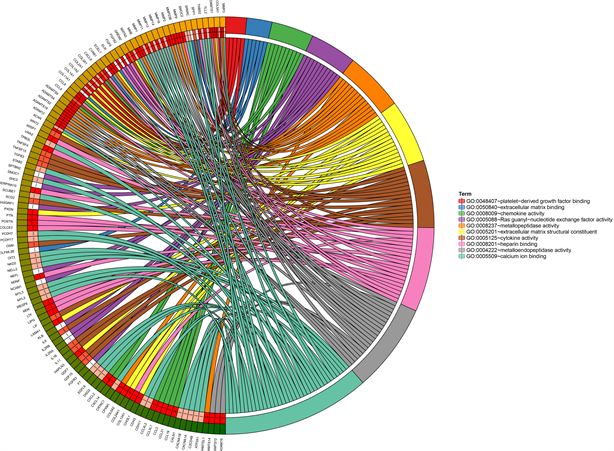
Figure 3. The major molecular functions of genes differentially expressed in the articular capsule between the two groups of patients
图3. 两组患者关节囊中差异表达基因主要的分子功能
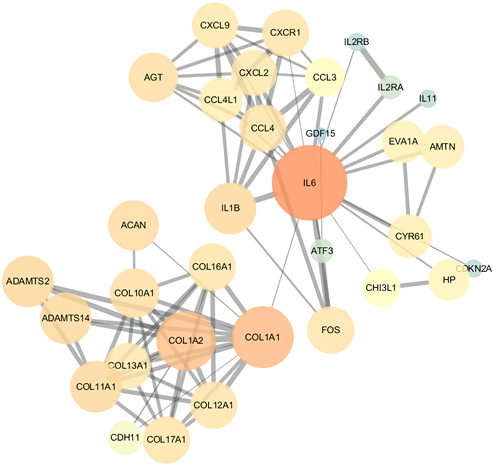
Figure 4. Protein interaction network diagram of differentially expressed genes
图4. 差异表达基因的蛋白互作网络图
4) 对差异基因进行KEGG通路分析,结果表明它们主要富集在PI3K/Akt等信号通路(PI3K/Akt pathway)、蛋白质消化与吸收(protein digestion and absorption)、细胞外基质与受体间相互作用(ECM-receptor interaction)、细胞因子与细胞因子受体间相互作用(cytokine-cytokine receptor interaction)、细胞的焦点粘连(focal adhesion)等通路上(图5)。
5) 对富集在PI3K/Akt信号通路中的基因做火山图分析(图6),可见炎症因子(IL-6、IL-2)、胶原蛋白(COL)等上调,而VEGFD、FGF9及PCK1下调。
4. 讨论
目前医学界对于FS发病机制的观点尚不统一,但以炎症反应机制和纤维化机制为主,其他还有神经炎症机制和内分泌机制 [8]。因为没有明确的发病机制及病理过程,FS的临床治疗相关研究进展亦十分缓慢。近年来,基因芯片技术被广泛应用于研究疾病的发病过程及分子机制,通过深入分析FS患者关节囊的基因芯片数据,有助于阐明FS的发病机制及寻找新的治疗方向。
本研究通过对GSE140731基因芯片数据进行分析,获得FS和SI患者关节囊组织中由545个差异表达基因,其中上调420个,下调125个。对差异基因进行GO富集分析,发现差异基因的生物学功能及分子功能主要富集在炎症反应、细胞对TNF及IL-1的反应、细胞外基质(ECM)分解与重构,细胞因子及趋化因子活化。组织学上,冻结肩关节囊组织的特征是成纤维细胞、肌成纤维细胞和慢性炎症细胞,包括肥大细胞、t细胞、b细胞和巨噬细胞 [9] [10]。其中最主要的细胞类型仍然是成纤维细胞,这证明在冻结肩的发病过程中,纤维化机制发挥了重要作用 [11] [12] [13]。另外,炎性因子通常包括IL-1、IL-6、IL-8、TNF-α等,这些炎症因子在炎症反应过程和胶原分解代谢中起重要作用 [5]。而炎症因子异常产生引起的炎症级联反应参与了冻结肩的纤维化和非自然组织修复 [14]。并且,这些炎症因子已经被证明在冻
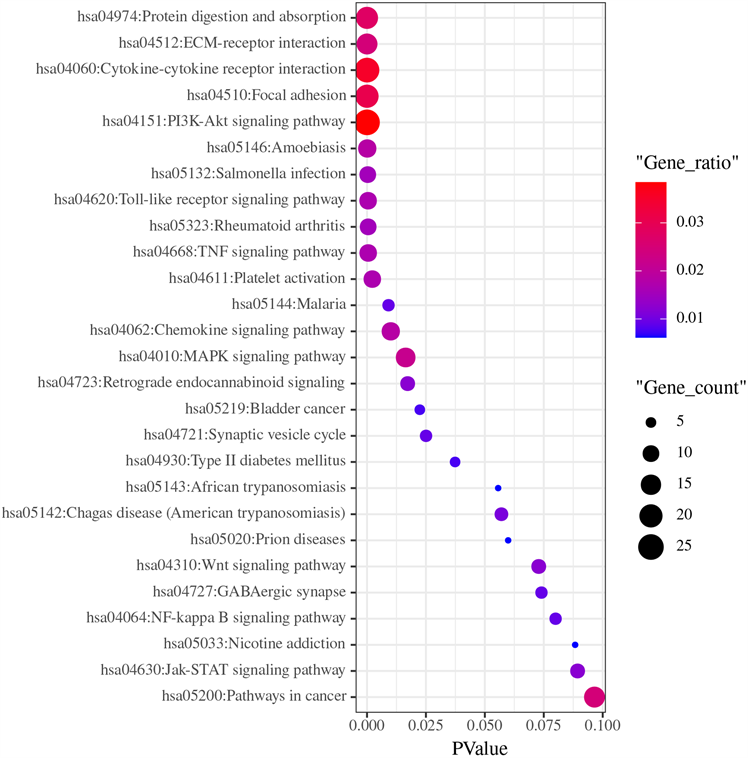
Figure 5. KEGG pathway analysis of differentially expressed genes in the articular capsule of the two groups of patients.
图5. 两组患者关节囊中差异表达基因的KEGG通路分析
结肩患者关节囊 [13] 及肩峰下囊组织 [12] 中高表达,因此,炎症反应机制在冻结肩发病的过程中起到重要调控作用。另外,在纤维化的进程中,细胞外基质(ECM)常常被认为是驱动因素 [11]。ECM的分解与重构由基质金属蛋白酶(MMPs)及其组织金属蛋白酶抑制剂(TIMPs)控制 [10]。MMPs的合成和活化是由TIMPs、细胞因子和生长因子控制的 [15]。部分研究报道,MMPs和TIMPs的异常表达可能导致冻结肩胶原重构失败 [5] [16] [17]。
通过PPI,将节点度值 > 25作为筛选关键基因的标准,共筛选出3个关键基因:IL6、COL1A1、COL1A2,在冻结肩患者中均上调。IL-6、基质金属蛋白酶(MMPs)在冻结肩的发病机制中已多有研究 [18] [19]。胶原蛋白(COL)占机体总蛋白质的30%,是ECM的主要结构成分 [20]。有研究对冻结肩患者关节囊组织标本进行免疫组化研究,与对照组对比,I型与III型胶原大量合成,III型胶原显示强阳性,反应细胞外基
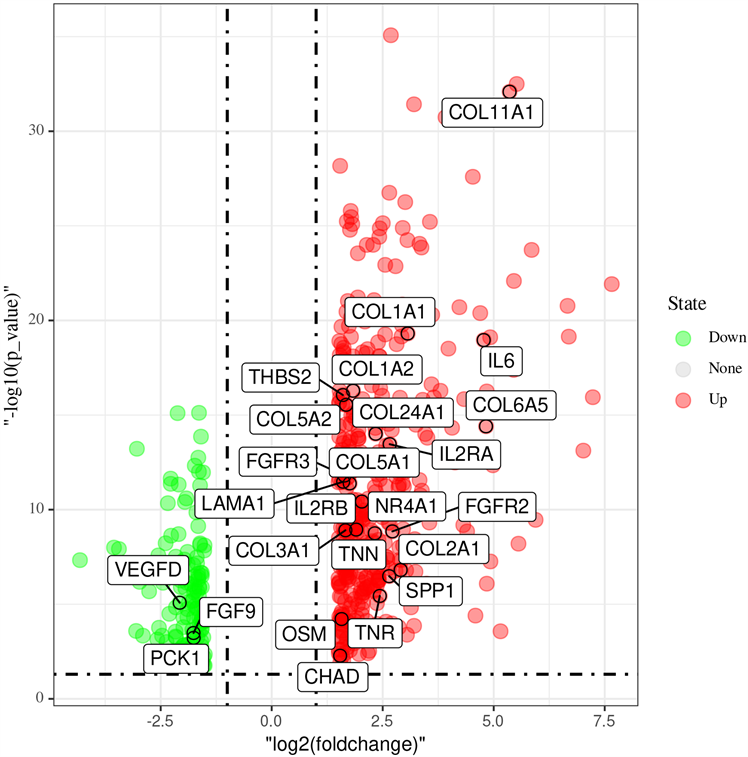
Figure 6. Differential genes enriched in PI3K/Akt signaling pathway
图6. 富集在PI3K/Akt信号通路中的差异基因
质中新的胶原沉积 [13]。这与本研究筛选出COL1A1、COL1A2、COL3A1在冻结肩患者中上调的结果相一致。通过PPI分析,发现炎症反应及纤维化机制在冻结肩发病机制中,均发挥重要作用,这与之前GO分析结果相同。
通过KEGG通路富集分析,发现差异基因主要参与PI3K/Akt信号通路、ECM与受体间相互作用、细胞因子与细胞因子受体间相互作用、细胞的焦点粘连、蛋白质消化与吸收等信号通路。其中ECM及细胞因子在冻结肩发病过程中的作用机制前文中已阐明。而PI3K/Akt信号通路与冻结肩发病相关的研究尚未见报道。PI3K-Akt信号通路广泛作用于人体各个组织器官中,与肝纤维化及肺纤维化中的成纤维细胞增殖分化密切相关 [21] [22]。PI3K (磷酯酰肌醇3激酶)是一种信号转导酶,使PI (4,5) P2磷酸化形成PI (3,4,5) P3,与Akt结合形成复合体,复合体与PDK1结合可促进Akt的氨基酸末端的PH结构域磷酸化,从而激活下游中的HIF-1α、mTOR等因子来参与成纤维细胞的增殖、分化 [23]。在KEGG通路富集分析中,共25个基因参与PI3K/Akt信号通路,其中COL1A1、COL2A1、COL1A2、COL3A1、COL5A1、COL5A2、IL6等纤维化及炎症反应相关基因均上调,表明在冻结肩发病过程中,该通路可能在纤维化及炎症反应过程中发挥重要作用。结合本研究的PPI结果,发现冻结肩发病的关键基因均在PI3K/Akt信号通路中高表达,因此本研究的结果首次揭示PI3K/Akt信号通路在冻结肩发病过程中发挥重要作用的可能,为后续的研究提供新的方向。
5. 结论
应用生物信息学分析FS患者关节囊中基因表达谱发现,炎症反应机制及纤维化机制在冻结肩的发生发展中起重要作用。同时,本研究发现了FS发病过程中潜在的关键基因及信号通路。