1. 引言
2020年全球最新癌症负担数据中显示肺癌死亡率仍居所有癌种首位。在非小细胞肺癌(Non-small-cell lung carcinoma, NSCLC)中,腺癌的EGFR突变率在15%~60%之间,亚洲人群中报告的百分比高于西方人群 [1]。表皮生长因子受体–酪氨酸激酶抑制剂(Epidermal growth factor receptor-tyrosine-kinase inhibitor, EGFR-TKIs)通常推荐用于EGFR突变的晚期NSCLC患者或术后复发NSCLC患者。临床试验表明,EGFR-TKIs比标准化疗提供更好的无进展生存期 [2] [3]。埃克替尼是中国自主研发的一代TKIs。III期ICOGEN研究表明埃克替尼与吉非替尼有着相似的疗效 [4];与厄洛替尼、吉非替尼相比,埃克替尼具备更好的安全性 [5]。靶向药物单药治疗时作用有限,更多研究探索其在联合治疗时的优势,以进一步指导治疗临床实践 [6] [7] [8]。本研究分析了真实世界中一代TKIs治疗晚期或局部晚期不可切EGFR突变阳性肺腺癌患者的生存数据,探索不同治疗方案的疗效及安全性,为制定更加精准的临床治疗策略提供依据。
2. 资料和方法
2.1. 临床资料与研究对象
分析了青岛大学附属青岛市中心医院和青岛大学附属医院自2008年8月至2017年4月收治的80名晚期不可手术肺腺癌患者,所有患者均已签署知情同意书。所有患者经分子病理学检测或二代基因检测(NGS)检测确定的EGFR基因突变患者(包括21外显子L858R突变或19外显子突变),且均为接受埃克替尼一线单药或联合治疗。排除标准:ECOG PS评分 > 2分;合并其他组织来源或其他病理类型的恶性肿瘤;患有严重不能控制的系统疾病。
2.2. 数据收集整理和随访
临床资料包括年龄、性别、分期、吸烟史、既往病史、手术史、发生进展的部位、治疗方式、不良事件、患者确诊时间、开始服用埃克替尼的时间、疾病进展时间、死亡时间、疗效评价等。
通过青岛大学附属医院和青岛大学附属青岛市中心医院随访中心数据库、门诊或住院病历查询系统随访大部分患者;对数据库和病历系统中缺少随访信息的患者通过电话、信件等方式完善相关数据。本研究随访截止时间为2021年3月31日。
2.3. 疗效评价标准
采用RECIST 1.1实体瘤疗效评定标准评价近期疗效,共分为完全缓解(Complete response, CR),部分缓解(Partial response, PR),疾病稳定(Stable disease, SD),疾病进展(Progressive disease, PD),客观反应率(Objective response rate, ORR) = (CR + PR)/总例数 × 100%,疾病控制率(Disease control rate, DCR) = (CR + PR + SD)/总例数 × 100%。无进展生存期(PFS)是指开始接受埃克替尼治疗到疾病进展或因任何原因死亡(以先发生者为准)之间的时间。在数据截止时间尚未进展或死亡的患者以末次随访日期进行统计。总生存期(OS)是指首次确诊到任何原因死亡之间的时间。最后一次随访时仍存活的病例,按照截止时间数据进行统计。不良事件(Adverse events, AEs)评价由美国国家癌症研究所不良事件通用术语标准(CTCAE,版本5.0)进行确定和分级。
2.4. 统计学处理
应用SPSS 22.0版本进行数据分析。应用Cox风险比例回归模型对PFS、OS进行多因素分析;采用Kaplan-Meier法对中位生存期的影响因素进行单因素分析;采用log rank检验比较各亚组的生存曲线。采用χ2检验和Fisher精确检验分析ORR和DCR。本研究所用统计推断均为双侧检验,P < 0.05为差异有统计学意义。
3. 结果
3.1. 临床病理学特征
按照入排标准,共筛选出80例EGFR基因突变阳性且经埃克替尼一线治疗的晚期或局部晚期不可手术肺腺癌患者。IIIB期患者10例,IV期患者70例。临床病理学特征详见表1。

Table 1. Clinicopathological features of patients included with advanced unresectable EGFR mutation-positive lung adenocarcinoma
表1. 晚期不可切除EGFR突变阳性肺腺癌患者临床病理学特征
3.2. 肿瘤反应
截至随访结束,80例患者中共59例疾病进展,死亡16例。中位无进展生存期为36.5个月(95% CI: 22~54.8) (图1),3年PFS率为56.25%,5年PFS率为16.25%。中位生存期为69个月(95% CI: 55.3~90) (图2),3年OS率为100%,5年OS率为72.5%。经一线埃克替尼单药或联合治疗后总体患者DCR为97.5%,ORR为77.5%。不同治疗方案之间的客观缓解率和疾病控制率差异无统计学意义(表2)。

Table 2. The difference analysis of the objective remission rate and the disease control rate
表2. 客观缓解率和疾病控制率差异性分析
注:CR:Compelte response,完全缓解;PR:Partial response,部分缓解;SD:Stable disease,疾病稳定;PD:Progressive disease,疾病进展;ORR:Objective response rate,客观反应率;DCR:Disease control rate,疾病控制率。

Figure 1. Analysis of mPFS in 80 patients with advanced or locally advanced unresectable EGFR-mutation-positive NSCLC (mPFS: median progression-free survival; NSCLC: Non-small- cell lung cancer)
图1. 80例晚期或局部晚期不可手术切除EGFR突变阳性患者中位无进展生存期分析(mPFS: median progression-free survival; NSCLC: Non-small-cell lung cancer)

Figure 2. Analysis of mOS in 80 patients with advanced or locally advanced unresectable EGFR-mutation-positive NSCLC (mOS: median overall survival; NSCLC: Non-small-cell lung cancer)
图2. 80例晚期或局部晚期不可手术切除EGFR突变阳性患者中位总生存期分析(mOS: median overall survival; NSCLC: Non-small-cell lung cancer)
3.3. 无进展生存期和总生存期分析
中位无进展生存期为36.5个月(95% CI: 22~54.8),中位总生存期为69个月(95% CI: 55.3~90)。Kaplan-meier法分析结果晚期不可手术肺腺癌患者中,联合放疗组患者的中位PFS显著高于联合化疗组或单药治疗组(P = 0.018) (图3) (表3),不同治疗方式患者的中位OS无显著性差异(图4)。应用Cox模型多因素回归分析的方法统计手术史(HR: 0.10, 95% CI: 0.02~0.48, P = 0.004)和分期(HR: 17.16, 95% CI: 1.03~185.22, P = 0.047)是晚期不可手术患者OS的独立影响因素。
3.4. 5年生存率
局部晚期及晚期(IIIB~IV期)不可手术EGFR突变阳性肺腺癌患者中,总体人群5年生存率为72.5%,单药治疗组患者的5年生存率为61.5%,联合化疗组为72%,联合放疗组为82.5%,差异无统计学意义(P = 0.206)。术后患者的5年生存率明显高于未行手术者且差异有统计学意义(85.7% vs. 51.9%, P = 0.006)。一线治疗后发生进展的患者中,换用三代靶向药物的患者的5年生存率高于加量服用埃克替尼的患者,差异无统计学意义(P = 0.524) (表4)。

Table 3. Prognostic factors of PFS
表3. PFS预后影响因素

Figure 3. Comparison of mPFS between treatment subgroups (mPFS: median progression-free survival)
图3. 不同治疗亚组之间患者的中位无进展生存期比较(mPFS: median progression-free survival)
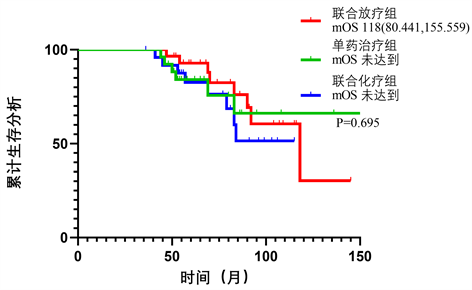
Figure 4. Comparison of mOS between treatment subgroups (mOS: median overall survival)
图4. 不同治疗亚组之间患者的中位总生存期比较(mOS: median overall survival)

Table 4. The difference analysis of the 5-year survival rate
表4. 5年OS率的差异性分析
3.5. 安全性与不良事件
药物相关不良反应事件(AEs)总发生率为50%,联合放疗组不良事件的发生率为55.2%,联合化疗组为52%,单药治疗组为42.3%。单药治疗组中最常见的不良事件为皮疹和口腔溃疡;联合化疗组和联合放疗组中最常见的不良事件是骨髓抑制和皮疹。没有观察到4级不良事件或相关死亡事件。没有患者因不良事件减少药物剂量或停药(表5)。
4. 讨论
这是一项关于中国局部晚期及晚期(IIIB~IV期)不可手术切除的EGFR突变阳性肺腺癌患者一线服用一代TKIs治疗后的疗效和安全性的真实数据分析。所有患者总生存期均达到3年或以上。对于病变可切除的、可手术NSCLC患者,最佳有效的治疗方法是根治性切除手术 [9]。肿瘤复发一直是术后肿瘤不能控制而死亡的主要原因,约50%~60%的I~IIIA期NSCLC患者术后出现肿瘤复发 [10]。在不可手术的局部晚期及晚期(IIIB~IV期)非小细胞肺癌(NSCLC)或多原发性肺癌(Multiple primary lung cancers, MPLC)患者中,最新研究发现立体定向放射技术可以提供局部控制和和接近手术切除的治疗效果,同时较围手术期安全性更高且成本更低 [11] [12]。对于EGFR阳性的MPLC患者中,高达45%的患者可能出现EGFR相同或不同的磨玻璃密度灶,尽管异质性分子事件可能导致不同的反应,靶向治疗联合立体定向放射治疗仍为不能手术的NSCLC或MPLC患者提供了一种替代治疗策略 [13]。
靶向治疗在24个月后的受益持续时间有限。尽管TKIs最初疗效显著,由于分子特征变化(尤其是T790M的发生),而出现耐药并形成影像学的进展,最终患者在TKI治疗约一年后出现疾病进展(临床进展)。本研究中埃克替尼应用于EGFR突变阳性的不可手术肺腺癌患者,结果显示:总体DCR为97.5%,ORR为77.5%。其中单药TKI治疗者ORR达69.2%,与IPASS研究亚组中吉非替尼治疗EGFR突变的NSCLC 亚洲患者ORR为71.2%的结果相似 [14] [15]。通过分析结果发现,不可手术的EGFR突变阳性肺腺癌患者中,相较于单药或联合化疗,联合放疗组患者无进展生存期更长。在临床实践中,靶向治疗通常与同步放化疗相结合,在局部不可手术NSCLC放化疗后的维持治疗中可延长无转移患者的PFS和OS。伴有脑转移的IV期NSCLC患者中,全脑放疗联合靶向治疗组平均生存时间优于同步放化疗组,疗效更为显著且安全性更好 [16]。脑转移和放疗可破环血脑屏障的完整性,增加其通透性,导致TKIs入脑浓度增加,减少EGFR野生型NSCLC细胞对放疗的耐药,增加EGFR突变型NSCLC细胞对放疗的敏感性 [17] [18]。此外,随着免疫佐剂在提高机体抗肿瘤能力的优势凸显下,更多的联合治疗方式被探索。Ye Qiu等人 [19] 应用埃克替尼联合放疗以及重组人粒细胞巨噬细胞刺激因子皮下注射治疗不可手术NSCLC患者疗效显著,提高自身免疫功能且不良反应无明显差异。最佳组合方式、治疗时机与放疗剂量的确定还有待进一步探索。
在安全性方面,无论是作为二线及以上治疗,还是作为一线治疗,埃克替尼均具有良好的安全性和耐受性,仅少数患者因不良反应而停止治疗 [20] [21]。本研究中,埃克替尼联合其他治疗时不良反应的发生率总体高于单药治疗。既往研究表明皮疹的发生与疗效有关 [22],皮疹高发生率也可能与本研究中100%的患者有EGFR突变有关,这也符合IPASS的研究结果。
本研究的局限性在于选择偏倚的可能性、不同研究之间对疾病进展定义不一致,以及回顾性分析自身存在的限制性。目前靶向治疗联合放化疗、抗血管生成治疗应用于EGFR突变的NSCLC的研究众多,免疫治疗登上新的舞台后,有研究发现免疫治疗应用于EGFR-TKIs耐药后或脑转移的患者疗效良好 [23]。免疫治疗或许是EGFR-TKIs耐药后的NSCLC患者的潜在选择,从而在恶性肿瘤慢性病化的过程中迈出新的一步。
综上所述,对于不可切的局部晚期或晚期EGFR突变的肺腺癌患者的治疗,一代TKIs仍是一种有效且安全的靶向药物,且在此基础上联合放疗疗效更佳,可提高5年生存率和治愈率,大幅度延长无进展生存期,提高晚期患者的生存质量,是局部晚期或晚期EGFR突变的NSCLC患者的规范治疗模式和组合。
NOTES
*第一作者。
#通讯作者。