摘要: 妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia, GTN)是一组与妊娠相关、起源于胎盘滋养细胞的恶性肿瘤,其中包含以下几种:侵袭性葡萄胎(invasive mole, IM)、绒毛膜癌(choriocarcinoma, CCA)、上皮性滋养细胞肿瘤(epithelial trophoblastic tumor, ETT)和胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor, PSTT)。随着有效化疗药物的临床应用,GTN临床治愈率达到了90%以上,但仍有10%对化疗药物不敏感的耐药患者,但目前国内外仍缺乏对耐药性GTN的诊断与治疗标准。本文对我院收治的1例低危耐药型侵蚀性葡萄胎病例进行临床分析,就其诊断、治疗、随访及转归情况,结合相关文献进行讨论,以总结经验,指导临床工作。
Abstract:
Gestational trophoblastic tumor (GTN) is a group of malignant tumors related to pregnancy and originated from placental trophoblasts, including invasive mole (IM), choriocarcinoma (CCA), epithelial trophoblastic tumor (ETT) and placental site trophoblastic tumor (PSTT). With the clinical application of effective chemotherapeutic drugs, the clinical cure rate of GTN has reached more than 90%, but there are still 10% drug-resistant patients who are not sensitive to chemotherapeutic drugs. However, there is still a lack of diagnostic and treatment standards for drug-resistant GTN at home and abroad. This paper makes a clinical analysis of a case of low-risk drug-resistant invasive mole treated in our hospital, and discusses its diagnosis, treatment, follow-up and prognosis in combination with relevant literature, so as to summarize experience and guide clinical work.
1. 临床资料(已获得患者知情同意)
患者,女,24岁,以“葡萄胎清宫术后3月余,阴道不规则流血8天”之主诉入院。平素月经规律,初潮16岁,未婚有性生活史,孕1产0,既往因个人因素于孕5月引产1次。2019-11-11因外院B超提示葡萄胎待排并行清宫术,术后复查血HCG:40,981 mIU/ml,术后病理提示:宫腔水泡状胎块,建议术后每周复查血HCG及B超,患者未遵医嘱。分别于2019-12-08、2020-01-13月经来潮1次,2020-02-14自测尿HCG阳性,遂就诊于我院行B超提示:子宫体大小58 * 41 * 44 mm,形态规则,子宫肌层内可见范围约62 * 38 * 37 mm不规则无回声,CDFI显示:其内部可见丰富五彩团状血流信号,频谱为动静脉瘘频谱,RI = 0.50。宫内膜厚约3 mm,子宫颈大小、形态、回声均未见明显异常。提示:子宫肌层内不规则无回声区,滋养细胞疾病待排,动静脉瘘形成。门诊以“滋养细胞疾病待排”收住院。入院后复查HCG 50,253.68 mIU/ml,胸部CT平扫:1) 左肺下叶外基底段结节影,转移瘤?2) 右肺下叶后基底段部分支气管血管束稍粗,周围少许点状稍高密度影;头颅CT示:脑实质内未见确切异常;盆腔MRI检查示:子宫肌层弥漫异常信号并丰富血管,结合病史,多考虑滋养细胞肿瘤。结合病史及辅助检查,初步诊断:侵蚀性葡萄胎(III:4)。排除禁忌症后,于2020-03-01给予化疗,具体化疗方案见表1,化疗后血HCG结果见图1。II程化疗后1周复查血HCG 32,628.06 mIU/ml,复查B超:子宫体大小85 × 62 × 39 mm,形态规则,宫体左侧至宫颈肌层内可见范围约77 × 57 × 32 mm混合回声,内可见不规则无回声区,CDFI显示:其内部可见丰富五彩团状血流信号,宫内膜厚约2 mm。提示:宫体左侧至宫颈肌层内所见,考虑:滋养细胞疾病。目前患者放线菌素D单药化疗II程后血HCG下降不理想,B超提示宫体左侧至宫颈肌层内可见范围约77 × 57 × 32 mm混合回声较前增大,考虑单药治疗效果不佳,经科内讨论后建议更换治疗方案为FAV联合化疗方案III程化疗,具体见表1,化疗后血HCG结果见图1。2个疗程化疗后患者血HCG下降后再次升高,考虑患者对此化疗方案耐药,讨论后更换化疗方案为EMA/CO方案V程化疗,具体见表2,化疗后血HCG结果见图1。2次化疗后患者血HCG降至正常,继续给予3次EMA/CO方案巩固化疗。现随访1年,患者未见复发。患者在应用EMA/CO方案化疗期间,出现骨髓抑制,肝功能损害,口腔溃疡等,均给予对症处理后好转。
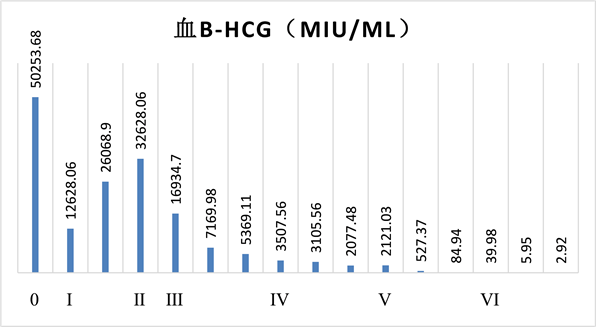
Figure 1. Blood β-HCG change during chemotherapy
图1. 化疗过程中血β-hCG变化

Table 2. EMA-CO chemotherapy regimen
表2. EMA-CO化疗方案
2. 讨论
2.1. 关于低危型GTN
妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia, GTN)是一组与妊娠相关、起源于胎盘滋养细胞的恶性肿瘤,其中包括以下几种:侵袭性葡萄胎(invasive mole, IM)、绒毛膜癌(choriocarcinoma, CCA)、上皮性滋养细胞肿瘤(epithelial trophoblastic tumor, ETT)和胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor, PSTT) [1]。根据国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)妇科肿瘤委员会2000年制定的解剖分期和2002年修正的改良预后评分系统,将GTN分为两种:低危型和高危型。临床工作中,我们常根据FIGO分期,将I~III期且FIGO ≤ 6分的GTN被定义为低危型GTN,IV期或评分 > 6分被定义为高危型GTN [2]。
2.2. 关于耐药型GTN的诊断标准
在化疗药物应用于临床之前,滋养细胞肿瘤的死亡率非常高,其中以绒毛膜癌死亡率最高,随着有效化疗药物的临床应用,患者的治疗效果也得到了显著改善,目前治愈率高达到90%以上 [3],而其余10%难以治愈的GTN通常是对化疗药物不敏感的耐药患者。目前对GTN的诊断及治疗标准绝大多数是针对化疗药物敏感的患者,所以目前国际上尚缺乏对于耐药型GTN的统一诊断标准,缺乏专家共识及相关指南。但根据大量文献报道,在化疗过程中出现以下情况之一即可诊断为耐药型GTN。
1) 血清β-人绒毛膜促性腺激素(β-hCG)下降不满意。有关血清β-hCG下降不满意的定义及观察疗程数尚无专家共识,大多数学者认为,化疗过程中应该每周监测血清β-hCG,在经过1个疗程的化疗之后,下一疗程化疗前血清β-hCG未呈对数下降,则提示有耐药可能,如果经过2个疗程的化疗后,血清β-hCG的下降仍未达到一个对数,则为耐药 [4]。也有一些学者认为,至少接受过2个疗程的联合化疗,在化疗期间或停止化疗后的3个月内,每周监测β-hCG水平,至少连续 3 周出现平台或连续 2 周出现升高,则为耐药 [5]。
2) 影像学检查。原有的病灶增大,或出现新的转移病灶。
2.3. 耐药GTN的高危因素
1) 化疗前高hCG水平。Taylor等 [6] 对289例的低危型GTN进行了研究,在研究中发现,血hCG > 105 IU/L的耐药率为83%,而血hCG ≤ 105 IU/L的耐药率是34% (P ≤ 0.0001)。Mousavi等 [7] 也对168例低危GTN单药化疗后耐药相关因素进行了研究,发现化疗前血hCG ≥ 105 IU/L的患者耐药风险比血hCG < 105 IU/L的患者耐药风险高了5倍(OR = 5.86, 95% CI: 1.07~32.02, P = 0.041)。
2) 有转移病灶,结合解剖分期,在FIGO评分系统中低危GTN评分似乎与转移无明显关系,而与转移灶的数目相关。欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO) GTN指南也指出:低危GTN初始化疗后肺部以及子宫的病灶并不是复发的危险因素,甚至不需要进行手术切除 [8],然而,多项研究表明有转移病灶与低危GTN单药化疗后的耐药、复发有着密切关系。Hasanzadeh等 [9] 在对一项117例低危GTN患者的研究中发现,81%的无转移病灶的患者获得缓解,而发生转移的患者(转移至肺或阴道)完全缓解率仅仅只有43% (P = 0.001)。
3) FIGO评分分值与低危GTN耐药关系。大量研究表明,在低危GTN患者中,随着FIGO预后评分的增高,其缓解率明显下降,而耐药率明显上升。Sita-Lumsden等 [10] 在一项研究中发现,557例FIGO评分为0~7分的患者中(评分7分者3例),在接受甲氨蝶呤–四氢叶酸(MTX-FA)初始化疗后,FIGO评分0~1分的耐药率为25%,评分为2分患者的耐药率为33%,3~5分的患者耐药率是50%,而评分6分的患者的耐药率则达到了69%。Mousavi等 [11] 对168例低危GTN患者进行了研究,也发现FIGO评分5~6分者的耐药率是评分 ≤ 4分患者耐药率的14倍(OR = 14.28, 95% CI: 5.54~36.81)。
4) 临床或病理诊断为绒毛膜癌。Davis等 [12] 在一项358例患者的研究中发现,临床或病理诊断为绒毛膜癌患者与非绒毛膜癌患者的耐药率分别是31%、17% (P = 0.028)。
2.4. 低危耐药葡萄胎的治疗现状
滋养细胞肿瘤(GTN)治疗原则是以化疗为主,辅以手术和放疗等其他治疗手段。因为其对化疗的高度敏感性,目前也是预后最好的恶性肿瘤之一 [13],即使存在广泛转移,也仍可获得高于90%的治愈率 [14]。
2015年FIGO妇癌报告对GTN诊治的指南更新中 [15],低危CTN患者首选单药化疗,常用的药物有:放线菌素D (Act-D)、甲氨蝶呤(MTX)、氟尿嘧啶/氟尿苷(5-FU/FUDR)等。因为不同单药化疗方案的具体用药剂量、用药频率和方式,以及患者的入选标准有所不同 [16],目前文献报道的低危GTN患者单药治疗后的完全缓解率在50%~90%之间,差别比较大,而且其中20%~30%的患者在使用单药化疗后发生耐药,需要接受补救化疗和(或)手术治疗。
2018年FIGO癌症报告推荐:一线化疗时血hCG水平上升或出现新病灶,或者另一种单药耐药的患者,需更换为联合药物化疗方案,比如EMA-CO (依托泊苷 + MTX + ACTD/长春新碱 + 环磷酰胺)方案。若更改为EMA-CO联合化疗后血hCG水平仍然呈平台或上升,则改用依托泊苷和(或)铂类为基础的化疗方案;可能的情况下,考虑联合手术切除耐药病灶,尤其是子宫切除术和肺叶切除术。
总之,低危GTN的治疗目前首选化疗,一线化疗方案推荐MTX或ACTD单药化疗,目前MTX单药化疗方案使用广泛,但ACTD单药化疗能取得更高的缓解率,因此对低危GTN患者一线化疗方案的选择仍有待进一步研究及探索。对于一线化疗失败患者可根据其疾病情况改为另一种单药化疗、联合化疗或结合手术辅助治疗,而多数研究认为影响低危GTN患者化疗疗效的独立因素主要为FIGO预后评分。我国作为GTN发病率较高的国家,需要进行系统、规范、标准的临床前瞻性研究,从而制定适合我国人群的低危GTN一线化疗方案,同时也为国际指南修订提供基于我国的循证医学证据。
综上所述,目前国内外研究发现,目前低危GTN的治疗首选化疗,一线化疗方案推荐单药化疗,对于一线化疗失败患者可根据其疾病情况尽早改为另一种单药化疗、联合化疗,必要时结合手术辅助治疗。本例患者根据FIGO评分虽为低危型GTN,但患者行清宫术后未定期随访,导致未能及时发现病情进展,入院时高hCG水平及CT提示肺部转移病灶等都是导致本例低危型GTN耐药的关键因素。化疗期间动态监测血HCG水平及影像学检查,及时发现患者对化疗药物的敏感性,及时更换化疗方案,使得该患者获得较好的预后。通过本例病案分析及文献回顾,提醒我们对于有高危因素的患者,如高血hCG水平,有转移病灶,高FIGO评分、病理类型为绒癌等,临床医师应对患者强调葡萄胎清宫术后定期复查的必要性,以免错过最佳治疗时期。在确定为GTN后,应按照FIGO分期确定临床分型以及分期,个体化选择化疗方案,治疗过程中告知患者定期复查,动态观察血HCG及影像学变化,及时发现耐药患者,尽早更换化疗方案,以获得良好的结局。
NOTES
*通讯作者。