1. 引言
钛铁矿在我国储量丰富,是一种常见的矿物资源,其主要组成为FeTiO3。由于FeTiO3含有大量的Fe(II)活性位点,能够以类似Fenton反应(如反应式(1)所示)的机理活化H2O2催化降解有机污染物,是一种潜在的绿色、高效、廉价的催化材料。
(1)
FeTiO3常用于光催化 [1] [2] [3] [4] [5]、电池负极 [6] [7] 等领域,目前对于其在催化Fenton反应氧化降解有机污染物的应用报道较少 [8]。如García-Muñoz [9] 等在pH 3、25℃和550 W∙m−2氙灯模拟太阳光的条件下,在组成为0.45 g/L FeTiO3、100 mg/L苯酚和500 mg/L H2O2的反应体系中考察了光-Fenton对苯酚的降解效果。发现苯酚的光-Fenton降解经历了3 h的诱导期,其间苯酚和H2O2浓度几乎没有变化。反应3 h后,体系中生成了对苯二酚,促进了Fe3+还原为Fe2+,提高了H2O2分解速率和∙OH生成速率,苯酚最终除去率达到95%。
常见的FeTiO3制备方案有固体转化法 [10]、共沉淀法 [11]、微波辅助法 [12]、离子液体辅助法 [13] [14]、溶胶–凝胶法 [15] [16] [17] [18]、水热法 [19] [20]、溶剂热法 [21] 等。如Han [21] 等采用溶剂热法,在5 mL甘油和25 mL乙醇中加入钛酸四正丁酯(TBOT),在180℃反应釜中反应24 h后冷却至室温,将得到的含钛固体转移到另一个反应釜中,以Fe(NO3)3∙9H2O为铁源,控制Ti:Fe为1:1,加入3 mL甘油和25 mL乙醇充分混合后,再在180℃反应釜中反应12 h后冷却至室温,所得固体用无水乙醇洗涤干燥后,在550℃下煅烧6 h可得到FeTiO3样品。该合成方法涉及步骤多,工艺复杂。Gambhire [15] 等人采用较为简单的溶胶–凝胶法,以TBOT为钛源,Fe(NO3)3∙9H2O为铁源,无水乙醇为溶剂,加入十六烷基三甲基溴化铵(CTAB)为表面活性剂,用HNO3调节pH为1~2,得到棕色溶胶,在70℃下加热除去溶剂得到凝胶,然后在600℃下煅烧得到FeTiO3。但我们在重复上述操作中,发现调控溶液pH值较为繁琐,影响产物的纯度和重复性。
本文以上述凝胶–溶胶法为基础,将加入HNO3调节pH的步骤替换为加入一定量的三乙基胺,在碱性条件下成功得到了FeTiO3微粒,并用来活化H2O2降解不同类型有机污染物,探究其动力学过程,以拓展FeTiO3作为多相类芬顿催化剂在处理新型有机废水方面的潜在应用。
2. 实验部分
2.1. 实验试剂
九水合硝酸铁(Fe(NO3)3∙9H2O)、TBOT、三乙基胺、亚甲基蓝(MB)、甲硝唑(MNZ)、橙黄G(OG)等均购自国药集团化学试剂有限公司,十六烷基三甲基溴化铵(CTAB)由南京化学试剂有限公司提供。所有药品规格均为分析纯级及以上,没有经过其它预处理。
2.2. 样品的制备
称取1.4540 g Fe(NO3)3∙9H2O溶解于10 mL无水乙醇中,搅拌均匀后加入1.2290 g TBOT,滴加10 mL CTAB (20 wt%)乙醇溶液,向其中缓慢滴加2 mL三乙基胺,升温至70℃后干燥得到棕色固体。取出一定量此前驱体在N2氛围下,700℃煅烧2 h,得到黑色块状固体经研磨后即为FeTiO3微粒。
2.3. 样品的表征
实验所得样品的物相结构采用X射线粉末衍射仪(XRD)测定(Bruker公司,型号D8),X射线为Cu靶Kα射线,管电压30 kV,管电流20 mA,扫描范围5℃~80℃,扫描速度为0.1˚/s。样品形貌和粒径采用扫描电子显微镜(SEM) (日本电子株式会社,型号JSM5510LV)观察。
2.4. 零电点测定
按照文献方法 [22],通过测定不同初始pH值的溶液与固体颗粒平衡后的pH改变量来确定固体颗粒的零电点。如在250 mL锥形瓶中加入20 mL NaCl (0.1 mol/L),调节其初始pH (pHi)为8.06,然后加入0.200 g样品混合均匀后,在30℃、转速150 rpm的水浴摇床中震荡8 h后,测定其最终pH值为3.62,因此可得初始pH为8.06时,pH改变量(DpH)为−4.44。以DpH对pHi作图,与DpH = 0对应的pH即近似为该固体颗粒的零电点。
2.5. 催化降解性能测试
称取0.025 g催化剂,加入装有50 mL 25 mg/L污染物(如OG、MB和MNZ)溶液的两口烧瓶中,调节pH~3,在黑暗条件下预吸附15 min后,取样测定其吸光度,然后加入0.230 g H2O2 (30 wt%),在25℃下搅拌反应,分别于不同时刻取样测定其吸光度值(注:由于MB (25 mg/L)吸光度较大,因此检测MB溶液的吸光度时,移取0.5 mL待测液稀释为五倍,混合均匀后测定紫外–可见光吸收曲线)。所用紫外–可见光分光光度计为UV-6100 (上海美谱达仪器有限公司),OG、MB和MNZ的检测波长分别为475 nm、664 nm和320 nm。
2.6. FeTiO3催化降解OG的循环使用性能测试
将反应后的固液混合物离心分离后,倒掉处理后的OG溶液,按照上述催化降解性能测试操作条件,测试回收固体的循环使用性能。
2.7. COD测定方案
COD测定参照国家标准GB11892-89 [水质高锰酸盐指数的测定]。
3. 结果与讨论
3.1. 材料的表征分析
图1为制备样品的XRD图谱,通过与标准卡片FeTiO3 (PDF #29-0733)对比,在2θ = 23.8˚, 32.3˚, 35.2˚, 40.3˚, 48.7˚, 52.8˚, 61.5˚, 63.3˚, 70.0˚等处的衍射峰均能与标准卡片相符合,分别对应于FeTiO3的(012), (104), (110), (113), (024), (116), (214), (300), (1010)晶面衍射峰。
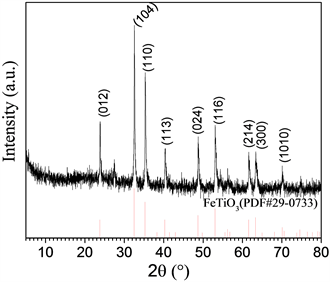
Figure 1. XRD pattern of FeTiO3 particles prepared via sol-gel method
图1. 溶胶–凝胶法制备的FeTiO3颗粒的XRD图
 (a)
(a)  (b)
(b)
Figure 2. SEM images of FeTiO3 particles prepared via sol-gel method. Shown in panels (a) and (b) were SEM images of different regions of the FeTiO3 particles
图2. 溶胶–凝胶法制备的FeTiO3颗粒的SEM图((a)、(b)为同一样品颗粒在不同位置的SEM图)

Figure 3. Measurement of point of zero charge of FeTiO3 particles
图3. FeTiO3颗粒的零电点测试
图2(a)和图2(b)分别为FeTiO3样品在不同区域所拍摄的SEM图。从图中可看出颗粒形状不规则,样品在区域图2(a)内主要为较小的球形颗粒,在区域图2(b)内则由形状不规则的块状、针状等颗粒组成,并有一定的团聚现象。这可能与样品制备过程中在700℃高温煅烧时颗粒聚并、长大和烧结等有关。
零电点(pHpzc)是影响固体颗粒吸附和催化性能的一个重要参数。从图3中测得FeTiO3颗粒的零电点pHpzc约为2.4。
3.2. 催化降解性能测试
本文分别选择了阴离子染料OG、阳离子染料MB、电中性抗生素MNZ (分子结构如图4)作为模型有机污染物,考察溶胶–凝胶法制备的FeTiO3颗粒的类Fenton催化活性,催化降解性能测试如图5(a)所示。在相同条件下反应30 min即可完全降解25 mg/L OG,而相同浓度的MB或MNZ需反应120 min后才基本完全降解(降解率90%以上)。三种模型有机污染物的降解过程均较符合一级动力学方程(拟合相关系数R2 = 0.99,如图5(b)),对应的速率常数分别为:0.175 min−1、0.024 min−1和0.028 min−1,表明FeTiO3颗粒可有效活化H2O2降解不同类型的有机污染物,适用范围较广,其中对降解阴离子染料OG效果最佳。
Figure 4. Molecular structures of three model organic pollutants
图4. 三种模型有机污染物的分子结构图
通常固体颗粒的零电点与其吸附和催化性能密切相关。但本文中催化降解反应体系的pH值(~3)与FeTiO3颗粒的零电点(~2.4)非常接近,因此FeTiO3颗粒表面基本保持电中性,此时静电作用力应该不是吸附不同电性的有机污染物的主要驱动力。如图5(c)~(e)所示,FeTiO3颗粒在15 min预吸附过程中,对OG、MNZ及MB的预吸附量分别为35%、34%和16%,表明FeTiO3颗粒对于OG和MNZ具有较好的吸附能力,而对MB的吸附能力较差。在反应零时刻加入H2O2,H2O2经FeTiO3颗粒活化5 min后对OG的降解率高达85%;对于相同预吸附量的MNZ,H2O2经FeTiO3颗粒活化5 min后的降解率仅为44%;而对于污染物MB,H2O2经FeTiO3颗粒活化5 min后的降解率仅32%。在反应30 min后,FeTiO3颗粒催化H2O2降解OG、MNZ及MB的降解率为99%、72%、61%,表明FeTiO3颗粒活化H2O2对三种模型污染物的降解性能依次为OG > MNZ > MB。
FeTiO3颗粒对不同有机污染物的吸附和催化降解性能的差异可能与有机污染物的分子结构特征及稳定性密切相关。FeTiO3与OG中的偶氮双键作用力可能较强,有利于促进吸附OG,表面吸附的OG分子有利于被H2O2表面分解形成的活性物种(主要为羟基自由基)所进攻和氧化降解。由于表面形成的活性物种寿命短,因此难以扩散到溶液中有效氧化降解溶液中的有机分子(如MB)。虽然MNZ在FeTiO3颗粒表面吸附能力与OG相似,但MNZ分子较小,和活性物种的碰撞频率也可能较小,结构也可能比较大的p共轭体系更加稳定,因此在相同条件下,FeTiO3活化H2O2对OG的降解性能最佳。
3.3. FeTiO3颗粒的循环使用性能
由于FeTiO3对催化降解OG的优异性能,本文以OG为模型污染物考察了FeTiO3的循环使用性能。如图6(a)所示,经过五次循环实验后,FeTiO3颗粒催化降解性能基本保持不变,均能够在120 min将OG降解率达到99%以上。
FeTiO3催化降解OG的循环性能测试中每次残液的COD去除率如图6(b)所示。前三次残液的COD去除率基本保持不变(约68%),第四次和第五次反应残液的COD去除率有所降低(分别为57%和61%)。60%~70%的COD去除率表明FeTiO3能够有效活化H2O2,产生具有强氧化性的羟基自由基等活性氧物种(如反应式1所示),高效降解或矿化有机污染物为小分子无机物。
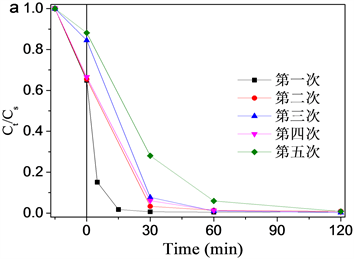
Figure 6. (a) Recyclability tests of FeTiO3 for catalytic degradation of OG; (b) COD removal rate in each cycle. Reaction conditions: 0.5 g/L FeTiO3, 25 mg/L OG and 40.0 mmol/L H2O2 at pH 3 and 25˚C for 120 min
图6. (a) FeTiO3催化降解OG的循环使用性能;(b) 循环性能测试中每次残液的COD去除率。实验条件:0.5 g/L FeTiO3,25 mg/L OG和40.0 mmol/L H2O2在pH 3和25℃条件下反应120分钟
4. 结论
本文以三乙基胺为矿化剂,用溶胶–凝胶法在碱性条件下成功制备了FeTiO3微粒,并将其应用于活化H2O2降解有机污染物(如OG、MB、MNZ),表明FeTiO3微粒具有良好的类Fenton催化活性,对降解有机污染物的适用性广,尤其适合于催化降解偶氮类有机污染物(如降解OG的一级动力学速率常数达0.175 min−1)。FeTiO3具有良好的循环使用性能,五次循环使用后对催化降解OG仍具有较高活性(2 h可完全降解25 mg/L OG,COD去除率达57%~69%)。
NOTES
*通讯作者。