1. 引言
金黄色葡萄球菌是一种常见的机会性感染病原菌,可引起从轻微的局部皮肤化脓性感染到危及生命的深层组织感染或全身感染、菌血症等。耐甲氧西林的金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)由于对青霉素类和头孢菌素类抗生素耐药,临床治疗困难,给临床医生带来极大困扰 [1]。但研究发现在不少健康者口咽部和呼吸道中仍可以检出MRSA菌,表明MRSA菌的毒力并不与其耐药性呈正相关,某些情况下MRSA菌可以定植于健康人口咽中并不引起临床症状,单纯痰液中MRSA菌的检出并不一定预示着患者会发生严重肺部化脓性感染 [2]。近年来,金黄色葡萄球菌的杀白细胞素(Panton-Valentine leukocidin, PVL)引起了人们的关注 [3]。英国学者最早发现,由携带pvl基因的MRSA菌感染导致的社区内肺炎患者死亡率高达90%,因此PVL是金黄色葡萄球重要毒力因子,也极可能是潜在高危型金黄色葡萄球菌的分子标记。目前仍未见有金黄色葡萄球菌PVL的快速检测方法,本研究通过自行制备抗PVL多克隆抗体,为下一步PVL快速检测提供了技术保障。
2. 实验材料
2.1 实验物品
实验菌株
携带pvl基因的金黄色葡萄球分离于本院患者血液,经PCR法鉴定表达pvl基因,保存于本研究室菌种库中。
2.2. 实验耗材
2.2.1. 细菌培养所需实验耗材
磷酸盐缓冲液(PBS)、Muller-Hinton (MH)培养基和羊血琼脂培养平板购自法国生物梅里埃公司;酵母浸出液、胰蛋白酶购自英国OXIOD公司。
2.2.2. PCR及载体构建相关耗材
2 × Taq Master Mix (Dye Plus)试剂盒和总RNA提取试剂盒购自南京Vazyme公司,溶菌酶、异丙醇、氯仿、无水乙醇、焦碳酸二乙酯(DEPC)购自上海生工生物公司。
2.2.3. PCR引物
根据金黄色葡萄球菌PVL编码序列引物,引物序列为:F:CTTGCATCAAGTTCAGCTCTTCC,R:AAGTGAGCCTCAACCGCATCCT,交由苏州金智唯公司合成。
2.3. 实验方法
2.3.1. 制备重组金黄色葡萄球菌PVL蛋白(S亚基)
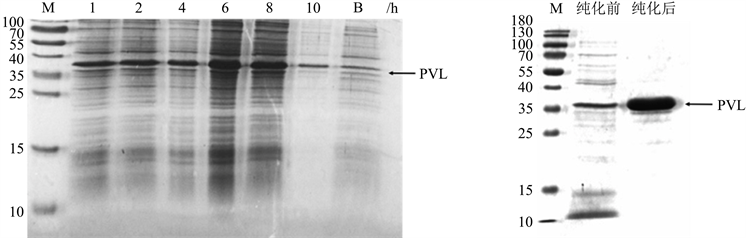
金黄色葡萄球菌LukS-PV/pET28a质粒由安徽省立医院常文娇博士和马筱玲教授惠赠,以热激法导入感受态大肠杆菌DH5α中,并涂布于LB平板上。平板琼脂中含50 μg/mL卡那霉素用于筛选阳性克隆。次日挑取单个菌落接种于新鲜LB液体培养基(50 μg/mL卡那霉素)扩大培养12 h。离心收集菌液,采用碱裂解法提取质粒,并重溶于20 μL灭菌双蒸水中。再采用热激法导入将上述质粒导入大肠杆菌BL21感受态中,并涂片于含50 μg/mL卡那霉素的LB平板上筛选阳性克隆。次日挑取单个菌落接种含50 μg/mL卡那霉素的LB液体培养基增菌12 h,再按1:100比例接种新鲜LB培养基并于37℃增菌至菌液OD600 = 0.6,加入终浓度为0.4 mmol/L IPTG诱导6 h后收集菌体沉淀重悬于结合缓冲液,以超声法裂解蛋白(超声功率45 W,每次15 s,间隔15 s,持续30次)。超声完毕后以16,000 rpm离心20 min彻底去除上清用于Ni-NAT亲和层析法纯化重组LukS-PV蛋白,纯化后重组LukS-PV蛋白以SDS-PAGE电泳分析纯化效果。
2.3.2. 制备兔抗LukS-PV多克隆抗体
取纯化后的重组LukS-PV蛋白与等量弗氏完全佐剂混合充分研磨至完全乳化成“油包水”状态后用于免疫新西兰兔,免疫量为1 mg/只,采用背部皮内多点注射法免疫。首次免疫后的第二周和第四周将纯化后PVL蛋白与等量弗氏不完全佐剂完全乳化后新西兰兔。于采集兔血清前采用ELISA法检测抗体效价,达到1:128,000时即采集血清用于后续实验研究。
2.3.3. Western Blotting法检测PVL表达
选取已鉴定为携带pvl基因的MRSA菌株,于血平板复苏并经液体LB培养基大量扩增后收集菌体,加入适量2 × SDS-PAGE上样缓冲液并煮沸10 min后离心取上清,用于Western blotting法检测。细菌蛋白经SDS-PAGE电泳分离后转印至PVDF膜,经5%脱脂奶粉封闭1 h,再以自制兔血清为一抗(免疫前和免疫后兔血清按照1:5000比例使用5%脱脂奶封闭液稀释) 4℃过夜孵育。次日使用TBST溶液洗涤3次,每次10 min。再与二抗(TBST溶液以1:1000比例稀释的羊抗兔二抗)于室温下孵育1 h,滴加ECL发光液,观察结果,并照相记录。使用Image J图像分析软件按照相应操作步骤对照片进行灰度扫描,记录结果后使用SPSS软件分析。
3. 结果
3.1. PCR法检测金黄色葡萄球菌pvl基因
10株临床分离MRSA菌株煮沸后经PCR法检测,5株pvl基因阳性,5株阴性(图1)。
3.2. 重组LukS-PV蛋白表达与纯化
使用IPTG诱导表达1 h、2 h、4 h、6 h、8 h、10 h,经SDS-PAGE电泳检测发现0.4 mmol/L IPTG诱导6 h时重组LukS-PV蛋白表达量达到最高。经Ni-NTA介质纯化后,SDS-PAGE电泳显示35 kDa处有一明显而清晰的条带,与LukS-PV分子量大小一致,表达纯化金黄色葡萄球菌重组LukS-PV蛋白获得成功(图2)。

Figure 1. Detection of pvl genes by PCR
图1. PCR法检测pvl基因
 (a) (b)
(a) (b)
Figure 2. Expression and purification of LukS-PV protein. (a) Recombinant LukS-PV protein was expressed 6 h after IPTG induction; (b) Purification of recombinant Luks-PV protein
图2. 重组LukS-PV蛋白表达与纯化。(a) 经IPTG诱导6 h时重组LukS-PV蛋白表达情况;(b) 重组LukS-PV蛋白纯化效果
3.3. 抗PVL多克隆抗体制备
以免疫前、后兔血清按1:5000比例稀释后作为一抗检测MRSA菌PVL表达。结果可见,免疫后血清可识别35 kDa处特异性条带,而免疫前血清未识别出35 kDa处条带,表明抗体制备成功(图3)。

Figure 3. The PVL protein was identified by self-made polyclonal antibodies
图3. 采用自制多抗鉴定PVL蛋白
3.4. Western Blotting法检测MRSA菌PVL表达
选取四株MRSA菌株,以自制兔抗血清按1:5000比例稀释后作为一抗检测MRSA菌PVL表达,可见两株携带PVL的菌株(3号和4号菌株)在35 kDa处有特异性条带,而两株不携带PVL的菌株(1号和2号菌株)在35 kDa处未见特异性条带(图4)。
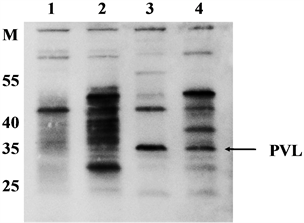
Figure 4. Detection of PVL by Western blotting
图4. Western blotting法检测PVL
4. 讨论
金黄色葡萄球菌(Staphylococcus aureus)是革兰阳性菌,常定植于宿主皮肤、鼻腔、肠胃中,在宿主免疫力低下时诱发各种感染性疾病,如肺炎、伪膜性肠炎、心包炎等,甚至引发脓毒血症造成死亡 [4]。随着抗生素的滥用导致金黄色葡萄球菌的耐药性逐年增强,1961年首次发现了对多种抗生素广泛耐药菌株—耐甲氧西林的金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA),并于上世纪80年代在全球范围内蔓延,每年直接或者间接夺去数百万人的生命 [5]。过去认为由MRSA菌引起的感染通常伴随着高死亡率、高发病率和高额医疗费用,但近年来的研究发现健康人群的口咽部和呼吸道也存在MRSA菌的定植,并且不会引起宿主任何症状 [6]。这表明,单纯依靠MRSA菌评估金黄色葡萄球菌并不可靠,易造成临床过度治疗。
金黄色葡萄球菌的毒力主要取决于多种毒素,包括溶血素、肠毒素、中毒休克综合征毒素-1等,以及各种侵袭性酶如蛋白酶、脂肪酶和透明质酸酶等 [7]。其中溶血素可以导致特应性皮炎(Atopic dermatitis, AD),肠毒素可以导致食物中毒,而杀白细胞素(PVL)是金黄色葡萄球菌的一种重要毒素,可引起高致死性社区内肺炎。特别是能够表达PVL毒素的MRSA菌,对常规青霉素类和头孢类抗生素耐药,极易导致患者死亡,因此建立金黄色葡萄球菌PVL的快速筛选技术具有重有临床应用价值。目前国外十分重视社区内发现MRSA菌株携带pvl基因的筛查,已将其推荐为国家疾病预防和控制中心微生物学实验室的常规检测项目,但国内尚未见相关检测研究 [8]。
1884年Van deleld等首次发现某些金黄色葡萄球菌可以分泌一种直接杀伤家兔白细胞的外毒素,1932年Panton和Valentine两位学者在提纯金黄色葡萄球菌溶血素时意外发现了PVL。金黄色葡萄球菌PVL蛋白是一种双组份成孔毒素,包括F亚基(LukF-PV)和S亚基(LukS-PV),可以杀伤宿主各类吞噬细胞,帮助细菌逃避宿主免疫清除 [9]。研究发现LukS-PV先与多形核白细胞(PMNs)细胞膜上的受体特异性结合,再与LukF-PS结合形成二聚体,并进一步形成一个环状异聚体在PMNs细胞膜上打孔。低浓度PVL会造成PMNs线粒体外膜穿孔,激活Caspase-3和Caspase-9,继而释放线粒体内细胞色素C诱发凋亡;高浓度PVL可以直接激活蛋白激酶A和蛋白激酶C的磷酸化,导致Ca2+活化内流至胞内促使产生各种炎性介质,直接杀伤溶解细胞 [10]。
我们研究中,我们制备出金黄色葡萄球菌PVL多克隆抗体,并建立了Western blotting法检测金黄色葡萄球菌表达PLV蛋白,该结果为下一步制备金黄色葡萄球菌PVL快速检测试验盒奠定了技术基础。
NOTES
*通讯作者。