摘要: 目的:探究超声内镜及图像分析技术在评估胃间质瘤危险度分级的临床价值。方法:收集2015年至2021年于青岛大学附属医院行手术或内镜下切除治疗的62例胃间质瘤患者。根据2008年NIH危险分级标准,将患者分为极低危组(n = 11例)、低危组(n = 29例)、中危组(n = 13例)、高危组(n = 9例),分析各危险分层组胃间质瘤的超声内镜征象特点。应用Photoshop软件将超声内镜图像量化,以灰度平均值(回声强度)、灰度标准偏差(回声均匀度)表示,分析肿瘤直径、灰度平均值均值(Tmean)、灰度标准偏差平均值(TSD)在各危险分层组的差异,绘制受试者工作特征曲线(ROC),评估三者评估胃间质瘤危险度分级的效能。结果:肿瘤内部液化、钙化、血流信号在GST危险度分组间差异有统计学意义(P < 0.05)。经二元logistic回归分析,肿瘤内部液化为GST危险度分级的独立危险因素(OR = 3.504, 95% CI = 1.087~11.299, P < 0.05)。GST的肿瘤直径、Tmean、TSD在不同危险分层间差异有统计学意义(P < 0.05),极低危组、低危组、中危组的肿瘤直径、Tmean、TSD均小于高危组(P < 0.05)。以高危险分层为阳性结果绘制ROC曲线,当肿瘤直径 > 42.5 mm,Tmean > 17.3775,TSD > 8.0988,预测GST为高侵袭性风险的效能AUC值分别为0.872、0.769、0.885。结论:EUS对于术前评估GST的侵袭危险性具有较高的临床价值。肿瘤内部发生液化是评估GST危险分层的独立危险因素。肿瘤直径、图像分析技术(Tmean、TSD)作为区分GST高恶性潜能的重要指标,可更好地辅助EUS对GST的评估。
Abstract:
Objective: To explore the clinical value of endoscopic ultrasonography and image analysis techniques in assessing the risk grade of gastric stromal tumors. Methods: A total of 62 patients with gastric stromal tumor who underwent surgery or endoscopic resection in the Affiliated Hospital of Qingdao University from 2015 to 2021 were collected. According to the 2008 NIH risk grading standard, the patients were divided into very low-risk group (n = 11), low-risk group (n = 29), intermediate-risk group (n = 13), and high-risk group (n = 9) to analyze the characteristics of endoscopic ultrasonography of gastric stromal tumors in each risk stratification group. The endoscopic ultrasound images were quantified by Photoshop software, expressed as gray mean (echo intensity), gray standard deviation (echo uniformity), and the differences of tumor diameter, gray mean mean (Tmean), and gray standard deviation mean (TSD) in each risk stratification group were analyzed, the receiver operating characteristic curve (ROC) was drawn, and the efficacy of the three to assess the risk classification of gastric stromal tumors was evaluated. Results: The liquefaction, calcification, and blood flow signals were significantly different among GST risk groups (P < 0.05). After binary logistic regression analysis, liquefaction was an independent risk factor to predicting the risk classification of GST (OR = 3.504, 95% CI = 1.087~11.299, P < 0.05). The tumor diameter, Tmean, and TSD of GST were significantly different among different risk stratifications (P < 0.05) and the tumor diameter, Tmean, and TSD in the very low-risk group, low-risk group, and intermediate-risk group were lower than those in the high-risk group (P < 0.05). The ROC curve was drawn with high risk stratification as the positive result. When tumor diameter > 42.5 mm, Tmean > 17.3775, TSD > 8.0988, the efficacy AUC values for predicting GST as high invasive risk were 0.872, 0.769, and 0.885, respectively. Conclusion: EUS has high clinical value for preoperative assessment of the invasive risk of GST. Liquefaction is an independent risk factor for assessing the risk stratification of GST. Tumor diameter and image analysis technology (Tmean, TSD), as important indicators to distinguish the high malignant potential of GST, can better assist EUS in the evaluation of GST.
1. 前言
胃肠道间质瘤(GIST)主要起源于胃肠道的Cajal细胞(Interstitial Cells of Cajal, ICC),是消化道最常见的间叶源性肿瘤,可发生于胃肠道的任何部位,多见于胃70% [1]。我国GIST的发病率约为0.40/10万,标准年龄调整后发病率约为0.42/10万 [2]。然而,随着免疫组织化学分析技术和辅助检查手段的改进,GIST的发病率有明显增加的趋势 [3]。与其他肿瘤不同,GIST不能简单地化分为良性肿瘤或恶性肿瘤,被认为是具有恶性潜能的肿瘤,需进行侵袭危险性分级,但GIST不同危险分级的治疗及预后不同。外科手术治疗已经成了GIST的主要治疗方式,在行根治性切除后患者仍有复发的可能,超过50%的高危险分层患者可在术后的5年内复发 [4]。因此准确评估其恶性潜能对于患者治疗方案的制定具有重要的指导意义 [5] [6]。超声内镜(EUS)结合普通胃镜和超声穿透性的优点,对GIST的诊断及危险度评估具有较高的敏感性及特异性,是目前GIST术前诊断的重要检查方式之一 [7]。但EUS对于疾病的诊断具有主观性,受医师的内镜知识、工作经验和肉眼鉴别能力的影响,有一定的局限性。随着图像分析技术在GIST诊断中地广泛应用,因其能精确提取EUS图像信息并以量化值表示,从而可降低EUS在GIST诊断中的主观性,更好辅助EUS对GIST的诊断与评估 [8]。本研究旨在分析EUS征象及图像分析技术、多普勒血流成像在评估胃间质瘤(GST)危险分级的价值,以期为术前准确评估GST的恶性潜能提供无创性工具。
2. 资料与方法
2.1. 研究对象
本研究收集了2015年至2021年于青岛大学附属医院行手术或内镜下切除治疗(内镜黏膜下切除术(ESE)或内镜黏膜下剥离术(ESD)),术前行EUS检查,术后经病理及免疫组化检查确诊为GST的78例患者,根据纳入、排除标准,本研究最终纳入62例患者。纳入标准:1) 经手术或内镜下切除获得标本且经病理学确诊为GST;2) 一般临床资料及EUS图像资料齐全;3) 行EUS检查前或手术前未接受过任何治疗,如靶向药物治疗;4) 选取EUS频率为7.5HZ的患者。排除标准:1) 一般临床资料及EUS图像资料缺失;2) 合并其他恶性肿瘤;3) 术前及行EUS检查前肿瘤已发生远处转移;4) 标本由超声内镜引导下细针穿刺活检(EUS-FNA)获得。所有参与者的隐私都受到保护。本回顾性研究经青岛大学附属医院医学伦理委员会批准。具体筛选流程见图1:
Figure 1. Included object screening process
图1. 纳入对象筛选流程
2.2. 研究方法
2.2.1. EUS检查
观察指标:肿瘤大小、生长方式(腔内/腔外/混合)、起源层次(黏膜下层/固有肌层)、肿瘤边界(边界规则包括圆形及类圆形、边界不规则包括分叶形),肿瘤位置(胃底/胃体/胃窦),钙化(是/否),表面溃疡(是/否),粘膜桥(是/否)和液化(是/否)。EUS图像由两名具有10年以上经验的内镜医师阅读并记录。如有争议,则与第三位更高年资内镜医师进行讨论并得出最终结论。
2.2.2. PS软件图像分析
由同一名内镜医师选取每一位患者在7.5 Hz频率下最清晰的EUS图像,应用Photoshop CS6图像处理软件,按照统一流程进行图像处理(① 图像 ② 模式 ③ 灰度 ④ 扔掉)以消除黑灰白以外其他颜色的影响。沿病灶轮廓选定感兴趣区域(ROI)测量肿瘤的灰度平均值、灰度标准偏差。每张图像需测定5次,以减小测量误差。最终取灰度平均值、灰度标准偏差5次测量值的平均值用灰度平均值均值(Tmean,反映回声强度)和灰度标准偏差平均值(TSD,反映回声均匀度)表示。
2.2.3. 超声内镜多普勒血流成像(CDFI)技术检查
Alder分级标准:0级,未发现明显血流信号;I级,少量血流,1~2个点状或细棒状的血管;II级,中量血流,3~4个点状血管或一个较长的血管穿入病灶,其长度可接近或超过肿块半径;III级,多量血流,可见≥5个点状血管或2个较长血管。将0、I级归为血供缺乏组,II、III归为血供丰富组 [9]。
2.2.4. 危险度分级
采用2008年改良版NIH危险分层标准,根据肿瘤大小、肿瘤部位、核分裂象数和肿瘤破裂情况,将所有病例分为极低危组、低危组、中危组和高危组四个等级 [5],见表1。

Table 1. Modified NIH risk classification of 2008
表1. 2008年改良版NIH危险度分级
*HPF:每高倍镜。
2.3. 统计学方法
采用SPSS软件(版本22.0,IBM)进行统计学分析,正态分布的定量资料以均值 ± 标准差(means ± SD)表示,多组间比较采用单因素方差分析,若有统计学差异再应用Bonferron法进行两两比较;非正态分布的定量资料以中位数表示,多组间比较采用Kruskal-Wallis秩和检验,若有统计学差异再进行两两比较。定性资料以频数及百分比表示,组间比较采用卡方检验或Fisher确切概率法。若P < 0.05,则说明差异具有统计学意义。
3. 结果
3.1. 一般临床资料特征
共纳入GST患者63例,男性25例(40.3%),女性37例(59.7%),男女之比为1:1.48。患者年龄中位数为59.0岁,肿瘤位于胃底、胃体、胃窦部分别为19例(30.6%)、32例(51.6%)、11例(17.8%)。根据2008版改良后NIH分级标准,极低危险度组11例(17.8%),低危险度组29例(46.7%),中危险度组13例(21.0%),高危险度组9例(14.5%)。经手术治疗者26例(41.9%),内镜下行ESD或ESE术者36例(58.1%)。见表2。

Table 2. General clinicopathological data of 62 GST patients
表2. 62例GST患者一般临床病理资料
3.2. GST的EUS征象与危险分层的关系
经卡方检验或Fisher确切概率法,肿瘤内部液化、钙化在GST危险度分组间差异有统计学意义(P < 0.05)。肿瘤的发病部位、生长方式、起源层次、溃疡、黏膜桥、肿瘤边界在GST危险度分组间差异无统计学意义(P > 0.05)。根据Alder分级,血供缺乏组35例(56.5%),血供丰富组27例(43.5%),血供缺乏组中,极低危险度、低危险度、中危险度、高危险度分别为11 (17.7%)、15 (24.2%)、7 (11.3%)、2 (3.2%)。血供丰富组中极低危险度、低危险度、中危险度、高危险度分别为0 (0.0%)、14 (22.6%)、6 (9.7%)、7 (11.3%),经Fisher确切概率法检验,P值为0.002 < 0.05,GST肿瘤内部血液供应在危险分级中差异有统计学意义。见表3。

Table 3. The relationship between EUS signs and GST risk stratification
表3. EUS征象与GST危险分层的关系
3.3. GST的肿瘤直径、Tmean、TSD与危险分层的关系
单因素方差分析结果示GST的肿瘤直径在危险分层间差异具有统计学意义(P < 0.05),进行两两比较,经Bonferron校正,极低危组、低危组、中危组的肿瘤直径均小于高危组(P < 0.05),但极低危组与低危组、低危组与中危组的肿瘤直径差异无统计学意义。Kruskal-Wallis秩和检验结果示Tmean、TSD在危险分层间的差异有统计学意义(P < 0.05),经Bonferron校正,极低危组、低危组的Tmean明显低于高危组(P < 0.05),而极低危组、低危组的Tmean与中危组,中危组的Tmean与高危组差异无统计学意义。极低危组、低危组、中危组的TSD均低于高危组(P < 0.05),而极低危组、低危组的TSD与中危组差异无统计学意义。见表4。

Table 4. The relationship between tumor diameter, Tmean, TSD and risk stratification of GST
表4. GST的肿瘤直径、Tmean、TSD与危险分层的关系
①经Bonferron校正,与高危组比,P < 0.05。
将极低危险度、低危险度和中危险度作为阴性结果,高危险度作为阳性结果,绘制EUS征象(肿瘤直径、Tmean、TSD)对评估GST危险度分级的ROC曲线,并用约登指数(约登指数公式 = 灵敏度 + 特异度 − 1)算出三者的最佳截止值,Tmean评估GST危险度分级的最佳截止值为17.3775,AUC为0.769,TSD评估GST危险度分级的最佳截止值为8.0988,AUC为0.885,肿瘤直径评估GST危险度分级的最佳截止值为42.5000,AUC为0.872。见图2,表5。
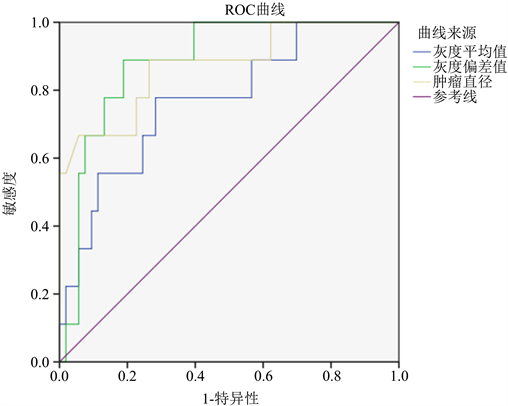
Figure 2. The ROC curve of tumor diameter, Tmean and TSD for GST risk stratification
图2. 肿瘤直径、Tmean、TSD对GST危险分层的ROC曲线

Table 5. The optimal cutoff values of tumor diameter, Tmean and TSD for GST risk stratification
表5. 肿瘤直径、Tmean、TSD对GST危险分层的最佳截止值
3.4. GST危险度分级的二元Logistic回归分析
将单因素分析中有统计学差异的EUS征象(液化、钙化、血流信号)作为自变量纳入二元logistic回归分析,因变量为危险分层,极低危险度、低危险度、均赋值“0”,中危险度、高危险度均赋值“1”,自变量赋值:液化:否 = 0,是 = 1,钙化:否 = 0,是 = 1,血流信号:血流缺乏 = 0,血流丰富 = 1,结果显示仅有肿瘤内部液化为GST危险度分级的独立影响因素(OR = 3.504, 95% CI = 1.087~11.299, P < 0.05)。见表6。

Table 6. The binary logistic regression analysis of GST risk classification
表6. GST危险度分级的二元logistic回归分析
4. 讨论
GIST是消化道最常见的间叶源性肿瘤,常发生于胃和小肠,GST约占60.00%~70.00% [10]。目前认为,GST生物学行为复杂多样,均有恶性潜能。有研究发现,肿瘤直径<2 cm、核分裂象数低的GST出现转移、复发的风险小,可内镜随访观察;低危、中危及高危的GST需行外科或内镜手术以尽早完整切除 [11]。但术后GST易发生转移与复发,尤其是高危患者。国际上主要采用2008年改良版的NIH分级标准对患者进行危险分级,根据肿瘤大小、肿瘤部位、核分裂象数和肿瘤破裂情况可将患者分为极低危、低危、中危、高危,危险分级越高,侵袭性越高,存活率越低 [12]。核分裂象数作为危险分层标准中最重要的参考因素,需经术后病例或肿瘤穿刺活检获得。肿瘤穿刺活检不仅可以引起穿孔、出血、感染等风险,并且活检的诊断准确率低 [13]。因此GST的侵袭危险等级在术前难以准确评估。
EUS结合普通内镜和超声穿透性特点,不仅可以评估肿瘤的大小和形态,还可以确定肿瘤的起源层次,异质性、液化、钙化、回声强度等特点,已成为消化道黏膜下病变的首选检查方式 [14]。有研究发现EUS诊断GST的灵敏度为88.27%,特异度为65.38%,准确率为85.11% [15]。GST典型的EUS下表现为低回声团块,内部回声多均匀,边界清晰且规则,来源于固有肌层 [16]。中国专家共识意见提出GST的高危征象包括肿瘤液化、发生溃疡、边界不规则、呈强回声模式。李梦莹等人通过分析纳入的86例GST的EUS征象发现,肿瘤发生液化、回声不均质性可作为评估GST危险程度的独立危险因素 [17]。陈丽萍等人报道,中危组、高危组GST的肿瘤表面发生溃疡、内部钙化及液化的发生率明显高于极低危组、低危组,液化、溃疡、钙化是评估GST侵袭危险性的重要参考指标 [18]。本研究对纳入的62例GST的EUS征象分析,发现肿瘤液化、钙化在不同危险分层中的差异具有统计学意义(P < 0.05)。进一步行Logistic回归分析结果示肿瘤液化是评估GST危险程度的独立危险因素(OR = 3.504, 95% CI = 1.087~11.299)。GST的肿瘤直径越大,内部血流越丰富,恶性程度越高。有研究发现,GST的血流信号在低风险组、中风险组、高风险组的差异有统计学意义 [9],基于其血流信号以及囊性变构建的logistic回归模型对生物学风险的预测准确率为76.96% [19]。在本研究中将62例GST依据CDFI血流分层标准分为血流缺乏组、血流丰富组,血流信号在不同风险分层间差异具有统计学意义,但不能作为评估GST危险度的独立危险因素。在本研究中肿瘤溃疡、钙化、回声不均质性在不同危险分层间差异无统计学意义,与李梦颖、陈丽萍等人的研究不完全一致。考虑到本研究纳入的样本量少,且EUS的检查具有一定的主观性。
Photoshop软件(PS软件)作为一种图像处理软件,因其能够精确提取图像的灰度信息并以量化值表示,被广泛应用于科研及临床工作中。近年来,PS软件在GIST的诊断与侵袭危险度评估中的应用受到众多学者的关注。王玮等人用PS软件测定了74例原发性GIST的Tmean值及TSD值,通过比较发现极低危组与低危组的Tmean及TSD均低于中危组与高危组,提示回声强度越高、回声越不均匀,危险分级越高,侵袭性越大 [20]。本研究测定了62例GST的Tmean、TSD,Tmean越大,回声越强,TSD越大,回声越不均匀。经分析发现GST的肿瘤直径、Tmean、TSD在不同危险分层间差异有统计学意义(P < 0.05),且两两比较,经Bonferron校正,极低危组、低危组、中危组的肿瘤直径、Tmean、TSD均小于高危组(P < 0.05),表明肿瘤直径越大、Tmean及TSD越高,危险分层越高,侵袭危险性越高。我们又以高危险分层为阳性结果,绘制了肿瘤直径、Tmean、TSD评估危险分层的ROC曲线,当肿瘤直径 > 42.5 mm,Tmean > 17.3775,TSD > 8.0988,预测GST为高侵袭性风险的效能AUC值分别为0.872、0.769、0.885,为临床更准确的区分GST的高危险分层提供指导。
综上所述,不同生物学行为的GST的EUS征象具有一定的差异。随着GST恶性程度增加,肿瘤直径增大,肿瘤发生钙化、液化、内部伴丰富血流更为多见。肿瘤内部发生液化是评估GST危险分层的独立危险因素。EUS对于术前评估GST的侵袭危险性具有较高的临床价值。PS软件的图像分析技术可提取图像的灰度信息以灰度平均值、灰度标准偏差值来反映肿瘤的回声强度及回声均匀程度。肿瘤直径、Tmean、TSD可作为区分GST高恶性潜能的重要参考指标。因此,图像分析技术可更好地辅助EUS对GST的评估,且操作简单,值得进一步推广。
NOTES
*通讯作者Email: yonghong6868@sina.com