1. 引言
卵巢癌是常见的女性恶性肿瘤之一,并且是导致女性癌症死亡的重要原因,通常发病于绝经后妇女,由于其发病早期主要为腹痛和腹胀等症状,容易被忽视,导致大多数妇女在确诊卵巢癌时已处于晚期(III期及以上),从而失去最佳治疗时机。在妇科恶性肿瘤中,虽然卵巢癌的发病率低于宫颈癌和子宫内膜癌,但其死亡率却比宫颈癌和子宫内膜癌的总和还要高,高居妇科恶性肿瘤的首位,对中国乃至全世界妇女的健康造成重大威胁 [1] [2]。但长期以来我们对卵巢癌分子发病机制的认识仍然比较缺乏,亟需开发对卵巢癌的早期诊断和治疗相关的分子标记物。
细胞外基质(Extracellular matrix, ECM)由基底膜和细胞间质构成,包含胶原蛋白、糖蛋白、多糖以及弹性蛋白等成分,对肿瘤细胞的转移发挥组织屏障作用。细胞外基质的变化对包括卵巢癌在内的多种恶性的发生和发展发挥重要作用,其可影响肿瘤细胞增值、分化、侵袭和转移等多种生物学过程。
MMP是依赖于锌离子(Zn2+)的肽链内切酶,它能够降解几乎所有的细胞外基质蛋白,进而对细胞外基质的改变和重塑发挥重要的调控作用 [3] [4] [5] [6]。距MMP家族的第一个成员MMP-1被发现已经有60余年的历史,到目前为止,在人类基因组中已经发现了24种MMP基因,在脊椎动物基因组中,发现了28种MMP基因。根据其结构域及底物的不同,又可以将MMP分为四大类:胶原酶、明胶酶、基质溶解素和膜型MMP。MMP不仅与细胞外基质的重塑(细胞外基质蛋白和细胞表面受体的降解)及肿瘤细胞的增殖、侵袭、转移和血管生成密不可分 [3] [4] [5],而且在炎症、动脉粥样硬化和心肌梗死等疾病的发生过程中也扮演着不可忽视的角色。
在过去的很长一段时间里,MMP被认为只在细胞外发挥作用,但是随着研究的不断深入,发现其在细胞内同样可以发挥内切酶功能,这极大地拓展了人们对MMP的认识。MMP-2是MMPs家族中第一个被发现在细胞内发挥内切酶作用的基因,在氧化应激损伤过程中,能够切割心肌细胞内的一些肌节蛋白。目前,除了MMP-2外,MMP-1、MMP-3、MMP-7、MMP-8、MMP-9、MMP-10、MMP-11、MMP-12、MMP-14、MMP-23和MMP-26等11种MMP定位于不同的亚细胞结构,如胞浆、肌节、线粒体和细胞核等。MMP的发现为多种疾病的治疗提供新的靶点 [6] - [11]。
MMP11是MMP家族基质溶解素亚家族的一员,主要表达于成纤维细胞和癌细胞,在肿瘤细胞、基质细胞和临近的肿瘤微环境中均能检测到它的存在,并在肿瘤微环境中发挥重要功能,它既能影响细胞外基质的结构,也能促进肿瘤的发生和发展,最早发现于乳腺癌细胞的基质细胞中 [11] [12]。与MMP家族中的其它成员不同,MMP11具有自身独特的生物学特征和功能 [11]:1) MMP11在细胞胞浆内被修饰加工,并以活性酶的形式分泌到细胞外,而大多数其它MMP则以无活性的酶原的形式被分泌到细胞外;2) MMP11不能水解MMP家族的传统底物(层粘连蛋白、纤维连接蛋白和弹性蛋白),但却对丝氨酸蛋白酶抑制剂α1-抗胰蛋白酶、胰岛素样生长因子结合蛋白1 (IGFBP-1)有很高的活性,并且能够诱导脂肪细胞的去分化和促结缔组织增生反应。研究发现,MMP11在多种实体瘤的血清和组织中存在过表达现象,如非小细胞肺癌、食管腺癌、胰腺癌、结肠癌和卵巢癌等。
已有研究表明,MMP11在细胞内通过与不同的信号通路发生相互作用,对肿瘤的发生发展过程发挥双重调节作用 [11] [12] [13] [14] [15]:1) MMP11蛋白通过抑制细胞凋亡促进肿瘤的增殖、侵袭和转移,这与MMP家族其它成员的功能类似;2) 一些动物模型实验显示,在肿瘤的早期和晚期阶段,MMP11能够抑制肿瘤的转移。所以,MMP11在实体瘤中的功能,还有待于进一步的研究。
本研究发现MMP11基因在卵巢癌细胞中表达上调且能明显促进卵巢癌细胞的增殖能力,这有助于增强我们对卵巢癌的发生和发展机制的认知。MMP11可以作为卵巢癌早期诊断和治疗的相关的生物标记物,也可以作为卵巢癌靶向/免疫治疗的潜在靶点。
2. 材料和方法
2.1. 细胞培养和RNAi实验
实验将采用常用的COV504 (浆液性卵巢癌细胞系)人卵巢癌细胞系,该细胞系购买自上海西格生物科技有限公司。COV504细胞系培养于添加了10%FBS、100 μg/mL青霉素和100 μg/mL链霉素的RPMI1640培养基(Life Technologies)。细胞置于含有5% CO2的37℃湿化培养箱中进行培养。
在RNAi实验中,使用Lipofectamine 2000进行siRNA转染,siRNA能够靶向干扰MMP11的表达,实验过程需设置阴性对照,siRNA将由RiboBio (广州,中国)合成。
2.2. RNA提取及荧光定量PCR实验
使用Trizol (Invitrogen)从组织和细胞中提取RNA,反转录实验使用PrimeScript RT Master Mix (Takara)。SYBR qPCR Mix (Toyobo)用于qRT-PCR,采用2−ΔΔCT法评估MMP11基因表达水平,β-actin基因用作内参基因。
2.3. Western Blotting
将细胞和组织裂解于RIPA缓冲液(100 mM Tris-HCl、300 mM NaCl、2%NP-40、0.5%脱氧胆酸钠),裂解液中添加蛋白酶混合物(Roche)。使用BCA蛋白浓度测定试剂盒(Thermo Fisher)测定蛋白浓度。将等量的蛋白用SDS-PAGE电泳分离后,转移到PVDF膜(Millipore),然后与以下蛋白对应的一抗在4℃条件下过夜孵育:MMP11 (Cell Signaling Technology, 8661; 1:1000稀释)和β-actin (Proteintech, 60004-1-Ig; 1:5000稀释)。过氧化物酶偶联的二抗购买于Proteintech公司(Rosemont)。蛋白条带将用化学发光并用Quantity One (Bio-Rad)进行定量,β-actin在Western blotting实验中用作内参。
2.4. CCK8实验
CCK8实验用于评估细胞的增殖能力,取对数生长期的细胞置于96孔板中(配置100 μL的细胞悬液),将培养板放在培养箱预培养一定时间(37℃,5% CO2),向每孔加入10 μL CCK8溶液(Dojindo),并37℃孵育4小时,用酶标仪测定450 nm波长的光吸收度。
2.5. 统计学分析
计量数据采用均数 ± 标准差(
)表示,并通过SPSS 25.0统计软件进行分析,计量数据组间比较采用配对t检验。所有统计结果均以P < 0.05认为差异具有统计学意义。
3. 结果
3.1. 卵巢癌临床样本MMP11基因的表达水平检测
我们前期收集到21例卵巢癌样本,并用qRT-PCR和Western blotting对卵巢癌组织和正常组织中MMP11的表达水平进行检测,发现相对于正常组织,肿瘤组织中MMP11的表达在RNA水平(图1(A))和蛋白水平(图1(B))都存在明显上调,t检验被用于数据的显著性分析,差异均具有统计学意义(RNA水平:P = 0.025;蛋白质水平:P = 0.031)。
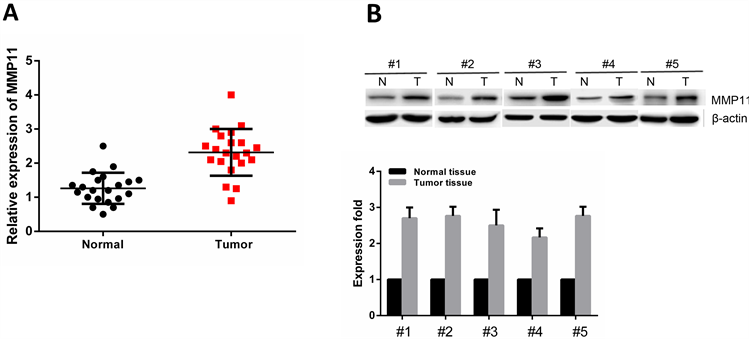
Figure 1. The expression level of MMP11 in clinical ovarian cancer samples. (A) The transcriptional level of MMP11 detected by qRT-PCR; (B) The protein level of MMP11 validated by Western blotting in 5 clinical ovarian cancer samples
图1. 卵巢癌临床样本MMP11基因表达水平检测。(A) qRT-PCR检测肿瘤组织中MMP11 mRNA转录水平;(B) Western blotting检测5例肿瘤组织MMP11蛋白表达水平
3.2. 卵巢癌shMMP11细胞系(MMP11基因稳定低表达)的构建
为了深入研究MMP11基因对卵巢癌细胞中细胞增殖能力的影响,我们利用RNAi敲除不同细胞系中(COV504) MMP11基因,得到了shMMP11细胞系,并通过qRT-PCR和Western blotting实验验证MMP11基因在对照组(shCtrl)和实验组(shMMP11)中MMP11基因的表达水平,结果显示,不论是在RNA水平还是蛋白水平,相对于对照组,实验组中MMP11基因的表达明显低于对照组,t检验被用于数据的显著性分析,差异均具有统计学意义(RNA水平:P = 0.0012;蛋白质水平:P = 0.0028)。结果表明已导入的shRNA降低了细胞系中MMP11基因的表达,并成功得到了MMP11基因低表达的shMMP11细胞系,这为后续MMP11基因的功能研究奠定了基础,具体实验结果如图2所示。
3.3. MMP11基因对卵巢癌细胞增殖能力的影响
为了深入研究MMP11基因对卵巢癌细胞增值能力的影响,我们借助CCK8实验,证实MMP11基因对COV504卵巢癌细胞系的增殖能力均具有显著的促进作用(图3),t检验被用于数据的显著性分析,差异有统计学意义(P = 0.003)。说明MMP11基因对卵巢癌的起始和发展过程发挥重要调控作用。
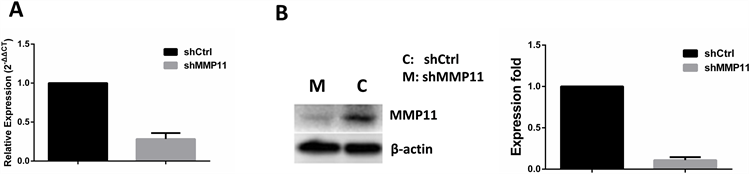
Figure 2. The expression level of MMP11 is down-regulated by RNAi. (A) The transcriptional level of MMP11 detected by qRT-PCR in shMMP11 cell lines; (B) The protein level of MMP11 performed by Western blotting in shMMP11 cell lines
图2. RNAi降低卵巢癌细胞系中MMP11基因表达水平。(A) qRT-PCR检测shMMP11细胞系中MMP11 mRNA转录水平;(B) Western blotting检测shMMP11细胞系中MMP11蛋白表达水平
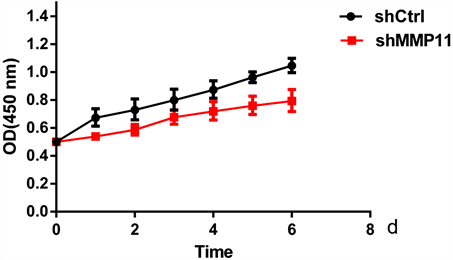
Figure 3. MMP11 gene elevates the growth ability of ovarian cancer cells
图3. MMP11基因促进卵巢癌细胞增殖能力
4. 讨论
MMP11基因是MMP家族的重要成员,在成纤维细胞和肿瘤细胞中都能表达,所以其既能影响细胞外基质的结构,在肿瘤微环境中发挥重要功能,也能在肿瘤细胞中发挥重要的功能。MMP11基因已经被证实在多种肿瘤细胞中存在过表达现象,如乳腺癌、肠癌等,同时,以MMP11为抗原的肿瘤疫苗的研究也取得了令人瞩目的临床效果 [15]。此外,一些生物信息学研究虽然已经证实MMP11基因在卵巢癌细胞中存在过表达现象 [10],但这些研究并未从生物学实验角度进一步验证该结论,而且并未涉及MMP11基因在卵巢癌细胞中的功能研究。在本文章中,我们利用分子生物学及细胞生物学方法,不仅分析了MMP11基因在卵巢癌临床样本及卵巢癌细胞系中的表达特征,同时对该基因对卵巢癌细胞增值能力的影响进行了研究,为卵巢癌的早期诊断和靶向/免疫治疗提供了一种可供选择的靶点。但MMP11基因对卵巢癌细胞其它生物学功能(如黏附能力、侵袭、转移和凋亡等)的影响还有待于进一步研究。总之,MMP11基因及细胞细胞生物学功能的研究不仅是对现有卵巢癌发生发展机制的完善,而且为卵巢癌的诊断和治疗提供新的理论基础。
致谢
感谢天津市卫生健康科技项目(项目编号:RC20189)对该文章的资金支持与帮助。
基金项目
天津市卫生健康科技项目(项目编号:RC20189)。
NOTES
*第一作者。
#通讯作者。