摘要: 病史摘要:患者,女性,69岁,因“头晕、呕吐伴行走不稳3小时”入院,发病后未行特殊处理。既往有“高血压病、糖尿病、胸闷”病史。症状体征:神志清,精神不振,言语流利,智能正常。双侧瞳孔等大等圆,对光反射灵敏,双眼各方向活动自如,眼球震颤(−),双侧鼻唇沟对称,伸舌居中,四肢肌力肌张力正常,无感觉障碍,双侧指鼻试验欠稳准,闭目难立征(+),容易前后倾倒,腱反射(++),病理征(−)。颈软,双侧克氏征(−)。诊断方法:脑干 + 小脑薄层MRI扫描未见异常。自身免疫性小脑共济失调抗体谱筛查提示抗浦肯野细胞2型抗体(PCA-2)血清和脑脊液均为阳性,滴度分别为1:10和1:30,患者诊断为抗PCA-2抗体相关自身免疫性小脑炎。治疗方法:患者入院后给予对症治疗,考虑存在糖尿病,未给予激素冲击及丙球治疗,给予丁螺环酮10 mg口服,每天3次,患者头晕及走路不稳逐渐改善,给予加用甲泼尼龙片每天20 mg口服,每周减1片,同时给予雷贝拉唑、氯化钾及维D钙片等药物辅助治疗。临床转归:患者接受激素治疗后头晕、走路不稳症状迅速改善,出院后病情进一步好转,嘱其随访异常肿瘤标志物的变化。
Abstract:
Patient Histories of Summary: The 69-year-old female patient was admitted to the hospital due to dizziness, vomiting and unstable walking for 3 hours, and had a history of hypertension, diabetes and chest tightness without special treatment after onset. Symptoms Signs: Conscious, languid, Verbal fluency, normal mental state, bilateral pupil big circle, sensitive to pupillary light reflex, eyes in each direction activities freely, nystagmus (−), nasolabial groove on both sides is symmetrical, tongue in the middle and normal muscle force and muscle strength of four limbs, no disorders of sensation, double side finger-to-nose test no steady, Romberg sign (+), easy to dump before and after, tendon reflex (++), pathologic sign (−). Soft neck, Kernig signs (−). Diagnostic Method: Thin-layer MRI scans of brainstem and cerebellum showed no abnormalities. Autoimmune cere-bellar ataxia antibody spectrum screening showed positive anti-purkinje cell type 2 antibody (PCA-2) in serum and cerebrospinal fluid with titers of 1:10 and 1:30, respectively, and the patient was diagnosed with anti-PCA-2-positive autoimmune cerebellitis. Therapy: Patients after admission to give symptomatic treatment, considering existing diabetes, not given hormone and gamma globulin treatment, give buspirone 10 mg orally, three times a day, patients with dizziness and walking instability gradually improve, to give every day with a prednisolone 20 mg orally, minus 1 piece per week, at the same time give rabeprazole, potassium chloride and vitamin D, calcium tablet drugs such as adjuvant therapy. Clinical Outcome: The patient’s symptoms of dizziness and unsteady walking improved rapidly after hormone therapy, and his condition improved further after discharge. Follow-up of abnormal tumor markers was ordered.
1. 引言
自身免疫性小脑炎(autoimmune cerebellitis, AC)又称自身免疫性小脑共济失调,是获得性小脑性共济失调的病因之一,多数是由各种抗神经抗体介导小脑炎性疾病。不同抗体介导的AC临床表型呈现多样性,对不同治疗方法的反应也不尽相同 [1]。随着对抗神经抗体谱临床意义认识的不断加深及检测技术的普及,对小脑性共济失调发生的病因和机制有了更深入的理解。与AC有关的抗神经抗体检测阳性结果有助于小脑性共济失调的精准诊断和治疗。现有关抗浦肯野细胞2型抗体(PCA-2)相关自身免疫性小脑炎的报道罕见。现就我科收治1例PCA-2抗体相关自身免疫性小脑炎报道如下。
2. 临床资料
2.1. 一般资料
患者,女性,69岁,主因“头晕、呕吐伴行走不稳3小时”于2021-10-20就诊于威海市中心医院神经内科。入院前3小时无明显诱因出现头晕,表现为持续性眩晕,视物旋转,伴周身乏力,行走不稳,不能独立行走,伴恶心及非喷射性呕吐,呕吐数次,均为非咖啡样胃内容物,睁眼、转头时头晕症状加重。在家未行特殊处理。既往有“高血压”病史10余年;“2型糖尿病”病史10余年;既往“胸闷”病史3年左右,曾于当地医院就诊未发现异常。个人史无特殊,无家族遗传病病史。
2.2. 检查结果
入院体格检查:神志清,精神不振,言语流利,智能正常。双侧瞳孔等大等圆,对光反射灵敏,双眼各方向活动自如,眼球震颤(−),双侧鼻唇沟对称,伸舌居中,四肢肌力肌张力正常,无感觉障碍,双侧指鼻试验欠稳准,闭目难立征阳性(睁闭眼),容易前后倾倒。腱反射(++),病理征(−),颈软,双侧克氏征(−)。
实验室检查:血常规、心肌酶、血凝、脑钠肽、肝功、血淀粉酶正常。血生化:尿素14.4 mmol/l,胆碱酯酶12.0 KU/L,肌酸激酶137 U/L,CK同工酶22.0 U/L,氯95.0 mmol/l,肌酐118 μmol/L,葡萄糖25.70 mmol/l,钠135.0 mmol/l。血糖:25 mmol/L。急诊/血气分析:葡萄糖24.4 mmol/l↑,血乳酸2.2 mmol/l↑,二氧化碳分压46.6 mmHg↑,氧分压112 mmHg↑;2021-10-21尿沉渣常规 + 镜检:红细胞计数34.1/μl↑,上皮细胞计数12.6/μl↑;血沉21 mm/h↑;糖化血红蛋白10.4(%),甲功五项:游离甲状腺素11.7 pmol/L↓,游离三碘甲腺原氨酸2.8 pmol/L↓;肌钙蛋白0.016 ng/ml↑;血生化:白蛋白34.1 g/L↓,磷1.55 mmol/l↑,肾小球滤过率44 ml/min↓,葡萄糖6.31 mmol/l↑,糖化白蛋白值27%↑,尿素13.8 mmol/l↑,肌酐108 μmol/L↑,尿酸559 μmol/L↑,胱抑素1.69 mg/L↑;血脂八项:总胆固醇7.63 mmol/l↑,甘油三酯7.49 mmol/l↑,同型半胱氨酸15.7 μmol/L↑,小而密低密度脂蛋白胆固醇1.21 mmol/l↑,低密脂胆固醇4.35 mmol/l↑,肿瘤标志物:人附睾蛋白241 pmol/l,CYFRA21-16.34 ng/ml。患者入院后出现发热,复查血常规 + Hs-CRP:中性粒细胞百分比91.4%↑,超敏C-反应蛋白5.34 mg/L↑;降钙素原0.626 ng/ml↑;行血培养提示双瓶革兰阴性杆菌阳性,给予哌拉西林他唑巴坦抗感染治疗后体温逐渐正常。

Figure 1. Thin layer MR scan of brain stem + cerebellum showed no abnormality
图1. 脑干 + 小脑薄层MR扫描未见异常
辅助检查:心脏彩超示左房增大、左室壁增厚、主动脉瓣钙化并关闭不全(轻度)、二尖瓣后瓣钙化并关闭不全(轻度)、三尖瓣反流(轻度)、左室舒张功能减低。双侧锁骨下动脉彩超未见明显异常。颈部血管彩超示双侧颈动脉内中膜增厚并多发斑块形成。头颅MRI示右侧小脑半球微出血灶,轻度脑动脉硬化。腹部CT提示双肾多发小结石,子宫内低密度灶,膀胱左后方条片状高密度影,结石?脑干 + 小脑薄层MRI扫描未见异常(图1)。胸部CT示双肺纹理增重。主动脉、心瓣膜区钙化。左侧乳腺密度不均,内见点状高密度影。腰穿检查:测脑压100 mmH2O (1 mmH2O = 0.098 kPa),脑脊液无色透明,脑脊液常规、生化均未见异常。自身免疫性小脑共济失调抗体谱筛查,包括抗接触蛋白关联蛋白2 (CASPR2)抗体IgG,抗Homer同源蛋白3 (homer protein homolog 3, Homer-3)抗体IgG,抗三磷酸腺苷酶α3 (ATP1A3)抗体IgG,Rho GTP酶激活蛋白26 (ARHGAP26)抗体IgG,抗氨甲酰化蛋白VII (CARP VII)抗体IgG,抗神经软骨蛋白抗体IgG,抗浦肯野细胞抗体2 (PCA-2) IgG,抗谷氨酸受体亚基δ2 (GluRδ2)抗体IgG。其中抗PCA-2抗体血清和脑脊液均为阳性,滴度分别为1:30和1:10 (图2)。
综上诊断:诊断为抗PCA-2抗体相关自身免疫性小脑炎,给予丁螺环酮10 mg口服,每天3次,患者临床症状稍有好转,给予甲泼尼龙片每天20 mg口服,每周减1片,患者头晕、走路不稳症状迅速好转。
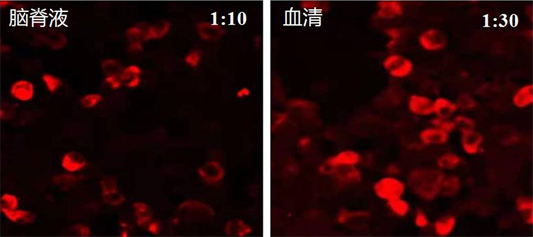
Figure 2. Immunohistochemical PCA-2 antibody titer
图2. 免疫组化PCA-2抗体滴度
3. 讨论
小脑在躯体和自主反射的适应控制、协调运动和认知功能等方面中起着关键作用 [2]。同时是神经系统的一个脆弱的自身免疫靶点,免疫介导的病理生理机制会影响小脑,导致出现进行性共济失调。免疫介导的小脑共济失调是由Charcot自1868年首次描述,它有多种病因,如麸质共济失调、感染后小脑炎、副肿瘤性小脑变性、肌阵挛肌综合征、抗GAD共济失调和原发性自身免疫性小脑共济失调等 [3]。AC则是获得性小脑性共济失调的主要病因之一。
小脑皮层是由相同的三层构成,在最外层分子层中包含有浦肯野细胞,它是小脑中唯一向下游小脑和前庭核发送信息的神经元。有着精致独特的树突。其轴突延伸到白质,之后再投射到小脑和前庭核。小脑接受的两条主要传入神经均汇聚在PC上,也是免疫攻击的靶结构之一 [4]。2000年Steven Vernino等在10例患者中鉴定出了一种新型的副肿瘤IgG,PCA-2。这10例患者的神经系统症状多种多样,5例表现为脑干或边缘叶脑炎,3例小脑共济失调,2例Lambert-Eaton肌无力综合征,1例自主神经病变,1例运动神经病变。多数伴有转移性小细胞肺癌。应用免疫治疗后,症状均有好转 [5] [6]。对于病变造成的功能损害可通过神经修复策略治疗 [7]。PCA一般有3种亚型,包括PCA-2、PCA-1和PCA-Tr。PCA-1主要是卵巢癌或乳腺癌引发免疫反应的标志物。PCA-Tr则是最早由John L. Trotter博士研究发现并描述的浦肯野细胞浆抗体,为霍奇金淋巴瘤免疫反应标志物 [8]。PCA-1能够以粗颗粒状模式与浦肯野神经元的细胞质、分子层神经元的外周细胞质结合,并与颗粒层的高尔基神经元结合,也能够与及肠道神经元结合 [9]。而PCA-Tr仅与小脑浦肯野细胞结合。PCA-2能够与小脑浦肯野神经元及树突、内部颗粒层和齿状核中的神经元结合。在外周神经系统中,它也能够与肾小动脉相关的神经元成分及肠道平滑肌中神经元结合。
北京协和医院任海涛团队对400例小脑性共济失调患者进行AC抗体谱筛查,含包括抗谷氨酸脱羧酶65 (glutamic acid decarboxylase 65, GAD65)、锌指蛋白4 (zinc finger protein 4, ZIC4)、Tr [delta/notch样表皮生长因子相关受体(delta/notch-like epidermal growth factor-related receptor, DNER)]、三磷酸肌醇受体1 (inositol 1,4,5-trisphosphate receptor 1, ITPR1)、Homer-3、神经软骨素(neurochondrin, NCDN)、碳酸酐酶相关蛋白VIII (carbonic anhydrase-related protein VIII,CARP VIII)和PCA-2抗体。通过筛查发现8例抗神经抗体阳性病例,其中抗PCA-2抗体阳性仅1例 [10]。目前国内外抗PCA-2抗体相关自身免疫性小脑炎的报道很罕见。
本例患者为急性起病,主要表现为头晕、呕吐及行走不稳。无智能减退、癫痫、脑干受累等边缘叶脑炎和脑干脑炎的表现。住院期间多次出现恶心、呕吐,出现畏寒、发热等症状,行血培养提示双瓶革兰阴性杆菌阳性,诊断脓毒血症,给予哌拉西林他唑巴坦抗感染治疗后好转。腹部彩超示脂肪肝、脾大、左肾结石、左肾小囊肿、膀胱壁厚、毛糙。脑干 + 小脑薄层MR扫描未见异常。脑电图正常。自身免疫性小脑共济失调抗体谱检测发现抗PCA-2抗体血清和脑脊液均为阳性。既往一般认为抗PCA-2抗体是副肿瘤综合征相关抗体,为除外潜在的肿瘤,女性肿瘤标志物筛查发现人附睾蛋白241 pmol/l,CYFRA21-16.34 ng/ml。虽然人附睾蛋白数值显著升高,但胸部、腹部CT及各脏器彩超检查未发现肿瘤证据。患者接受激素治疗后病情迅速改善,出院时行走稳健,无头晕及恶心等不适。神经系统查体未见阳性体征。该患者诊断为抗PCA-2抗体相关自身免疫性小脑炎,主要临床表现为共济失调,推测与PCA-2抗体攻击小脑浦肯野纤维细胞有关。小脑浦肯野细胞是从小脑皮质发出的唯一能够传出冲动的神经元,其轴突穿过颗粒层和白质到达深层小脑核团,浦肯野细胞在协调中起着重要的作用。另外该患者接受激素治疗后临床症状改善较快,且临床病程短,推测可能与血清及脑脊液PCA-2抗体滴度不高有关,但仍存在复发的可能。因PCA-2一般认为是副肿瘤标志物,因此嘱其门诊随诊,注意复查肿瘤标志物人附睾蛋白水平的变化及妇科彩超等。
综上,抗PCA-2抗体相关自身免疫性小脑炎是一类可治疗的疾病,早期确诊、尽早治疗能防止浦肯野细胞发生不可逆性损伤,从而阻止临床症状进展。同时对于自身免疫性小脑炎要排除潜在的肿瘤。注意定期复诊、随访,观察、评估治疗效果。虽然病情改善,鉴于自身免疫相关疾病的反复迁延特性,是否会发生小脑进行性萎缩,仍需要长期影像学随访。
基金项目
齐鲁卫生与健康领军人才培育工程专项(2020~2025)。
NOTES
*通讯作者。